2. 昆明医科大学医学机能实验中心,云南 昆明 650500
2. Experimental Center of Medical Function, Kunming Medical University, Kunming 650500, China
单肺通气(OLV)是目前临床广泛运用的一种机械通气模式,但它会引起肺损伤[1-4]。由于通过阻断疾病的早期关键病理环节以达到治疗目的,是难度系数最低、康复效果最理想的方法。所以,从肺微血管内皮细胞(PMVEC)通透性增加这一机械通气致肺损伤的早期关键病理变化环节[4-5]入手,阐明其机制,找寻药物干预作用靶点,是临床防治OLV致肺损伤最科学的方法。
我们前期的动物实验研究发现,OLV可使实验动物肺内白三烯B4 (LTB4)大量生成[6];体外高通量基因芯片筛查发现,LTB4可使体外培养兔PMVEC磷脂酶Cεl(PLCE l)表达水平明显增高,细胞通透性增加。由于LTB4被认为是目前发现最为强效的炎症介质之一[7],并在机体众多的炎症性疾病中发挥重要作用[8-11]。短暂的接触LTB4即可造成血管内皮细胞损伤以致血管通透性增加[12]。据此我们提出科学假设:LTB4致OLV兔PMVEC通透性增加的机制与其上调PLCE1表达有关。
此外,由于LTB4是5-脂氧化酶代谢产物白三烯A4经由白三烯A4水解酶(LTA4H)直接代谢生成[7]。但目前并不清楚OLV是否还可通过上调LTA4H表达使肺内LTB4生成增多。为此,本研究拟在OLV致兔肺损伤动物模型上,通过观察肺组织LTA4H表达变化,并探讨LTA4H抑制剂乌苯美司预处理减少肺内LTB4生成对肺组织PLCE1表达变化的影响,从LTB4的生成和作用途径进一步阐明LTB4致OLV兔PMVEC通透性增加的作用机制。
1 材料和方法 1.1 材料多功能麻醉机(Aestiva/5 7900,Datex Ohmeda. Inc);麻醉监护仪(S/5 Compact,通用电器医疗集团);多参数心电监护仪(M8003A,飞利浦公司);酶标仪(Model NO 550,BIO RAD);显微照相系统(DM4000B,LEICA);48只健康日本大耳白兔,体质量2.2~2.5 kg,雌雄不拘,购自昆明医科大学实验动物中心。LTB4检测试剂盒(武汉优尔生,CEA562Ge);PLCE1抗体(Biorbyt, orb335375);LTA4H (santa cruz,sc-23070)和MLCK抗体((abcam,ab130135);GAPDH抗体(abmart, M20006);HRP抗山羊二抗(santa cruz,sc-2354);乌苯美司(abmole,M1883)。本研究项目获云南省第一人民医院医学伦理委员会批准通过(2015LH026)。
1.2 方法 1.2.1 实验设计实验动物随机均分为:对照组(C组)、生理盐水预处理组(S组)、(乌苯美司+生理盐水)预处理组(B组)、单肺通气组(O组)、生理盐水预处理+单肺通气组(SO组)和(乌苯美司+生理盐水)预处理+单肺通气组(BO组)。
1.2.2 乌苯美司的给予方法参照Chen等[13]和我们之前预实验的方法,将乌苯美司以2 mg/mL的浓度溶于生理盐水中,用橡胶导管法对B组和BO组进行每天1次的乌苯美司溶液(4 mL/kg)灌胃操作。S组和SO组以4 mL/kg的生理盐水灌胃。以上4组均持续灌胃5天。C组和O组不行灌胃处理。
1.2.3 单肺通气和术中监测及麻醉维持方法麻醉诱导,单肺通气和术中监测的方法同我们之前研究[6],以恒速输注丙泊酚(0.6 mg·kg-1·min-1)和瑞芬太尼(1 μg·kg-1·min-1),每30 min追加维库溴铵0.1 mg·kg-1维持麻醉。
1.2.4 PMVEC通透性的评价方法 1.2.4.1 肺湿/干重(W/D)比值靠右肺上叶内1/2外侧缘处切取重约2~3 g肺组织,记录湿重(W)之后将标本置于干燥箱内(80 ℃,72 h),充分干燥至恒重后再次称重(D),计算W/D比值。
1.2.4.2 肺通透性指数测定右肺下叶支气管-肺泡灌洗液(BALF)中总蛋白浓度与血清总蛋白浓度之比为肺通透性指数。血清及BALF中的总蛋白测定采用二喹啉甲酸(BCA)法。
1.2.4.3 PMVEC通透性分子标志物的测定肌球蛋白轻链激酶(MLCK)的激活被认为是反映PMVEC通透性增加的分子标志物[14]。因此本研究运用Western blot和定量PCR分别检测右肺中间两叶MLCK蛋白和mRNA表达水平反映PMVEC通透性增加情况,具体方法见1.2.7。
1.2.5 肺组织学评分靠右肺上叶外1/2内侧缘处切取肺组织,行HE染色。切片由一不知情的病理学专业技术人员参照之前[6, 15]的方法在光学显微镜下对肺组织进行形态学评分。
1.2.6 肺组织LTB4含量的测定ELISA检测右肺上叶LTB4含量,具体方法按试剂盒说明书进行。
1.2.7 Western blot和Q-PCR实验取右肺中间两叶,分别运用Western blot和Q-PCR检测实验动物肺组织MLCK、LTA4H和PLCE1蛋白及其mRNA表达水平。
1.2.7.1 Western blot实验取肺组织100 mg,加入1 mL组织裂解液,电动匀浆后BCA法测定蛋白浓度。各样本均恒上样量70 μg,60 V电压电泳30 min,90 V电压电泳40 min,100 V电压湿转法转膜2 h。TBST充分洗膜。室温封闭1 h,加入对应浓度的一抗(MLCK,1: 500;LTA4H,1:500;PLCE1,1:200;GAPDH,1:2000),4 ℃孵育过夜。洗膜后加入HRP标记二抗(1:2000),室温孵育1 h。TBST漂洗PVDF膜4次,每次5 min。将配置好的HRP底物显色液滴加到PVDF膜上,采用化学发光仪(Bio-Rad)采集图片,所得图片用Image J软件分析灰度值。
1.2.7.2 Q-PCR实验取重约100 mg的肺组织,提取组织总RNA。各组等量RNA上样,SYBR Green Master Mix试剂盒(Kapa公司)进行Q-PCR实验。PCR反应引物见表 1。Q-PCR反应体系:上下游引物各0.5 μL,cDNA 1 μL,SYBR Green Mix 5 μL,无RNA酶的去离子水3 μL。反应条件:95 ℃ 30 s预变性,95 ℃ 5 s,60 ℃ 30 s,40个循环。用GAPDH为内参进行校正,以正常组(C组)为对照组,得到目的基因表达的(Ct)值,以2-ΔΔCt计算各样品表达量的相对值。
| 表 1 基因名称及其引物序列 Table 1 Primers used to amplify LTA4H, PLCE1 and MLCK |
所有数据为计量资料,以均数±标准差表示,采用SPSS 18.0软件进行统计学分析。多组间比较采用单因素方差分析,两两比较采用SNK法,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组PMVEC通透性变化与C组相比,S组和B组实验动物PMVEC通透性评价指标[肺W/D比值(图A),肺通透性指数(图B)和MLCK蛋白(图C1、C2)及mRNA表达水平(图D))无显著性差异,但O组和SO组实验动物PMVEC通透性评价指标均显著增高(P < 0.05),且后二者间相比无显著性差异;BO组实验动物PMVEC通透性评价指标明显低于O组和SO组(P < 0.05,图 1)。
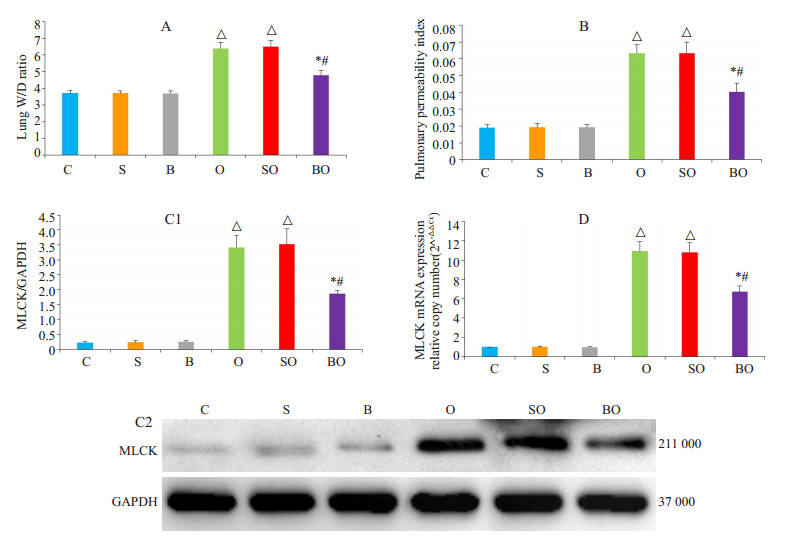
|
图 1 各组动物肺微血管内皮细胞通透性评价指标 Figure 1 Lung W/D ratio (A), pulmonary permeability index (B), MLCK protein expression (C1 and C2), and MLCK mRNA (D) of the rabbits in different groups for evaluating PMVEC permeability. C: Control group; S: Saline pretreatment group; B: Bestatin plus saline preatreatment group; O: OLV group; SO: Saline pretreatment plus OLV group; BO: Bestatin plus saline pretreatment with OLV group. *P < 0.05 vs O group, #P < 0.05 vs SO group, △P < 0.05 vs BO group. |
C组、S组和B组实验动物肺组织部分区域见毛细血管扩张充血、肺泡腔内少量炎症细胞外,无明显病理改变。O组与SO组动物肺组织可见大量出血、充血灶,肺泡腔内较多红细胞和炎症细胞浸润,肺泡壁明显充血、增厚和渗出。BO组上述肺组织病理学改变较O组和SO组明显减轻(图 2)。
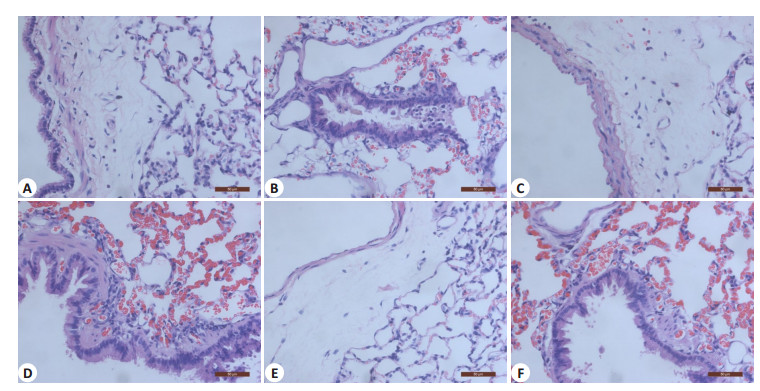
|
图 2 各组动物肺组织HE染色 Figure 2 Lung histology in different groups (HE staining, original magnification: ×200). A: Group C; B: Group S; C: Group B; D: Group O; E: Group SO; F: Group BO. |
与C组相比,S组实验动物肺组织LTA4H和PLCE1表达水平(蛋白及mRNA)无显著性差异,B组实验动物LTA4H表达水平明显下降(P < 0.05),PLCE1表达水平无显著改变,但O组与SO组实验动物肺组织LTA4H和PLCE1表达水平均显著增加(P < 0.05),且后二者间无显著性差异;与O组相比,BO组实验动物肺组织LTA4H表达水平明显下调(P < 0.05),同时伴有PLCE1表达水平的显著降低(P < 0.05,图 3)。
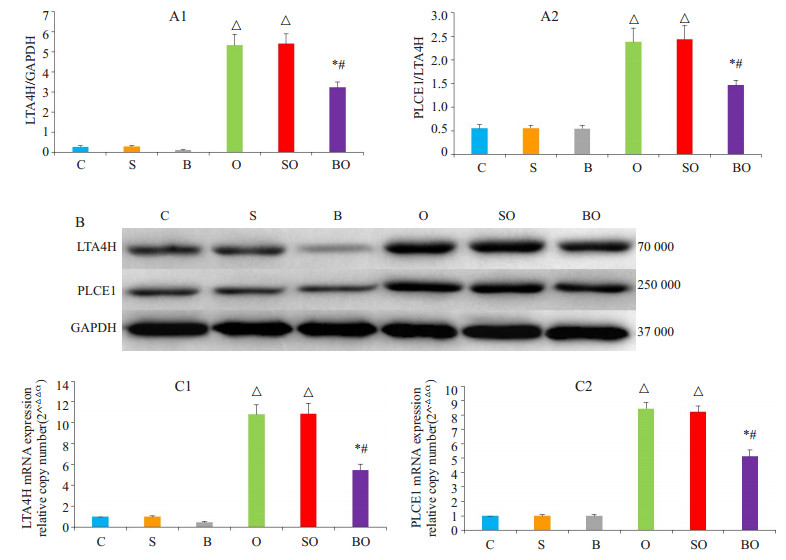
|
图 3 各组动物肺组织LTA4H和PLCE1蛋白及mRNA表达变化 Figure 3 Expressions of LTA4H and PLCE1 proteins (A1, A2 and B), LTA4H mRNA (C1) and PLCE1 mRNA (C2) in rabbit lung tissues in different groups. * vs O group P < 0.05. # vs SO group P < 0.05. △ vs BO group P < 0.05. |
与C组相比,S组和B组实验动物肺内LTB4含量及肺组织学评分无显著性差异,但O组和SO组上述指标均均显著增高(P < 0.05),且后二者间无显著性差异;与O组和SO组相比,BO组实验动物肺内LTB4的含量及肺组织学评分明显降低(P < 0.05,图 4)。
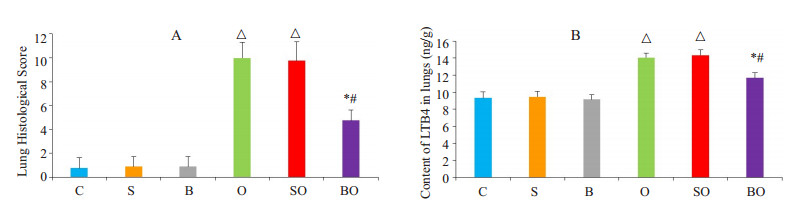
|
图 4 各组动物肺组织学评分和肺内LTB4含量 Figure 4 Histological scores (A) and LTB4 content (B) in rabbit lungs in different groups. * vs O group P < 0.05. # vs SO group P < 0.05. △ vs BO group P < 0.05. |
本研究发现,单纯给予乌苯美司未引起实验动物出现不良副作用,这与他人研究相同[13, 16]。单肺通气实验动物肺组织LTA4H表达水平增高,肺内LTB4生成增多,同时伴有PMVEC通透性(肺W/D比值、肺通透性指数和MLCK表达水平)和肺组织学评分的明显增加;运用LTA4H抑制剂乌苯美司下调LTA4H表达后,实验动物肺内LTB4生成明显减少,PMVEC通透性下降、肺损伤明显减轻。由于LTB4具有强烈促血管通透性增加作用[12, 17],且是LTA4H的唯一直接代谢产物[18]。这一研究结果提示,单肺通气可上调LTA4H表达使肺内LTB4生成增多继而引起PMVEC通透性增加和肺损伤。同时提示,LTA4H可作为抗单肺通气致PMVEC通透性增加的药物干预作用靶点。
研究还发现,单肺通气实验动物肺内LTB4生成增多的同时伴有肺组织PLCE1表达水平的显著增高和PMVEC通透性的明显增加。运用乌苯美司减少肺内LTB4生成后,单肺通气实验动物肺组织PLCE1表达水平明显下降,PMVEC通透性降低。这一研究结果提示,LTB4致单肺通气实验动物PMVEC通透性增加的机制与上调PLCE1表达有关。由于PLCE1可被受体酪氨酸激酶(如表皮生长因子、血管内皮生长因子、神经生长因子、血小板生长因子等)和G蛋白偶联受体激活[19-21],而LTB4的生物学活性作用主要通过G蛋白偶联受体超家族来实现[7, 22],在肝脏缺血再灌注损伤修复的研究中发现,LTB4与其1型受体结合后可上调表皮生长因子和血管内皮生长因子表达,引起巨噬细胞募集[23]。据此推测LTB4上调OLV实验动物肺组织PLCE1表达的机制可能与其上调表皮生长因子和血管内皮生长因子表达和G蛋白偶联受体超家族有关。
除此之外,单肺通气实验动物肺组织PLCE1表达水平增高的同时伴有肺组织MLCK表达水平的明显增加;PLCE1表达水平降低时,MLCK表达水平也明显降低。由于PLCE1具有鸟嘌呤核苷酸交换因子的功能,可以使Ras家族GTP酶从无活性的Ras-GDP转变为有活性的Ras-GTP,从而激活其下游的信号调节通路[19, 24]。Ras家族中,RhoA主要参与应力纤维的形成和黏着斑复合体的组装。活化的RhoA可激活MLCK,继而引起肌动蛋白-肌球蛋白收缩和横向细胞肌动蛋白束(应力纤维)形成,最终导致细胞收缩和内皮细胞屏障功能破坏[14, 25]。这些研究结果提示,单肺通气可通过上调PLCE1表达水平继而引起PMVEC通透性增加,而PLCE1调控PMVEC通透性的机制可能与RhoA/ MLCK信号通路有关。
综上所述,我们首次证实了:(1)OLV可通过上调LTA4H表达使肺内LTB4大量生成,继而引起PMVEC通透性增加和肺损伤;(2)LTB4可通过激活PLCE1/ MLCK信号通路引起OLV实验动物PMVEC通透性增加。本研究的不足之处在于对实验动物实施的是潮气量为20 mL/kg的“伤害性”通气模式,在目前临床普遍采用“非伤害性”通气模式的大环境下,该研究结果对临床的实际指导意义有限。因此,有必要进一步深入探讨花生四烯酸代谢途径关键酶及代谢产物在“非伤害性”通气模式中的作用。除此之外,对于LTB4调控PLCE1以及PLCE1调控MLCK信号通路的具体作用机制,均有待于进一步的深入阐明。
| [1] | Della Rocca G, Coccia C. Acute lung injury in thoracic surgery[J]. Curr Opin Anaesthesiol, 2013, 26(1): 40-6. DOI: 10.1097/ACO.0b013e32835c4ea2. |
| [2] | Kometani T, Okamoto T, Yoshida S, et al. Acute respiratory distress syndrome after pulmonary resection[J]. Gen Thorac Cardiovasc Surg, 2013, 61(9): 504-12. DOI: 10.1007/s11748-013-0276-7. |
| [3] | Şentürk M, Slinger P, Cohen E. Intraoperative mechanical ventilation strategies for one-lung ventilation[J]. Best Pract Res Clin Anaesthesiol, 2015, 29(3): 357-69. DOI: 10.1016/j.bpa.2015.08.001. |
| [4] | Lohser J, Slinger P. Lung injury after one-lung ventilation: A review of the pathophysiologic mechanisms affecting the ventilated and the collapsed lung[J]. Anesth Analg, 2015, 121(2): 302-18. DOI: 10.1213/ANE.0000000000000808. |
| [5] | Wang T, Gross C, Desai AA, et al. Endothelial cell signaling and ventilator-induced lung injury: molecular mechanisms, genomic analyses, and therapeutic targets[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 312(4): L452-L476. DOI: 10.1152/ajplung.00231.2016. |
| [6] | Liu R, Luo J, Li J, et al. Protective mechanisms of sevoflurane against one-lung ventilation-induced acute lung injury: role of cyclooxygenase-2 and 5-lipoxygenase pathways[J]. J South Med Univ, 2013, 33(5): 625-30. |
| [7] | Cornejo-García JA, Perkins JR, Jurado-Escobar R, et al. Pharmacogenomics of prostaglandin and leukotriene receptors[J]. Front Pharmacol, 2016, 7: 316. |
| [8] | Hoxha M. A systematic review on the role of eicosanoid pathways in rheumatoid arthritis[J]. Adv Med Sci, 2017, 63(1): 22-9. |
| [9] | Xia W, Xie L, Cao B, et al. Genes involved in leukotriene synthesis pathway are dynamically regulated during lung development in Rhesus monkeys[J]. Prostaglandins Leukot Essent Fatty Acids, 2017, 122: 1-6. DOI: 10.1016/j.plefa.2017.06.008. |
| [10] | Bouchareychas L, Grössinger EM, Kang M, et al. Critical role of LTB4/BLT1 in -23-Induced synovial inflammation and osteoclastogenesis via NF-κB[J]. J Immunol, 2017, 198(1): 452-60. DOI: 10.4049/jimmunol.1601346. |
| [11] | Said MM, Bosland MC. The anti-inflammatory effect of montelukast, a cysteinyl leukotriene receptor-1 antagonist, against estradiol-induced nonbacterial inflammation in the rat prostate[J]. Naunyn Schmiedebergs Arch Pharmacol, 2017, 390(2): 197-205. DOI: 10.1007/s00210-016-1325-4. |
| [12] | Bray MA, Ford-Hutchinson AW, Smith MJ. Leukotriene B4: an inflammatory mediator in vivo[J]. Prostaglandins, 1981, 22: 213-22. DOI: 10.1016/0090-6980(81)90036-8. |
| [13] | Chen X, Li N, Wang S, et al. Leukotriene A4 hydrolase in rat and human esophageal adenocarcinomas and inhibitory effects of bestatin[J]. J Natl Cancer Inst, 2003, 95(14): 1053-61. DOI: 10.1093/jnci/95.14.1053. |
| [14] | Birukov KG, Zebda N, Birukova AA. Barrier enhancing signals in pulmonary edema[J]. Compr Physiol, 2013, 3(1): 429-84. |
| [15] | Liu R, Yang Y, Li Y, et al. Effects of sevoflurane on pulmonary cytosolic phospholipase A2 and clara cell secretory protein expressions in rabbits with one lung ventilation-induced lung injury[J]. J South Med Univ, 2013, 33(4): 469-73. |
| [16] | Jia Y, Liu Z, Huo X, et al. Enhancement effect of resveratrol on the intestinal absorption of bestatin by regulating PEPT1, MDR1 and MRP2 in vivo and in vitro[J]. Int J Pharm, 2015, 495(1): 588-98. DOI: 10.1016/j.ijpharm.2015.09.042. |
| [17] | Finsterbusch M, Voisin MB, Beyrau M, et al. Neutrophils recruited by chemoattractants in vivo induce microvascular plasma protein leakage through secretion of TNF[J]. J Exp Med, 2014, 211(7): 1307-14. DOI: 10.1084/jem.20132413. |
| [18] | He C, Wu Y, Lai Y, et al. Dynamic eicosanoid responses upon different inhibitor and combination treatments on the arachidonic acid metabolic network[J]. Mol Biosyst, 2012, 8(5): 1585-94. DOI: 10.1039/c2mb05503a. |
| [19] | Smrcka AV, Brown JH, Holz GG. Role of phospholipase Cε in physiological phosphoinositide signaling networks[J]. Cell Signal, 2012, 24(6): 1333-43. DOI: 10.1016/j.cellsig.2012.01.009. |
| [20] | Dusaban SS, Brown JH. PLCε mediated sustained signaling pathways[J]. Adv Biol Regul, 2015, 57: 17-23. DOI: 10.1016/j.jbior.2014.09.014. |
| [21] | Dusaban SS, Purcell NH, Rockenstein E, et al. Phospholipase C epsilon links G protein-coupled receptor activation to inflammatory astrocytic responses[J]. Proc Natl Acad Sci USA, 2013, 110(9): 3609-14. DOI: 10.1073/pnas.1217355110. |
| [22] | Liu M, Yokomizo T. The role of leukotrienes in allergic diseases[J]. Allergol Int, 2015, 64(1): 17-26. DOI: 10.1016/j.alit.2014.09.001. |
| [23] | Ohkubo H, Ito Y, Minamino T, et al. Leukotriene B4 type-1 receptor signaling promotes liver repair after hepatic ischemia/reperfusion injury through the enhancement of macrophage recruitment[J]. FASEB J, 2013, 27(8): 3132-43. DOI: 10.1096/fj.13-227421. |
| [24] | Zhang RY, Du WQ, Zhang YC, et al. PLCε signaling in cancer[J]. J Cancer Res Clin Oncol, 2016, 142(4): 715-22. DOI: 10.1007/s00432-015-1999-x. |
| [25] | Chrzanowska-Wodnicka M, Burridge K. Rho-stimulated contractility drives the formation of stress fibers and focal adhesions[J]. J Cell Biol, 1996, 133(6): 1403-15. DOI: 10.1083/jcb.133.6.1403. |
 2017, Vol. 37
2017, Vol. 37

