2. 蚌埠医学院生理教研室,安徽 蚌埠 233030
2. Department of Physiology, Bengbu Medical College, Bengbu 233030, China
糖尿病作为一种常见的代谢性疾病,常伴慢性高糖血症和胰岛素减少或胰岛素抵抗。近年来,2型糖尿病发病率逐渐增高,长时间的糖脂类物质代谢紊乱可导致多个脏器发生病理生理改变,其中心脏病变最常见。糖尿病患者心梗后心衰发生率及死亡率是非糖尿病患者的2~4倍[1-2]。右美托咪定(DEX)是一种新型高选择性α2肾上腺能受体激动剂,有良好的镇静作用且不会产生呼吸抑制,是临床常用的镇静镇痛药。研究发现,右美托咪定通过减轻氧化应激反应,减少炎性介质释放减轻正常大鼠心脏缺血再灌注损伤[3],而对于糖尿病大鼠心肌缺血再灌注损伤的作用尚未见报道。本实验拟通过建立2型糖尿病大鼠模型,观察右美托咪定后处理对对照组及糖尿病大鼠心肌缺血再灌注损伤的作用,并分析炎症反应的改变。
1 材料和方法 1.1 动物与药品SPF级雄性SD大鼠140~160 g,由蚌埠医学院实验中心提供[动物合格证号:SC XK(沪)2013-0006]。盐酸右美托咪定注射液(批号:国药淮字H20110085,恩华药业),链脲佐菌素(批号:S0130,Sigma),伊文氏兰和2,3,5-氯化三苯基四氮唑(TTC)(批号:Sigma E-2129,Amresco 0765, biosharp)。大鼠血浆肌钙蛋白(Ⅰ CTnI)、白介素-6(IL-6)和肿瘤坏死因子-a(TNF-a)ELISA试剂盒(建成生物);白介素-10(IL-10)及白介素-1β(IL-1β)ELISA试剂盒(达科为生物)。
1.2 方法 1.2.1 复制2型糖尿病大鼠模型雄性SD大鼠65只适应性喂养7 d之后按随机数字表法分为正常组(n=30)和糖尿病组(n=35)。糖尿病组大鼠给予高脂高糖饲料(普通饲料74.5%,胆固醇0.5%,猪油10%,糖10%,蛋黄粉5%,购于南京市江宁区龙泉饲料经营部)喂养,4周后禁食12 h腹腔注射链脲佐菌素(溶于0.1 mol/L,pH4.5柠檬酸缓冲液)35 mg/kg[4],正常组大鼠腹腔注射等量柠檬酸缓冲液。72 h后针刺尾尖取血测空腹血糖(FBG)≥16.7 mmol/L,伴有多饮,多食,多尿症状为造模成功,继续高脂高糖饲料喂养,期间每周测1次血糖,血糖不达标剔除实验,4周后最终30只糖尿病大鼠进入后期实验。正常组大鼠普食喂养8周进入实验。
1.2.2 复制糖尿病大鼠心肌缺血-再灌注模型各组大鼠予4%水合氯醛(0.9 mL)腹腔注射,未使用肌松剂,麻醉后四肢插入电极针记录Ⅱ导联心电图,气管切开后接呼吸机,潮气量2.5 mL,呼吸频率70~80 min。颈总动脉插管后连接Med-Lab系统,记录心率和血压变化。股静脉留置导管用于术中补充生理盐水。开胸后用4-0的慕丝线在距离左冠状动脉前降支(LAD)根部4 mm处结扎,心电图可见ST段弓背向上抬高,为心肌缺血成功,持续30 min后解开慕丝线,再灌注维持120 min[6]。再灌注120 min后取出心脏,预冷生理盐水冲洗后滤纸吸干,称重全心质量。
1.2.3 TTC双染法测量大鼠心肌梗死面积大鼠再灌注维持120 min后取出心脏用预冷PBS溶液冲净残留血后再次结扎LAD,缓慢注入1%伊文氏兰0.3 mL,放入-80 ℃冰箱冷冻2 h后沿心脏纵轴垂直切成2 mm薄片,置于1% TTC溶液中37 ℃水浴箱避光染色20 min,再放于4%多聚甲醛溶液中固定。用Image-J软件测量相关区域面积,非梗死区为蓝染区域,梗死区为灰白色心肌(IS),红色为危险区(AAR),每个处理组最终取6只大鼠心脏进行染色,计算并统计IS/AAR变化。
1.2.4 大鼠血浆酶学指标及生化指标检测大鼠再灌注120 min后从颈总动脉取血3 mL于肝素抗凝管内,4 ℃,3000 r/min离心15 min,取上清置于1.5 mL EP管,-80 ℃保存。每个处理组取6只大鼠血浆样本进行检测,分光光度计测量血浆总胆固醇(TC)和甘油三酯(TG)含量,ELISA检测血浆CTnI、TNF-a、IL-6、IL-1β和IL-10浓度。
1.2.5 实验分组正常大鼠和造模成功的2型糖尿病大鼠各30只随机分为6组(n=10),假手术组(S组)、缺血-再灌注组(IR组)、右美托咪定后处理组(DP组)、糖尿病假手术组(DM-S组)、糖尿病缺血-再灌注组(DM-IR组)和糖尿病右美托咪定后处理组(DM-DP组)。假手术组:只穿线不结扎维持150 min;缺血再灌注组:缺血30 min,再灌注120 min,再灌注前5 min尾静脉注射等量生理盐水;右美托咪定后处理组:再灌注前5 min经尾静脉注射右美托咪定10 μg/kg[5]。
1.3 统计分析采用均数±标准差统计各实验数据,统计软件采用SPSS18.0多组间比较采用One-way ANOVA方法,两两比较采用LSD法检验,两组对比采用t检验方法,P<0.05为差异具有统计学意义。
2 结果 2.1 各组大鼠一般情况比较与正常大鼠相比,糖尿病大鼠体质量(BW)减轻(P<0.01),全心质量(HW)减轻(P<0.01),FBG、TC和TG明显增高(P<0.01),饮食、饮水、尿量均增加,毛色変黄且容易脱落(表 1、2)。
| 表 1 正常大鼠与糖尿病大鼠一般情况比较 Table 1 Baseline body weight (BW), heart weight (HW) and the heart/body weight ratio (H/B) in normal and diabetic rats (Mean±SD, n=30) |
| 表 2 正常大鼠与糖尿病大鼠FBG、TC和TG的变化 Table 2 FBG, TC and TG at baseline in normal and diabetic rats (Mean±SD, n=30) |
S组和DM-S组相比,各个时间段的MAP、HR和RPP均无统计学差异(P>0.05)。各组大鼠MAP、HR和RPP的基础值差异无统计学意义(P>0.05);与S组比较,IR和DP在缺血期和再灌注期MAP、HR和RPP降低(P<0.05),与DM-S组比较,DM-IR和DM-DP在缺血期和再灌注期MAP、HR和RPP降低(P<0.05);除S组和DM-S组外,各组在缺血及再灌注期MAP、HR和RPP均降低(P<0.05);与IR比较,DP于缺血30 min及再灌注30 min,MAP、HR和RPP呈下降趋,但复灌120 min回升(P<0.05);与DM-IR比较,DM-DP缺血30 min及再灌注30、120 min时MAP、HR和RPP差异没有统计学意义(P>0.05,表 3)。
| 表 3 各组大鼠不同时间MAP、HR和RPP的比较 Table 3 Comparison of MAP, HR and RPP at different time points among the groups (Mean±SD, n=6) |
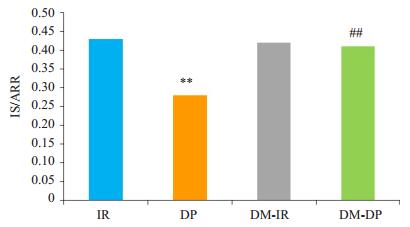
与IR组比较,DP组IS/ARR显著降低(P<0.01),与DP组比较,DM-DP组IS/ARR明显升高(P<0.01)。
|
图 1 各组大鼠心肌梗死面积比较 Figure 1 Comparison of IS/ARR among the groups (Mean±SD, n=6). IR: Ischemia reperfusion group; DP: Dexmedetomidine postconditioning group; DM-IR; Diabetic ischemia reperfusion group; DM-DP: Diabetic dexmedetomidine postconditioning group.**P < 0.01 vs IR, ##P < 0.01 vs DP. |
S组与DM-S组相比,血浆CTnI、TNF-a、IL-6、IL-1β和IL-10浓度差异无统计学意义(P>0.05);与S组相比,IR、DP组血浆CTnI、TNF-a、IL-6、IL-1β和IL-10浓度升高(P<0.05);与DM-S组相比,DM-IR、DM-DP组血浆CTnI、TNF-a、IL-6、IL-1β和IL-10浓度升高(P<0.05);与IR相比,DP组CTnI、TNF-a、IL-6和IL-1β浓度降低,IL-10浓度升高(P<0.05);与DP相比,DM-DP组CTnI、TNF-a、IL-6和IL-1β浓度进一步升高(P<0.05);DM-IR与DM-DP组以上指标没有统计学差异(P>0.05,表 4)。
| 表 4 各组大鼠血浆CTnI、TNF-a、IL-6、IL-1β和IL-10含量比较 Table 4 Comparison of plasma CTnI, TNF-a, IL-6, IL-1β and IL-10 levels among the groups (Mean±SD, n=6) |
心肌缺血再灌注损伤是指给予缺血区组织恢复血流后损伤反而加重的现象,许多研究表明再灌注前给予麻醉药物可减轻心肌缺血再灌注损伤[6-8]。近几十年来,糖尿病发病率呈现递增的趋势,糖尿病患者并发冠心病的几率显著高于非糖尿病患者[1]。血糖升高后可通过激活体内炎症反应,氧化应激反应,促使心肌纤维化等途径改变心肌细胞结构和功能[9-11]。关于糖尿病对心肌缺血再灌注损伤的耐受程度说法不一。有研究认为糖尿病大鼠心肌缺血再灌注损伤程度比非糖尿病大鼠严重[12-13]。而Malfitano[14]与Chu[15]等则认为糖尿病大鼠心肌缺血再灌注损伤程度轻于非糖尿病大鼠。本课题组前期实验结果显示,右美托咪定通过PI3K/Akt通路对大鼠心肌缺血再灌注损伤产生保护[16]。本实验中非糖尿病组大鼠给予右美托咪定处理后,其血浆炎性因子含量,心肌梗死面积变化提示右美托咪定可以对抗大鼠心肌缺血再灌注损伤发挥保护作用,同前期实验结果一致。
采用改良的药物后处理方法,再灌注前5分钟给予右美托咪定10 μg/kg[5, 16],观察右美托咪定后处理对心肌缺血再灌注损伤的保护作用。本实验通过MAP、HR和RPP反映心脏收缩和舒张功能。记录结果显示除S组外,各组大鼠心肌缺血30 min、再灌注30 min及120 min时MAP、HR和RPP显著低于基础值,说明发生缺血再灌注后心功能降低;与IR组比较,DP组MAP、HR和RPP在缺血30 min,再灌注30 min降低,再灌注120 min时心功能有所恢复,说明DEX可以改善心功能。与DM-IR比较,DP组MAP、HR和RPP在缺血30 min,再灌注30 min降低,再灌注120 min时MAP、HR和RPP无明显变化,提示DEX对糖尿病心功能损伤无明显改善。
CTnI特异性高且仅存在于心肌组织,是心肌损伤的敏感性标记物[17]。本实验结果显示,与S组和DM-S比较,IR和DM-IR组血浆CTnI浓度明显增高,提示缺血导致了心肌细胞发生损伤;与S组比较,DM-S组血浆CTnI浓度升高,提示糖尿病4周大鼠心肌细胞发生损伤。相对于IR组,DP组血浆CTnI浓度下降,提示DEX后处理可减轻心肌细胞损伤。与DM-IR组相比,DMDP组CTnI降低但差异无统计学意义,提示糖尿病削弱了DEX对心肌缺血再灌注损伤的保护作用。
炎症反应是参与心肌缺血再灌注损伤过程的机制之一,抑制炎症反应可以减少心肌梗死面积,减轻心肌缺血再灌注损伤从而改善心功能[18-19]。TNF-α、IL-6、IL-1β和IL-10等炎性介质在炎症反应中发挥重要作用。心肌缺血再灌注过程中TNF-α、IL-6等炎性因子大量释放。TNF-α是创伤后机体发生炎症反应的始发因子,激活细胞因子产生级联反应,促进生成氧自由基,激活巨噬细胞进而激活IL-1、IL-6、IL-8、TNF-α和PGE2等炎性因子,加重心肌缺血-再灌注损伤[20-21]。IL-6主要由活化的中性粒细胞产生,其释放量与心肌损伤程度呈正相关[21]。吴付轩等[22]给予兔心肌缺血再灌注模型使用IL-6单克隆抗体后,发现中性粒细胞在心肌中的聚集范围变小,同时心肌梗死面积减小,提示心肌缺血与再灌注时激活中性粒细胞释放IL-6,抑制IL-6的释放可以改善心肌损伤。IL-1β是IR损伤早期炎症介质,IR可诱发心肌产生IL-1β,IL-1β的释放可导致相关的急性炎症反应发生,同时IL-1β分泌也加重心肌缺血再灌注损伤[23]。IL-10为具有代表性的内源性抗炎因子之一,可抑制TNF-α、IL-8等炎性细胞因子的产生,从而减轻组织炎症反应[24]。研究表明,糖尿病状态下,心肌发生缺血再灌注后炎症反应的发生率明显增高[12]。本实验DM-S组TNF-α、IL-6、IL-1β和IL-10浓度均比S组高,提示糖尿病可促使炎性细胞的激活。相对于IR组,DP组血浆TNF-α、IL-6和IL-1β浓度降低,IL-10浓度增高,提示DEX可减轻心肌缺血再灌注引起的炎症反应,与Huang等[25]研究结果类似。与DM-IR组相比,DM-DP组血浆TNF-α、IL-6和IL-1β浓度下降,IL-10浓度升高,但差异无统计学意义,提示DEX用于糖尿病大鼠模型上没有产生抗炎作用。与DP组比较,DM-DP组TNF-α、IL-6和IL-1β浓度升高,提示DEX没有改善糖尿病状态下心肌缺血再灌注引起的炎症反应。Zeng等[26]发现DEX减少血浆TNF-α、IL-6含量,改善氧化应激水平,对糖尿病大鼠脑缺血再灌注损伤发挥保护作用。在本实验中,我们观察到与缺血组比较,DEX没有明显改变糖尿病大鼠血浆TNF-α、IL-6含量,该研究结果与章雨雯[6]等研究类似。右美托咪定后处理对糖尿病大鼠心肌缺血再灌注后炎症因子的影响及具体机制还有待进一步探索。
多种刺激因素最终通过诱导氧化应激反应、激活炎症反应导致心肌损伤,诱发心肌梗死的形成[27]。有研究指出,给予IL-1β、TNF-α抑制剂FR167653后,可在mRNA水平上减少IL-1β、TNF-α的释放,从而减少心肌梗死面积,改善缺血再灌注后心肌损伤[28]。心肌梗死面积可一定程度上反映心肌缺血再灌注损伤程度。本实验结果显示与IR组比较,DP组大鼠心肌梗死面积显著减少,与吴志林等[3]研究结果一致,提示DEX后处理对正常大鼠心肌缺血再灌注损伤有一定的保护作用;DMIR与DM-DP组比较无明显差异,提示DEX后处理不能改善糖尿病大鼠的心肌梗死面积。
综上所述,DEX改善血流动力学指标,降低TNF-α、IL-6和IL-1β等促炎因子的释放,促进抑炎因子IL-10的生成,减少心肌梗死面积,对正常大鼠心肌缺血再灌注损伤具有保护作用,但对糖尿病状态下的心肌缺血再灌注损伤时心肌梗死面积、炎症介质的释放无明显影响。糖尿病本身可引起心肌损伤,在此基础上发生心肌缺血再灌注使得损伤进一步加重,有必要后期探索更有效的干预措施。
| [1] | Ansley DM, Wang BH. Oxidative stress and myocardial injury in the diabetic heart[J]. J Pathol, 2013, 229(2): 232-41. DOI: 10.1002/path.4113. |
| [2] | Peake BF, Nicholson CK, Lambert JP, et al. Hydrogen sulfide preconditions the db/db diabetic mouse heart against ischemiareperfusion injury by activating Nrf2 signaling in an Erk-dependent manner[J]. Am J Physiol Heart Circ Physiol, 2013, 304(9): H1215-24. DOI: 10.1152/ajpheart.00796.2012. |
| [3] | 吴志林, 褚淑娟, 姚尚龙, 等. 不同剂量右美托咪定预处理对大鼠心肌缺血再灌注损伤以及炎症反应的影响[J]. 华中科技大学学报:医学版, 2015, 44(4): 445-7. |
| [4] | Zhang Y, Hu T, Zhou H, et al. Antidiabetic effect of polysaccharides from Pleurotus ostreatus in streptozotocin-induced diabetic rats[J]. Int J Biol Macromol, 2016, 83: 126-32. DOI: 10.1016/j.ijbiomac.2015.11.045. |
| [5] | Lempi?inen J, Finckenberg P, Mervaala EE, et al. Dexmedetomidine preconditioning ameliorates kidney ischemia-reperfusion injury[J]. Pharmacol Res Perspect, 2014, 2(3): e00045. DOI: 10.1002/prp2.45. |
| [6] | 章雨雯, 顾尔伟, 张雷, 等. 糖尿病因素取消舒芬太尼后处理对大鼠缺血后心肌保护炎症机制的影响[J]. 临床麻醉学杂志, 2015, 31(9): 891-5. |
| [7] | Tai W, Shi E, Yan L, et al. Diabetes abolishes the cardioprotection induced by sevoflurane postconditioning in the rat heart in vivo: roles of glycogen synthase kinase-3β and its upstream pathways[J]. J Surg Res, 2012, 178(1): 96-104. DOI: 10.1016/j.jss.2012.02.021. |
| [8] | Minguet G, Brichant JF, Joris J. Opioids and protection against ischemia-reperfusion injury: from experimental data to potential clinical applications[J]. Acta Anaesthesiol Belg, 2012, 63(1): 23-34. |
| [9] | Falcão-Pires I, Leite-Moreira AF. Diabetic cardiomyopathy: understanding the molecular and cellular basis to progress in diagnosis and treatment[J]. Heart Fail Rev, 2012, 17(3): 325-44. DOI: 10.1007/s10741-011-9257-z. |
| [10] | Ku PM, Chen LJ, Liang JR, et al. Molecular role of GATA binding protein 4 (GATA-4) in hyperglycemia-induced reduction of cardiac contractility[J]. Cardiovasc Diabetol, 2011, 10: 57. DOI: 10.1186/1475-2840-10-57. |
| [11] | Wen HL, Liang ZS, Zhang R, et al. Anti-inflammatory effects of triptolide improve left ventricular function in a rat model of diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2013, 12: 50. DOI: 10.1186/1475-2840-12-50. |
| [12] | 李虹, 高奋, 边云飞, 等. Intermedin对糖尿病大鼠心肌缺血再灌注炎性细胞因子的影响[J]. 中国动脉硬化杂志, 2015, 23(10): 1005-11. |
| [13] | Wang T, Mao X, Li H, et al. N-Acetylcysteine and allopurinol upregulated the Jak/STAT3 and PI3K/Akt pathways via adiponectin and attenuated myocardial postischemic injury in diabetes[J]. Free Radic Biol Med, 2013, 63: 291-303. DOI: 10.1016/j.freeradbiomed.2013.05.043. |
| [14] | Malfitano C, Alba LT, Rodrigues B, et al. Hyperglycaemia protects the heart after myocardial infarction: aspects of programmed cell survival and cell death[J]. Eur J Heart Fail, 2010, 12(7): 659-67. DOI: 10.1093/eurjhf/hfq053. |
| [15] | Chu LM, Osipov RM, Robich MP, et al. Is hyperglycemia bad for the heart during acute ischemia[J]. J Thorac Cardiovasc Surg, 2010, 140(6): 1345-52. DOI: 10.1016/j.jtcvs.2010.05.009. |
| [16] | Cheng XY, Gu XY, Gao Q, et al. Effects of dexmedetomidine postconditioning on myocardial ischemia and the role of the PI3K/ Akt-dependent signaling pathway in reperfusion injury[J]. Mol Med Rep, 2016, 14(1): 797-803. DOI: 10.3892/mmr.2016.5345. |
| [17] | O'brien PJ. Cardiac troponin is the most effective translational safety biomarker for myocardial injury in cardiotoxicity[J]. Toxicology, 2008, 245(3): 206-18. DOI: 10.1016/j.tox.2007.12.006. |
| [18] | Kawano S, Kubota T, Monden Y, et al. Blockade of NF-kappaB improves cardiac function and survival after myocardial infarction[J]. Am J Physiol Heart Circ Physiol, 2006, 291(3): H1337-44. DOI: 10.1152/ajpheart.01175.2005. |
| [19] | Kempf T, Zarbock A, Vestweber D, et al. Anti-inflammatory mechanisms and therapeutic opportunities in myocardial infarct healing[J]. J Mol Med (Berl), 2012, 90(4): 361-9. DOI: 10.1007/s00109-011-0847-y. |
| [20] | 邹吉丽, 尹照萍, 张利群, 等. 大鼠心肌缺血再灌注早期心肌及血清中IL-6, TNF-α的表达[J]. 中国医科大学学报, 2013, 42(9): 830-3. |
| [21] | Szczygiel AM, Brzezinka G, Targosz-Korecka M, et al. Elasticity changes anti-correlate with NO production for human endothelial cells stimulated with TNF-α[J]. Pflugers Arch, 2012, 463(3): 487-96. DOI: 10.1007/s00424-011-1051-1. |
| [22] | 吴付轩, 丁文惠, 李大元, 等. 炎症递质在兔心肌缺血再灌注损伤中的作用[J]. 临床心血管病杂志, 2000, 16(2): 85-7. |
| [23] | Saxena P, Aggarwal S, Misso NL, et al. Remote ischaemic preconditioning down-regulates kinin receptor expression in neutrophils of patients undergoing heart surgery[J]. Interact Cardiovasc Thorac Surg, 2013, 17(4): 653-8. DOI: 10.1093/icvts/ivt279. |
| [24] | Wander AA. Ischemic-reperfusion syndroms: biochemical and immunologic rationate for IL-1 targeted therapy[J]. Clin Immunol, 2008, 128(2): 127-32. DOI: 10.1016/j.clim.2008.03.514. |
| [25] | Huang Y, Lu Y, Zhang L, et al. Perineural dexmedetomidine attenuates inflammation in rat sciatic nerve via the NF-κB pathway[J]. Int J Mol Sci, 2014, 15(3): 4049-59. DOI: 10.3390/ijms15034049. |
| [26] | Zeng X, Wang H, Xing X, et al. Dexmedetomidine protects against transient global cerebral ischemia/reperfusion induced oxidative stress and inflammation in diabetic rats[J]. PLoS One, 2016, 11(3): e0151620. DOI: 10.1371/journal.pone.0151620. |
| [27] | Giribabu N, Roslan J, Rekha SS, et al. Methanolic seed extract of Vitis vinifera ameliorates oxidative stress, inflammation and ATPase dysfunction in infarcted and non-infarcted heart of streptozotocin-nicotinamide induced male diabetic rats[J]. Int J Cardiol, 2016, 222: 850-65. DOI: 10.1016/j.ijcard.2016.07.250. |
| [28] | Hoshida S, Yamashita N, Otsu K, et al. FR167653, a cytokinesuppressive agent, reduces myocardial ischemia-reperfusion injury in rats[J]. Cytokines Cell Mol Ther, 2000, 6(4): 165-70. DOI: 10.1080/mccm.6.4.165.170. |
 2017, Vol. 37
2017, Vol. 37

