2. 广东药科大学 生物资源与创新药物研究中心,广东 广州 510006
2. Center for Bioresources and Drug Discovery, Guangdong Pharmaceutical University, Guangzhou 510006, China
近年来,研究者们发现醛固酮水平异常升高会导致骨量减少/骨质疏松和骨折[1-5],应用醛固酮受体拮抗剂螺内酯能明显改善原发性醛固酮增多症患者的骨代谢状况[6];而醛固酮缺乏的患者也表现出钙代谢异常[7],另有临床病例指出低醛固酮血症-Wolcott-Rallison综合征患者慢性肾衰-骨骺发育不良之间可能存在因果联系[8]。此外,对骨质疏松症的全基因组关联研究显示醛固酮信号通路可能通过调节编码骨质疏松相关基因而参与骨代谢[9];Jaffe等[10]证实醛固酮能促进钙化血管细胞的分化和矿化,并伴有成骨指标基因(ALP)的增加。但醛固酮异常导致骨代谢失衡的具体机制尚未完全明确,且目前文献多以临床和动物实验为主,未见外源性醛固酮干预对成骨细胞影响的研究报道。
上皮钠离子通道(ENaC)是一种非电压依赖性钠离子通道蛋白,对维持细胞内外Na+平衡具有重要作用[11]。ENaC属于醛固酮诱导蛋白[12],外源性醛固酮可以刺激人类骨髓内皮细胞(HBMEC)中ENaC的合成[13],机体内醛固酮水平变化与细胞膜上ENaC的表达量相关[14];而ENaC亦是醛固酮调控Na+重吸收的主要靶点[15-16]。研究表明ENaC不仅存在于上皮细胞,在成骨细胞、软骨细胞上均有分布表达[17-19]。课题组前期研究已证实ENaC参与了雌激素、糖皮质激素、cGMP以及多种中药提取物或中药含药血清对成骨细胞功能的调节[20-24]。因此,我们推测,醛固酮可能通过ENaC实现对成骨细胞的调节作用,为验证这一设想,本研究观察外源性醛固酮对大鼠原代成骨细胞增殖、碱性磷酸酶活性和成骨功能指标基因表达的影响,并以ENaC为切入点,分析醛固酮作用下成骨细胞上骨形成活性相关标志物和ENaC基因转录和表达水平的变化情况,初步探讨ENaC是否参与了醛固酮对成骨细胞的调节作用,为进一步明确醛固酮影响骨代谢的作用机制提供实验基础和理论依据。
1 材料和方法 1.1 实验动物出生24 h内SD大鼠乳鼠10只,购自广州中医药大学实验动物中心,动物质量合格证号:44005800003074
1.2 药物与主要试剂醛固酮(Sigma),β-甘油磷酸钠(Sigma),L-维生素C(Sigma),地塞米松(Sigma);DMEM高糖培养基(Gibco),胎牛血清(Gibco),0.25%胰酶-EDTA(Gibco),Ⅰ型胶原酶(Sigma),PBS缓冲液(Gibco),Trizol(Thermo Fisher Scientific);兔抗大鼠Alkaline Phosphatase(ALP)单克隆抗体(GeneTex),兔抗大鼠Osteopontin(OPN)多克隆抗体(GeneTex),小鼠抗大鼠Collagen-Ⅰ alpha(Coll Ⅰα)单克隆抗体(abcam),兔抗大鼠α-ENaC多克隆抗体(Santa Cruz);CCK-8试剂盒(Dojindo Laboratories),碱性磷酸酶试剂盒(南京建成生物工程研究所),PrimeScriptTM RT-PCR Kit两步法试剂盒(Takara),BCA蛋白定量试剂盒(康为世纪)。
1.3 主要仪器Microplate Reader 680酶标仪(Bio-Rad);Mycycler梯度PCR仪(Bio-Rad);Tanon 4100凝胶成像分析系统(上海天能科技有限公司);Trans-Blot SD半干转印槽(Bio-Rad);PowerPac HC电泳仪(Bio-Rad);Mini-Protean Tetra小型垂直电泳槽(Bio-Rad)
1.4 成骨细胞培养采用酶消化法分离培养成骨细胞:SD大鼠乳鼠经乙醚麻醉处死后置于75%酒精中浸泡消毒10 min,在超净台内分离颅骨,以PBS缓冲液洗涤,并刮除结缔组织和骨膜,剪碎骨片后加入胰酶(0.25% Trypsin-EDTA)溶液消化15 min,弃去胰酶消化液,再加入Ⅰ型胶原酶溶液(Ⅰ型胶原酶:PBS=15 mg:10 mL)消化2次(37 ℃孵育1 h),离心10 min(400×g)后弃去消化液。以含10%胎牛血清的DMEM高糖培养基重悬细胞并转移至培养皿中,置于37 ℃,5% CO2培养箱中培养。每2 d换液1次,待细胞生长至90%融合时胰酶消化传代,以1.0×105/mL密度接种于培养皿中,从P2代细胞开始使用成骨诱导培养基(含10%胎牛血清的DMEM高糖培养基中加入终浓度为10 mmol/L β-甘油磷酸钠、10 nmol/L地塞米松、50 mg/L维生素C)培养。取P3-P5代细胞用于各项实验。
1.5 Cell Counting Kit-8(cck-8试剂盒)测定成骨细胞增殖细胞以1×104/mL的密度接种于96孔细胞培养板,培养24 h后,分别更换为含1×10-3、1×10-2、0.1、1、10 μmol/L醛固酮的成骨诱导培养基,各浓度组均设5个复孔,给药培养24 h后,每孔分别加入10 μL CCK-8试剂盒检测液,37 ℃培养箱中孵育2 h后,在酶标仪450 nm波长处测定光密度值。
1.6 成骨细胞碱性磷酸酶活性测定细胞接种、给药方法同“1.5”,给药培养24 h后,按碱性磷酸酶(AKP)试剂盒(南京建成生物工程研究所)说明书操作,在酶标仪520 nm波长处测定光密度值。
1.7 逆转录-PCR测定mRNA表达细胞以1.0×105/mL的密度接种于10 cm×10 cm培养皿中,培养24 h后分别更换为含1×10-2、0.1、1 μmol/L醛固酮的成骨诱导培养基,37 ℃,5% CO2培养箱内培养24 h后以Trizol提取总RNA,按PrimeScriptTM RT-PCR Kit试剂盒方法逆转录合成cDNA。引物由生工生物工程(上海)股份有限公司合成(表 1)。PCR扩增反应条件为:94 ℃变性30 s,X ℃退火30 s(α-ENaC基因退火温度X为58 ℃;各成骨功能指标基因退火温度X为54 ℃),72 ℃延伸1 min,共进行30个循环,以4 ℃结束循环。RT-PCR产物以2%琼脂糖凝胶电泳检测,凝胶成像系统拍照后以Image J软件测定目的条带灰度值,与内参β-actin灰度值比较,相对定量。
| 表 1 目的基因引物序列列表 Table 1 Primer sequences used for RT-PCR analysis of the target genes |
细胞以5×105/mL的密度接种于10 cm×10 cm培养皿中,培养24 h后分别更换为含1×10-2、0.1、1 μmol/L醛固酮的成骨诱导培养基,37 ℃,5% CO2培养箱内培养24 h后经RIPA蛋白抽提试剂提取总蛋白,按BCA蛋白定量试剂盒方法测定各组蛋白浓度。各组取等量蛋白经12% SDS-PAGE电泳后转膜1 h,经TBST洗膜10 min×3次后用含5%脱脂奶粉的TBST溶液摇床轻摇封闭2 h,再用TBST洗膜5 min×3次后加入一抗,4 ℃摇床轻摇过夜,次日室温孵育1 h,TBST洗膜10 min×3次后加入含5%脱脂奶粉的TBST溶液(1:1000)稀释二抗(辣根过氧化物酶标记的多克隆山羊抗兔IgG),4 ℃摇床孵育1 h,TBST洗膜10 min×3次,经曝光、显影、定影后获得蛋白胶片,凝胶成像系统拍照后以Image J软件测定目的条带灰度值,与内参GAPDH灰度值比较,相对定量。
1.9 统计学分析处理所有参数均用均数±标准差表示,以GraphPad Prism软件进行统计分析,One-way ANOVA检验法比较组间的变量差异,P<0.05表示差异有统计学意义。
2 结果 2.1 醛固酮对成骨细胞增殖及AKP活性的不同影响醛固酮浓度为10 μmol/L和1×10-3 μmol/L时细胞增殖率与对照组无显著差异(P>0.05),浓度为1、0.1、1×10-2 μmol/L时细胞增殖率均显著高于对照组(P<0.05),但3个浓度组间无显著差异(P>0.05)。醛固酮各浓度给药组计算所得AKP浓度值与对照组比较均无显著性差异(P>0.05,表 2)。
| 表 2 醛固酮对成骨细胞增殖和AKP活性的影响 Table 2 Effects of aldosterone on osteoblast proliferation and AKP activity (Mean±SD, n=5) |
设计并合成大鼠成骨细胞成骨功能指标基因(Coll-Ⅰα、ALP、OPN)和α-ENaC的引物,以逆转录PCR方法扩增目的片段,经2%琼脂糖凝电泳检测,分别得到4条与Coll-Ⅰα、ALP、OPN和α-ENaC基因大小一致的特异性片段(490、500、446、429 bp,图 1)。Image J软件测得各目的条带灰度值并与对应内参基因灰度值比较,结果表明(表 3):醛固酮浓度为1、0.1、1×10-2μmol/L时,成骨细胞上ALP、OPN的条带亮度均明显高于对照组(P<0.05),醛固酮浓度为0.1 μmol/L、1×10-2μmol/L时,成骨细胞上Coll-Ⅰα的条带亮度亦明显高于对照组(P<0.05),说明外源性给予醛固酮可促进成骨细胞骨形成活性相关标志物的mRNA表达;此外,醛固酮给药组成骨细胞上α-ENaC的条带亮度亦高于同浓度空白血清对照组(P<0.01),与其对成骨细胞骨形成活性相关标志物mRNA表达的促进作用一致。
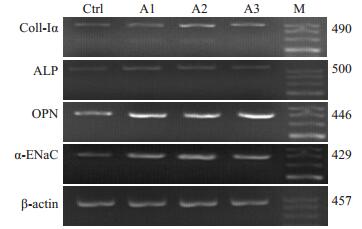
|
图 1 RT-PCR分析各组成骨细胞骨形成活性相关标志物基和α-ENaC基因mRNA的表达 Figure 1 RT-PCR analysis of osteogenic gene and α-ENaC mRNA expressions. M: Marker; A1: 1 μmol/L aldosterone; A2: 0.1 μmol/L aldosterone; A3: 1 × 10-2 μmol/L aldosterone. |
| 表 3 醛固酮对成骨细胞骨形成活性相关标志物和α-ENC基因mRNA表达的影响 Table 3 Effects of aldosterone on expressions of osteogenic gene and α-ENaC mRNA (Mean±SD, n=3) |
以Western blot方法检测得到成骨细胞骨形成活性相关标志物Coll-Ⅰα,ALP,OPN和α-ENaC的特异性蛋白条带(图 2),经Image J软件测得的灰度值结果表明(表 4):醛固酮浓度为1、0.1、1×10-2 μmol/L时成骨细胞上ALP、OPN、α-ENaC基因的蛋白表达量均明显高于对照组(P<0.05),醛固酮浓度为0.1 μmol/L、1×10-2 μmol/L时,成骨细胞上Coll-Ⅰα基因的蛋白表达量亦明显高于对照组(P<0.05)。
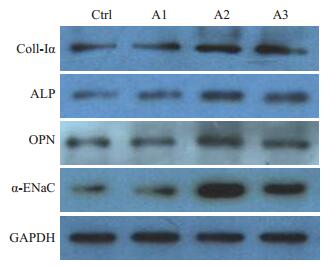
|
图 2 Western blotting分析各组成骨细胞骨形成活性相关标志物和α-ENaC蛋白的表达 Figure 2 Western blotting of osteogenic gene and α-ENaC protein expressions. M: Marker; A1: 1 μmol/L aldosterone; A2: 0.1 μmol/L aldosterone; A3: 1 × 10-2μmol/L aldosterone. |
| 表 4 醛固酮对成骨功能指标基因和α-ENaC基因蛋白表达的影响 Table 4 Effects of aldosterone on expressions of osteogenic gene and α-ENaC proteins (Mean±SD, n=3) |
成骨细胞是维持骨代谢平衡的主要功能细胞,负责骨基质的合成、分泌和矿化,其数量和功能情况直接影响着代谢性骨病的发生发展,因此,研究不同因素对成骨细胞的调节作用,也是目前代谢性骨病药物研发的主要内容。醛固酮是肾素-血管紧张素-醛固酮系统(RAAS)的终产物,负责调节体内水盐平衡,研究表明,机体的醛固酮分泌水平不仅与心血管疾病和肾脏疾病的发生发展有关,也参与对机体钙平衡调节并影响骨代谢[1-9],课题组前期研究亦发现给予高盐饮食的大鼠血清醛固酮水平降低,且骨量丢失和骨微细结构破坏。本研究通过对醛固酮(1×10-3 ~10 μmol/L)共培养下成骨细胞增殖和碱性磷酸酶活性情况的检测发现,醛固酮浓度为1、0.1、1×10-2 μmol/L时能明显促进成骨细胞增殖,但对成骨细胞碱性磷酸酶活性无显著影响。提示醛固酮浓度变化可以直接影响成骨细胞的增殖,并可能通过调节细胞增殖而干预骨形成过程。
成骨细胞的骨形成过程包括细胞增殖、细胞外基质形成与成熟、基质矿化3个阶段,本研究分别选择了3个阶段中具有代表性的成骨细胞活性标志物:Coll-Ⅰα、ALP和OPN基因[25-26]作为特异性检测指标,经逆转录PCR方法检测,证实醛固酮能显著上调Coll-Ⅰα、ALP和OPN等成骨细胞骨形成活性相关标志物的mRNA表达水平,且这种上调趋势与成骨细胞上α-ENaC基因在醛固酮刺激下mRNA表达水平的上调趋势一致,随后采用Western blotting对蛋白表达水平的检测也得到了与逆转录PCR实验相符的结果。ENaC是醛固酮调节水盐代谢的主要分子靶点[16],研究表明在多种细胞和组织中醛固酮均能促进ENaC的表达并调节其功能活性[12, 27-29],而上述实验结果说明,与在其它组织细胞中一样,成骨细胞上的ENaC也受醛固酮调控,并与醛固酮对成骨细胞的调节作用具有一定相关性。此外,虽然目前尚未见醛固酮对体外培养的成骨细胞影响的相关研究,但早有报道证实醛固酮受体在成骨细胞、破骨细胞上均有分布表达[30],并且是介导醛固酮影响骨代谢的重要通路之一[9],因此我们推测,醛固酮可能通过其受体介导的信号通路调节成骨细胞上ENaC基因的转录和表达,进而实现对成骨细胞的调节,即ENaC可能是醛固酮调节成骨细胞功能的作用靶点之一。
综上所述,醛固酮在一定浓度范围内能明显促进大鼠颅骨来源的成骨细胞增殖,并上调成骨细胞上骨形成活性相关标志物的mRNA和蛋白表达水平,这种促成骨作用与ENaC的表达上调趋势一致,说明醛固酮对成骨细胞的影响可能与ENaC的功能活性有关,但具体作用机制还有待后续研究确定。
| [1] | Petramala L, Zinnamosca L, Settevendemmie A, et al. Bone and mineral metabolism in patients with primary aldosteronism[J]. Int J Endocrinol, 2014, 2014: 836429. |
| [2] | Ceccoli L, Ronconi V, Giovannini L, et al. Bone health and aldosterone excess[J]. Osteoporos Int, 2013, 24(11): 2801-7. DOI: 10.1007/s00198-013-2399-1. |
| [3] | Chhokar VS, Sun Y, Bhattacharya SK, et al. Loss of bone minerals and strength in rats with aldosteronism[J]. Am J Physiol Heart Circ Physiol, 2004, 287(5): H2023-6. DOI: 10.1152/ajpheart.00477.2004. |
| [4] | Law PH, Sun Y, Bhattacharya SK, et al. Diuretics and bone loss in rats with aldosteronism[J]. J Am Coll Cardiol, 2005, 46(1): 142-6. DOI: 10.1016/j.jacc.2005.03.055. |
| [5] | Runyan AL, Chhokar VS, Sun Y, et al. Bone loss in rats with aldosteronism[J]. Am J Med Sci, 2005, 330(1): 1-7. DOI: 10.1097/00000441-200507000-00001. |
| [6] | Salcuni AS, Palmieri S, Carnevale V, et al. Bone involvement in aldosteronism[J]. J Bone Miner Res, 2012, 27(10): 2217-22. DOI: 10.1002/jbmr.1660. |
| [7] | Saito T, Tojo K, Yamamoto H, et al. Isolated adrenocorticotropin deficiency presenting with impaired renin-angiotensin-aldosterone system and suppressed parathyroid hormone-vitamin D axis[J]. Intern Med, 2002, 41(7): 561-5. DOI: 10.2169/internalmedicine.41.561. |
| [8] | Ucar A, Aydemir Y, Dogan A, et al. Relative hypoaldosteronism in a patient with Wolcott-Rallison syndrome[J]. Diabet Med, 2016, 33(3): E13-6. DOI: 10.1111/dme.12968. |
| [9] | Gupta M, Cheung CL, Hsu YH, et al. Identification of homogeneous genetic architecture of multiple genetically correlated traits by block clustering of Genome-Wide associations[J]. J Bone Miner Res, 2011, 26(6): 1261-71. DOI: 10.1002/jbmr.333. |
| [10] | Jaffe IZ, Tintut Y, Newfell BG, et al. Mineralocorticoid receptor activation promotes vascular cell calcification[J]. Arterioscler Thromb Vasc Biol, 2007, 27(4): 799-805. DOI: 10.1161/01.ATV.0000258414.59393.89. |
| [11] | Haerteis S, Krueger B, Korbmacher C, et al. The delta-Subunit of the Epithelial Sodium Channel (ENaC) Enhances Channel Activity and Alters Proteolytic ENaC Activation[J]. J Biol Chem, 2009, 284(42): 29024-40. DOI: 10.1074/jbc.M109.018945. |
| [12] | Dooley R, Angibaud E, Yusef YR, et al. Aldosterone-induced ENaC and basal Na +/K +-ATPase trafficking via protein kinase D1-phosphatidylinositol 4-kinaseⅢβ trans Golgi signalling in M1 cortical collecting duct cells[J]. Mol Cell Endocrinol, 2013, 372(1/ 2): 86-95. |
| [13] | Chen W, Valamanesh F, Mirshahi T, et al. Aldosterone signaling modifies capillary formation by human bone marrow endothelial cells[J]. Vascul Pharmacol, 2004, 40(6): 269-77. DOI: 10.1016/j.vph.2003.08.003. |
| [14] | 刘德凤. 醛固酮-WNK4参与盐负荷对远端肾小管钠离子转运体表达的调节[D]. 上海: 复旦大学, 2010. http://d.wanfangdata.com.cn/Thesis/Y2228275 |
| [15] | Garty H, Palmer LG. Epithelial Sodium channels: function, structure, and regulation[J]. Physiol Rev, 1997, 77(2): 359-96. |
| [16] | Studer RA, Person E, Robinson-Rechavi M. Evolution of the epithelial Sodium Channel and the Sodium pump as limiting factors of aldosterone action on Sodium transport[J]. Physiol Genomics, 2011, 43(13): 844-54. DOI: 10.1152/physiolgenomics.00002.2011. |
| [17] | Kizer N, Guo XL, Hruska K. Reconstitution of stretch-activated cation channels by expression of the α-subunit of the epithelial Sodium Channel cloned from osteoblasts[J]. Proc Natl Acad Sci, 1997, 94(3): 1013-8. DOI: 10.1073/pnas.94.3.1013. |
| [18] | Mobasheri A. Regulation of Na +, K +-ATPase density by the extracellular ionic and osmotic environment in bovine articular chondrocytes[J]. Physiol Res, 1999, 48(6): 509-12. |
| [19] | Mobasheri A, Pocock AE, Trujillo E, et al. Detection of mRNA and protein of the α subunit of the epithelial Sodium Channel (ENaC) in human osteoblasts and human ACL cells[J]. J Physiol, 2001, 535(S): 4P-5P. |
| [20] | 卢丽, 林晓慧, 陈珺, 等. 钠离子调节成骨细胞功能及其相关基因的差异性变化[J]. 广东医学, 2012, 33(3): 299-302. |
| [21] | Chen J, Zhang HJ, Zhang XL, et al. Epithelial Sodium Channel enhanced osteogenesis via cGMP/PKGⅡ/ENaC signaling in rat osteoblast[J]. Mol Biol Rep, 2014, 41(4): 2161-9. DOI: 10.1007/s11033-014-3065-1. |
| [22] | Lu L, Wu L, Jia HH, et al. The epithelial Sodium Channel is involved in dexamethasone-induced osteoblast differentiation and mineralization[J]. Cell Biol Toxicol, 2012, 28(5): 279-89. DOI: 10.1007/s10565-012-9222-1. |
| [23] | Yang GZ, Nie HG, Lu L, et al. Estrogen regulates the expression and activity of epithelial sodium channel in mouseosteoblasts[J]. Cell Mol Biol, 2011, 57(S): OL 1480-6. |
| [24] | 陈珺, 刘家剑, 卢丽, 等. 血清药理学研究车前子对成骨细胞功能的影响[J]. 中药材, 2012, 35(11): 1820-4. |
| [25] | Siggelkow H1, Rebenstorff K, Kurre W, et al. Development of the osteoblast phenotype in primary human osteoblasts in culture: comparison with mouse calvarial cells in osteoblast differentiation[J]. J Cell Biochem, 1999, 75(1): 22-35. DOI: 10.1002/(ISSN)1097-4644. |
| [26] | 李敏, 赵琳, 李捷莉, 等. Ⅲ型代谢型谷氨酸受体通过OPG/RANKL途径改善成骨细胞矿化能力的研究[J]. 诊断学理论与实践, 2010, 9(5): 477-81. |
| [27] | Perlewitz A, Nafz B, Skalweit A, et al. Aldosterone and vasopressin affect α-and γ-ENaC mRNA translation[J]. Nucleic Acids Res, 2010, 38(17): 5746-60. DOI: 10.1093/nar/gkq267. |
| [28] | Wynne BM, Mistry AC, Al-Khalili O, et al. Aldosterone Modulates the Association between NCC and ENaC[J]. Sci Rep, 2017, 7(1): 4149. DOI: 10.1038/s41598-017-03510-5. |
| [29] | Arroyo JP, Ronzaud C, Lagnaz D, et al. Aldosterone paradox: differential regulation of ion transport in distal nephron[J]. Physiology (Bethesda), 2011, 26(2): 115-23. DOI: 10.1152/physiol.00049.2010. |
| [30] | Beavan S, Horner A, Bord S, et al. Colocalization of glucocorticoid and mineralocorticoid receptors in human bone[J]. J Bone Miner Res, 2001, 16(8): 1496-504. DOI: 10.1359/jbmr.2001.16.8.1496. |
 2017, Vol. 37
2017, Vol. 37

