2. 右江民族医学院附属医院 检验科,广西 百色 533000;
3. 右江民族医学院附属医院 外科,广西 百色 533000;
4. 湖南中医药大学中西医结合学院,湖南 长沙 410208
2. Department of Laboratory Medicine, Affiliated Hospital of Youjiang Medical College for Nationalities, Guangxi, BaiSe 533000, China;
3. Department of Surgery, Affiliated Hospital of Youjiang Medical College for Nationalities, Guangxi, BaiSe 533000, China;
4. College of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Hunan, Changsha 410208, China
α-烯醇化酶(ENO1)作为糖酵解过程中一个关键的酶,能在许多生理过程中发挥重要的作用。它主要定位于细胞质中,蛋白相对分子质量为48 000。目前,一些研究表明,该基因通过促进糖酵解的方式参与了葡萄糖的代谢,从而促进了肿瘤的发病过程,这其中包括了子宫内膜癌、非小细胞肺癌和乳腺癌等[1-4]。
胶质瘤是一种发生于脑组织或脊椎的肿瘤,称它为胶质瘤是因为它起源于神经胶质细胞。其发病原因复杂,常导致基因表达异常紊乱[5-9],如PC4和SFRS1Interacting Protein 1(PSIP1),Zinc finger protein 217(ZNF217),Histone H3 lysine 9(H3K9)乙酰化,表皮生长因子受体和Heterochromatin protein 1α(HP1α)等,从而诱导胶质瘤的发病。在胶质瘤中,ENO1目前的功能和机理研究极少,仅Song等[10]发现,ENO1过表达通过诱导phosphatidylinositol-3-kinase/serine/threonineprotein kinase(PI3K/AKT)介导的细胞周期和上皮间质转化(EMT)信号明显增加了胶质瘤的恶性表型。然而,该基因在胶质瘤中关于是否调控糖酵解影响细胞生长还没有相关的研究。在本研究中,我们探讨ENO1在胶质瘤是否了调节糖酵解过程,从而进一步明确其在胶质瘤中的作用,这将为ENO1在临床上作为治疗靶点提供理论依据。
1 材料和方法 1.1 材料细胞和试剂胶质瘤U251细胞购自于上海中科院细胞库,培养在含15%胎牛血清的RPMI 1640培养液中,在37 ℃,5% CO2环境下培养。HK2和LDHA抗体从美国ABCAM购买;ENO1和内参glyceraldehyde-3-phosphate dehydrogenase(GAPDH)兔抗人多克隆抗体购自Santa-Cruz购买。
1.2 方法 1.2.1 siRNA转染siRNA-ENO1和对照siCtr购自广州锐博公司。将胶质瘤细胞U251根据不同处理因素分Small interfering RNA ENO1(siENO1)组和Small interfering RNA Control(siCtr)组。按照Lipofectamine 2000试剂说明书常规转染,方法简述如下:将20 pmol的siRNA及6 µL脂质体分别稀释于250 µL无血清培养基,室温静置5 min后轻柔混匀,再室温静置10 min后均与加入各组培养板中,使siRNA的终浓度为10 nmol/L。
1.2.2 实时荧光定量PCRsiRNA-ENO1和对照siCtrU251细胞总Ribonucleic Acid(RNA)各自被提取后,分别利用日本TAKARA公司的逆转录试剂盒合成complementary Deoxyribonucleic acidc(DNA)。进一步,ENO1 mRNA在siRNA-ENO1和对照siCtr细胞中表达被检测,反应体系为:SYBR Premix 10 µL、上下游引物各1.0 µL、cDNA模板1 µL和灭菌去离子水7 µL共20 µL。反应条件如下:94 ℃变性2 min;94 ℃变性12 s;53 ℃退火12 s,72 ℃延伸15 s,45个循环;溶解曲线分析。实验重复3次。
1.2.3 葡萄糖摄取实验U251细胞在siRNA处理24 h后,收集培养基上清液,设置空白培养基对照组,按照说明书(Sigma-ALDRICH)要求检测葡萄糖的含量。应用试剂盒中的葡萄糖标准品绘制标准曲线。运用全波长酶标仪在激发波长530 nm,发射波长590 nm下检测样品吸收度。根据标准曲线公式计算求得样品上清液中剩余葡萄糖含量,用空白培养基中的葡萄糖含量扣除剩余葡萄糖含量即得到葡萄糖的摄取量。siCtr U251细胞作为研究对照。实验重复3次。
1.2.4 乳酸生成实验U251细胞在siRNA处理24 h后,收集培养基上清液,按照说明书要求检测乳酸的生成量。采用全波长酶标仪在530 nm的波长处检测样品吸收度。由以下公式计算得到乳酸的含量:乳酸生成量(mmol/L)=3×(A(sample)-A(blank)/(A(standard)-A(blank)。siCtrU251细胞作为研究对照。实验重复3次。
1.2.5 MTT利用MTT方法检测siENO1对U251细胞生长的影响,siCtrU251细胞作为研究对照。对数期1×103细胞接种于96孔培养板,共2组,每组3个复孔。当细胞生长至满孔的50%融合时,将siENO1和对照siCtr分别转染入胶质瘤细胞,培养72 h后,每孔加入5 mg/mL MTT 20 µL,继续培养4 h,弃去液体,加入150 µL Dimethyl Sulphoxide(DMSO),震荡10 min,酶标仪测定A490 nm,以A490 nm反映活细胞水平,实验重复3次。
1.2.6 细胞周期流式细胞仪检测siENO1对U251细胞生长对细胞周期的影响,siCtrU251细胞作为研究对照。接种细胞到6孔培养板。当细胞培养约至满孔的70%融合,将siENO1和对照siCtr分别转染入胶质瘤细胞。继续培养细胞56 h,收集细胞,加预冷70%乙醇固定过夜,用PI染色,流式细胞仪进行检测。实验重复3次。
1.2.7 Western blot收集siRNA-ENO1和对照siCtrU251细胞。phosphate buffer saline(PBS)分别漂洗细胞后,加入适量:Radio-Immunoprecipitation Assay(RIPA)裂解液,提取细胞总蛋白。进一步加入适量sodium dodecyl sulfate, sodium salt(SDS)上样缓冲液,100 ℃水浴解除蛋白交联。各组蛋白样品行聚丙烯酰胺凝胶电泳,poiy vinylidene fluoride(PVDF)膜转膜并用脱脂奶粉封闭2 h,然后依次孵育一抗4 ℃过夜及辣根过氧化物酶标记的羊抗兔二抗(1:1000,CST,USA)室温1 h后化学发光法显影,利用Rabbit-antihuman ENO1 antibody(1:500,Proteintech Group Inc,USA),Rabbit-antihuman HK2 antibody(1:500,CST,USA)和Rabbit-antihuman LDHA antibody(1:500,CST,USA)检测细胞中蛋白ENO1、HK2和LDHA,表达情况,以Rabbit-antihuman GAPDH(1: 500,Santa Cruz Biotechnology, USA)作为内参。ECL试剂盒进行化学发光检测。
1.2.8 统计分析Graphpad Prism 5软件用于统计分析,P<0.05表示有统计学意义。数据用均数±标准差表示,配对t检验用于检测siRNA-ENO1和对照siCtrU251细胞体外葡萄糖摄取、乳酸生成、增殖和EDU着色分析。
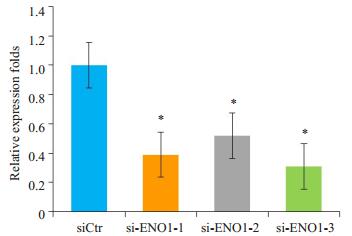
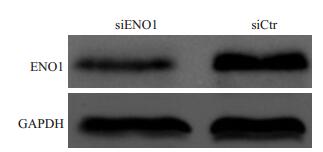
2 结果 2.1 siRNAs靶向ENO1片段筛选利用实时荧光定量检测了3个siRNAs片段,结果发现,虽然siENO1 3个片段都能有效的抑制ENO1mRNA表达,但siENO-1-3片段显示了最强的抑制能力,其抑制效率达到68.12%(图 1)。进一步,我们利用Western blot检测发现,siENO-1-3片段能有效的抑制的ENO1蛋白的表达(图 2)。
|
图 1 siRNA-ENO1干扰片段筛选 Figure 1 QPCR for screening siRNA-ENO1. *P < 0.05 vs siCtr group. |
|
图 2 siENO1抑制ENO1蛋白在胶质瘤细胞中的表达 Figure 2 Inhibitory effect of siENO1 on protein expression of ENO1 in glioma cells. |
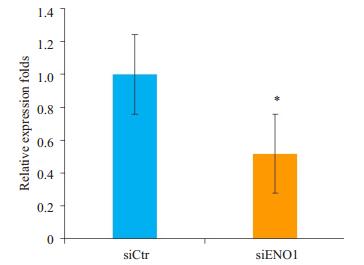
在利用siENO1转染胶质瘤细胞后,利用葡萄糖摄取试剂盒检测,最后经配对t检验分析发现,细胞的葡萄糖摄取能力明显的降低(P=0.007,图 3)。
|
图 3 抑制ENO1表达降低胶质瘤细胞对葡萄糖的摄取 Figure 3 siENO1-induced suppression of glucose uptake in glioma cells. *P < 0.05 vs siCtr group. |
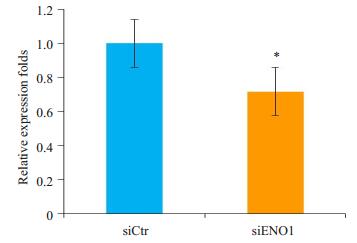
在利用siENO1转染胶质瘤细胞后,利用葡乳酸生成试剂盒分析检测,数据经配对t检验分析发现,细胞的乳酸生成能力也明显的降低(P=0.023,图 4)。
|
图 4 抑制ENO1表达降低胶质瘤细胞乳酸的生成 Figure 4 siENO1-induced suppression of lactic acid production in glioma cells. *P < 0.05 vs siCtr group. |
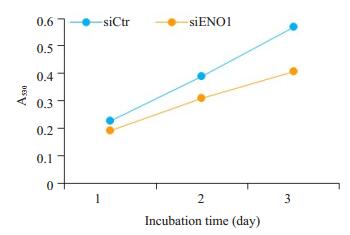
在抑制ENO1表达后,我们使用MTT检测细胞生长能力的改变,绘制生长曲线。经配对t检验分析发现,胶质瘤细胞的增殖能力明显降低(图 5)。
|
图 5 抑制ENO1表达降低胶质瘤细胞生长 Figure 5 siRNA-mediated ENO1 knockdown suppresses the growth of glioma cells. *P < 0.05 vs siCtr group. |
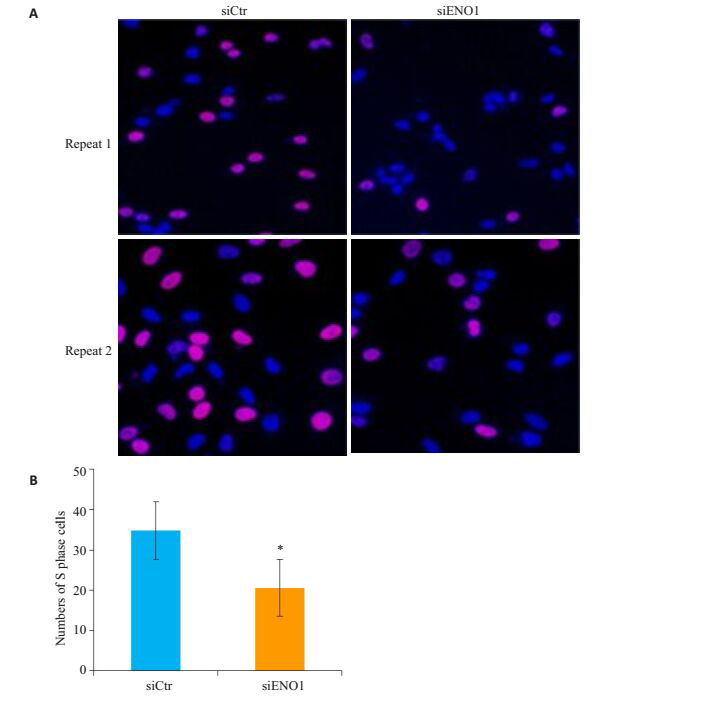
SiRNA下调ENO1表达后,EDU着色并经配对T检验分析发现,细胞的着色能力明显下降,这表明细胞的G1/S转化能力明显抑制(P=0.0425,图 6)。
|
图 6 抑制ENO1表达降低EDU着色 Figure 6 siRNA-mediated ENO1 knockdown reduces EDU staining in glioma cells (Original magnification: × 400). *P < 0.05 vs siCtr group. A:EDU staining in siEON1 and siCtr group; B: Bar map for comparison of EDU staining between siEON1 and siCtr group. |
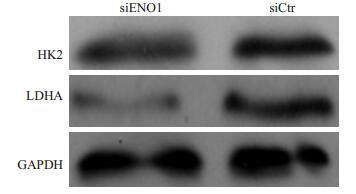
HK2和LDHA是葡萄糖代谢增加的两个关键指标。我们发现,在抑制ENO1表达后,HK2和LDHA表达水平明显降低(图 7)。
|
图 7 抑制ENO1表达降低HK2和LDHA表达 Figure 7 siRNA-mediated ENO1 knockdown suppresses the expression of HK2 and LDHA in glioma cells (Western blotting). |
从肿瘤微环境的角度来讲,尽管胶质瘤的局部血供不足从而导致肿瘤细胞常常处于缺氧的状态,但是胶质瘤细胞却能不停地活跃生长[11],这当中可能的机制就是肿瘤细胞葡萄糖摄取能力及有氧氧化能力的增强[12]。近年来的研究表明,部分与糖酵解有关的酶是一种功能复杂的、作用多层面的蛋白,而不是以往所认为的糖酵解途径中简单的一个组成部分[13]。
ENO1作为糖酵解过程中一个关键的酶,能在许多生理过程中发挥重要的作用[14]。其在细胞核内存在其同源异构体,即c-Myc启动子结合蛋白,它起着负性转录调控的作用[15]。与之相反,目前已有大量文献报道,ENO1在许多肿瘤中的转录活性和蛋白表达量均上调[16]。由于ENO1的糖酵解活性与ATP柠檬酸裂合酶的表达上调有关系[17],因此ENO1可能是一个肿瘤代谢的促进因子,并导致ENO1高表达的肿瘤细胞具有明显生长优势。
在以往的研究中,ENO1促进糖代谢过程,从而参与了一些肿瘤的发病过程,包括非小细胞肺癌[1]、子宫内膜癌[2]、乳腺癌[3]和多发性骨髓瘤[4]等。然而,其在调节胶质瘤糖代谢方面目前还没有相关的报导。
在本次研究中,我们首先筛选利用siRNA的方法,筛选了能有效抑制ENO1表达的siRNA。进一步,我们观察到,在ENO1表达抑制后,胶质瘤细胞的葡萄糖摄取和乳酸产生的能力明显降低,进而导致细胞的增殖和细胞周期转化能力也明显下降。该研究类似于Zhao和Fu等在子宫内膜癌和非小细胞肺癌中的结果,表明ENO1促进了糖代谢,从而参与胶质瘤的发病过程。
ENO1的功能阐明为机制的研究奠定了良好的基础。HK2和LDHA是糖代谢的两个关键性标志基因,其基因的活化参与了一些肿瘤的发病过程,包括了胰腺癌、卵巢癌、肝癌和胶母细胞瘤[18-25]。在随后的研究中,我们发现,HK2和LDHA在ENO1表达降低的胶质瘤细胞中表达下调,该结果进一步支持ENO1促进了胶质瘤细胞的糖代谢。
综合以上结果表明,ENO1在胶质瘤中通过正向调控糖代谢相关基因HK2和LDHA表达,从而促进了胶质瘤的发病过程,这提示ENO1是可以作为脑胶质瘤治疗的一个关键靶标。
| [1] | Fu QF, Liu Y, Fan YE, et al. Alpha-enolase promotes cell glycolysis, growth, migration, and invasion in non-small cell lung Cancer through FAK-mediated PI3K/AKT pathway[J]. J Hematol Oncol, 2015, 8: 22. DOI: 10.1186/s13045-015-0117-5. |
| [2] | Zhao MY, Fang WY, Wang Y, et al. Enolase-1 is a therapeutic target in endometrial carcinoma[J]. Oncotarget, 2015, 6(17): 15610-27. DOI: 10.18632/oncotarget.v6i17. |
| [3] | Harami-Papp H, Pongor LS, Munkacsy GA, et al. TP53 mutation hits energy metabolism and increases glycolysis in breast cancer[J]. Oncotarget, 2016, 7(41): 67183-95. DOI: 10.18632/oncotarget.v7i41. |
| [4] | Gu ZM, Xia JL, Xu HW, et al. NEK2 promotes aerobic glycolysis in multiple myeloma through regulating splicing of pyruvate kinase[J]. J Hematol Oncol, 2017, 10(1): 17. DOI: 10.1186/s13045-017-0392-4. |
| [5] | 向伟, 漆松涛, 刘亚伟, 等. siRNA干扰相互作用蛋白1表达抑制胶质瘤细胞的侵袭和迁移[J]. 南方医科大学学报, 2016, 36(6): 802-6. |
| [6] | 罗起胜, 黄海能, 邓元央, 等. 慢病毒介导shRNA靶向ZNF217抑制胶质瘤细胞生长、迁移和侵袭[J]. 南方医科大学学报, 2015, 35(7): 1024-7, 1033. |
| [7] | 李周儒, 刘捷, 雷宇, 等. 组蛋白高乙酰化介导的Egr-1结合促进gdnf基因高转录[J]. 南方医科大学学报, 2015, 35(5): 697-701. |
| [8] | Yang C, Li YS, Wang QX, et al. EGFR/EGFRvIII remodels the cytoskeleton via epigenetic silencing of AJAP1 in glioma cells[J]. Cancer Lett, 2017, 403(2): 119-27. |
| [9] | Song Y, Luo Q, Long H, et al. Alpha-enolase as a potential cancer prognostic marker promotes cell growth, migration, and invasion in glioma[J]. Mol Cancer, 2014, 13: 65. DOI: 10.1186/1476-4598-13-65. |
| [10] | Oudard S, Arvelo F, Miccoli L, et al. High glycolysis in gliomas despite low hexokinase transcription and activity correlated to chromosome 10 loss[J]. Br J Cancer, 1996, 74(6): 839-45. DOI: 10.1038/bjc.1996.446. |
| [11] | Oudard S, Boitier E, Miccoli L, et al. Gliomas are driven by glycolysis: putative roles of hexokinase, oxidative phosphorylation and mitochondrial ultrastructure[J]. Anticancer Res, 1997, 17(3C): 1903-11. |
| [12] | Kim JW, Dang CV. Multifaceted roles of glycolytic enzymes[J]. Trends Biochem Sci, 2005, 30(3): 142-50. DOI: 10.1016/j.tibs.2005.01.005. |
| [13] | Merkulova T, Dehaupas M, Nevers MC, et al. Differential modulation of alpha, beta and gamma enolase isoforms in regenerating mouse skeletal muscle[J]. Eur J Biochem, 2000, 267(12): 3735-43. DOI: 10.1046/j.1432-1327.2000.01408.x. |
| [14] | Chang YS, Wu W, Walsh G, et al. Enolase-alpha is frequently downregulated in non-small cell lung cancer and predicts aggressive biological behavior[J]. Clin Cancer Res, 2003, 9(10 Pt 1): 3641-4. |
| [15] | Altenberg B, Greulich KO. Genes of glycolysis are ubiquitously overexpressed in 24 cancer classes[J]. Genomics, 2004, 84(6): 1014-20. DOI: 10.1016/j.ygeno.2004.08.010. |
| [16] | Beckner ME, Fellows-Mayle W, Zhang Z, et al. Identification of ATP citrate lyase as a positive regulator of glycolytic function in glioblastomas[J]. Int J Cancer, 2010, 126(10): 2282-95. |
| [17] | Katagiri M, Karasawa H, Takagi KA, et al. Hexokinase 2 in colorectal cancer: a potent prognostic factor associated with glycolysis, proliferation and migration[J]. Histol Histopathol, 2017, 32(4): 351-60. |
| [18] | Li HZ, Wang XJ, Fang Y, et al. Integrated expression profiles analysis reveals novel predictive biomarker in pancreatic ductal adenocarcinoma[J]. Oncotarget, 2017, 8(32): 52571-83. |
| [19] | Ogawa H, Nagano H, Konno M, et al. The combination of the expression of hexokinase 2 and pyruvate kinase M2 is a prognostic marker in patients with pancreatic cancer[J]. Mol Clin Oncol, 2015, 3(3): 563-71. DOI: 10.3892/mco.2015.490. |
| [20] | Jin Z, Gu J, Xin X, et al. Expression of hexokinase 2 in epithelial ovarian tumors and its clinical significance in serous ovarian cancer[J]. Eur J Gynaecol Oncol, 2014, 35(5): 519-24. |
| [21] | Kwee SA, Hernandez B, Chan OW, et al. Choline kinase alpha and hexokinase-2 protein expression in hepatocellular carcinoma: association with survival[J]. PLoS One, 2012, 7(10): e46591. DOI: 10.1371/journal.pone.0046591. |
| [22] | Wolf A, Agnihotri S, Micallef J, et al. Hexokinase 2 is a key mediator of aerobic glycolysis and promotes tumor growth in human glioblastoma multiforme[J]. J Exp Med, 2011, 208(2): 313-26. DOI: 10.1084/jem.20101470. |
| [23] | Mack N, Mazzio EA, Bauer D, et al. Stable shRNA silencing of lactate dehydrogenase a (LDHA) in human MDA-MB-231 breast cancer cells fails to alter lactic acid production, glycolytic activity, ATP or survival[J]. Anticancer Res, 2017, 37(3): 1205-12. DOI: 10.21873/anticanres. |
| [24] | Han RL, Wang FP, Zhang PA, et al. miR-383 inhibits ovarian cancer cell proliferation, invasion and aerobic glycolysis by targeting LDHA[J]. Neoplasma, 2017, 64(2): 244-52. DOI: 10.4149/neo_2017_211. |
 2017, Vol. 37
2017, Vol. 37

