2. 广东省人民医院 中山大学附属第一医院内分泌科,广东 广州 510080
2. Department of Endocrinology, First Affiliated Hospital of Sun Yat-set University, Guangzhou 510080, China
肥胖是一个严峻的全球性问题,随着生活水平改善,肥胖患病率近年来不断攀升,国际肥胖研究组织2010年报告显示全球超重和肥胖人群分别高达十亿和四百万[1]。肥胖不仅与冠心病、脑血管疾病、高血压等疾病密切相关,还可以显著增加全因死亡风险[2-3],同时也是2型糖尿病发生发展的独立危险因素[4-5]。调查研究显示我国2型糖尿病患病率为11.6%,而超重和肥胖人群中2型糖尿病患病率则高达12.8%和18.5%[6]。虽然各种证据提示肥胖与2型糖尿病发生发展密切相关,但其确切机制尚未完全明确。
体质量增加是2型糖尿病发生的独立危险因素之一,但仍有相当部分肥胖患者血糖代谢正常[7-8];研究显示胰岛素抵抗、胰岛β细胞功能、炎症因子以及线粒体功能等其他因素可能影响肥胖患者是否发生糖代谢异常[9],其中胰岛素抵抗是肥胖和2型糖尿病共同的病理生理改变[4, 9]。近期研究显示肥胖患者胰岛素抵抗的程度可能与异位脂肪沉积密切相关;异位脂肪沉积是指脂肪在异常部位如腹部、肝脏、肌肉等沉积[10]。由于肝脏和骨骼肌不仅是肥胖患者常见的异位脂肪沉积部位[11],同时也是胰岛素抵抗发生的常见部位[12],因此大量研究学者致力于研究肝脏和骨骼肌脂肪含量与胰岛素抵抗和糖代谢异常的关系。但由于研究结果不尽相同,至今仍未得到一致的结论。
本研究拟在不同糖耐量状态的肥胖人群中采用磁共振质谱法(1HMRS)对肝脏脂肪和骨骼肌脂肪进行定量测定;通过高胰岛素-正常葡萄糖钳夹试验评估不同糖耐量肥胖人群的胰岛素敏感性,并探讨肝脏和骨骼肌脂肪含量与胰岛素敏感性的相关性。
1 资料和方法 1.1 研究对象中山大学附属第一医院内分泌科2012年~2013年门诊或体检中心患者中符合入选条件并自愿参加该项研究的受试者为本课题的研究对象。入选标准:①自愿参与该研究并签署知情同意书;②年龄≥18岁;③否认糖尿病病史,门诊口服糖耐量试验(OGTT)结果提示糖耐量异常或糖代谢正常;④入组前患者至少3个月内体质量稳定(变化幅度不超过±5%);⑤18 kg/m2≤体质量指数(BMI)≤35 kg/m2;⑥研究对象无生育能力或同意在研究过程中采用避孕措施。排除标准:①确诊1型糖尿病或2型糖尿病;②合并严重感染、脏器功能衰竭不能配合检查。
1.2 研究方法 1.2.1 研究分组亚洲人群标准肥胖定义[13-14]为25 kg/m2≤BMI≤35 kg/m2;糖耐量正常(NGT)诊断标准OGTT空腹血糖(FPG)<6.1 mmol/L,餐后2 h血糖(2 hPG)<7.8 mmol/L,糖耐量异常(IGT)诊断标准OGTT 2 hPG≥7.8 mmol/L且<11.1 mmol/L,FPG<6.1 mmol/L。研究共入组肥胖人群16例,然后根据糖代谢情况分为NGT-肥胖组以及IGT-肥胖组,另外入组健康对照人群10例为NGT-非肥胖组。
1.2.2 人体测量指标和实验检查项目所有受试者进行身高、体质量、血压、心率等人体学参数检测;检测FPG/ 2 hPG(葡萄糖氧化酶法)、空腹胰岛素(Fins,化学发光免疫分析法)、胆固醇(CHOL,胆固醇氧化酶法)、甘油三酯(TG,GPO-POD酶法)、高密度脂蛋白胆固醇(HDL-c,反应促进剂-过氧化酶清除法)、低密度脂蛋白胆固醇(LDL-c,表面活性剂清除法)和糖化血红蛋白A1c(HbA1c,离子交换高效液相色谱法)。
1.2.3 高胰岛素-正常葡萄糖钳夹试验采用德国EKFBiosen C_line血糖分析仪,(葡萄糖检测采用氧化酶电极法),采用标准高胰岛素-正常葡萄糖钳夹法[15],目标血糖值5.0 mmol/L;设定胰岛素输注速度,输注速度为前10 min 2 mU/(kg·min),随后调整输注速度为1 mU/(kg·min)。钳夹开始后每5 min取加热后动脉化的静脉血,使用EKF Biosen C_line血糖分析仪快速测定血糖,并根据血糖调整葡萄糖输注速率使血糖尽量接近5.0 mmol/L。以血糖波动小于±10%目标值即波动于4.5~5.5 mmol/L之间并持续20 min以上判断为进入稳态期,此后于稳态期维持至少60 min,并将稳态期最后30 min的葡萄糖输注率(GIR,M值)作为胰岛素敏感性判断指标。
1.2.4 1H MRS测量肝脏和骨骼肌脂肪含量采用Siemens Magnetom Verio 3.0T磁共振扫描仪,其中肝脏脂肪测量扫描参数为TR 2000 ms,TE 30 ms,激励次数8次,感兴趣区1.5 cm×1.5 cm×1.5 cm。体素放置于肝脏右后叶,避开血管、胆囊和脂肪组织。扫描结束后,对所有MRS数据采用jMRUI软件进行分析,分别测量4.7 ppm水峰下面积和1.5 ppm脂峰下面积。骨骼肌脂肪测量扫描参数为TR 3000 ms,TE 20 ms,激励次数48次,感兴趣区1.0 cm×1.0 cm×1.0 cm。体素分别放置于右侧小腿比目鱼肌和胫骨前肌中段,避开血管、筋膜和脂肪组织。扫描结束后,分析位于4.7 ppm的水波峰及位于1.3 ppm的肌细胞内脂肪含量(IMCL)波峰以及位于1.5 ppm的肌细胞外脂肪含量(EMCL)波峰。其中IMCL(sol)和EMCL(sol)表示比目鱼肌肌纤维细胞内和比目鱼肌肌纤维细胞外脂肪含量,而IMCL(ta)和EMCL(ta)表示胫骨前肌肌纤维细胞内和肌纤维细胞外脂肪含量。
1.3 统计学分析所有原始数据核查整理后,使用SPSS 22.0软件进行数据分析。符合正态分布或经转换后呈正态分布的连续变量用均数±标准差表示,组间均数比较采用单因素ANOVA分析,相关性分析采用Spearman相关分析和多元线性逐步回归法。其中P<0.05差异具有统计学意义。
2 结果 2.1 一般资料本研究共入组26人,其中NGT-非肥胖组10例(男2例,女8例),年龄45.20±11.49岁;NGT-肥胖组9例(男7例,女2例),年龄47.22±7.40岁;IGT-肥胖组7例(男2例,女5例),年龄50.71±7. 30岁。具体基线资料见表 1。
| 表 1 患者基本资料 Table 1 Basic characteristics of the 3 groups of participants |
本研究所有参与受试者均按计划完成了高胰岛素-正常葡萄糖钳夹试验,检查过程顺利。在进入血糖稳态期时NGT-非肥胖组、NGT-肥胖组和IGT-肥胖组血糖变异系数分别为(4.98±2.00)%、(4.51±0.86)%、(3.15±1.20)%,3组稳态期血糖平均变异系数CV均<5%(表 2),提示高胰岛素-正葡萄糖钳夹实验模型成功建立。
| 表 2 高胰岛素-正常葡萄糖钳夹实验血糖和M值 Table 2 Blood glucose (BG) and steady state M value in hyperinsulinemic-euglycemic clamp |
高胰岛素-正常葡萄糖钳夹试验正式开始后血糖逐渐稳定在5.0 mmol/L左右,血糖波动于4.5~5.5 mmol/L之间,进入稳态期。稳态期最后30 min NGT-非肥胖组、NGT-肥胖组和IGT-肥胖组M值分别为8.76±2.46 mg/(kg·min)、6.14±1.90 mg/(kg·min)、3.95±1.66 mg/(kg·min)(表 2)。IGT-肥胖组M值显著低于NGT-肥胖组和NGT-非肥胖组(P<0.05),NGT-肥胖组M值显著低于NGT-非肥胖组(P<0.05)。
2.3 肝脏和骨骼肌脂肪含量1HMRS定量测定肝脏和骨骼肌脂肪含量,结果如表 3所示。若受试者脂峰太小,无法测量峰下面积,则记录其脂肪含量记录为0。结果显示IGT-肥胖组、NGT-肥胖组和NGT-非肥胖组肝脏脂肪含量分别为(15.23± 3.09)%、(6.25±0.38)%、(1.89±0.90)%,3组差异具有统计学显著性(P<0.05),其中IGT-肥胖组肝脏脂肪含量最高。骨骼肌脂肪含量检测中,NGT-肥胖组和IGT-肥胖组胫骨前肌肌内脂肪含量显著高于NGT-非肥胖组,比目鱼肌肌内外脂肪含量和胫骨前肌肌外脂肪含量3组间比较差异均不具有显著性。
| 表 3 1H MRS测定受试者肝脏脂肪和骨骼肌脂肪含量 Table 3 Liver fat content and skeletal muscle fat contents in the participants determined by 1H MRS |
肝脏脂肪含量与M值、HOMAIR以及HOMAβ存在显著相关性。绘制散点图(图 1)提示随着肝脏脂肪含量下降M值呈上升趋势,随着肝脏脂肪含量的上升HOMAIR和HOMAβ呈上升趋势,相关性分析提示肝脏脂肪含量与M值存在负相关关系(r=-0.895,P<0.01),与HOMAIR和HOMAβ存在正相关(相关系数分别是:r=0.624,P<0.01;r=0.708,P<0.01)。胫骨前肌和比目鱼肌的肌细胞内外的脂肪含量与M值、HOMAIR以及HOMAβ无明显相关性。
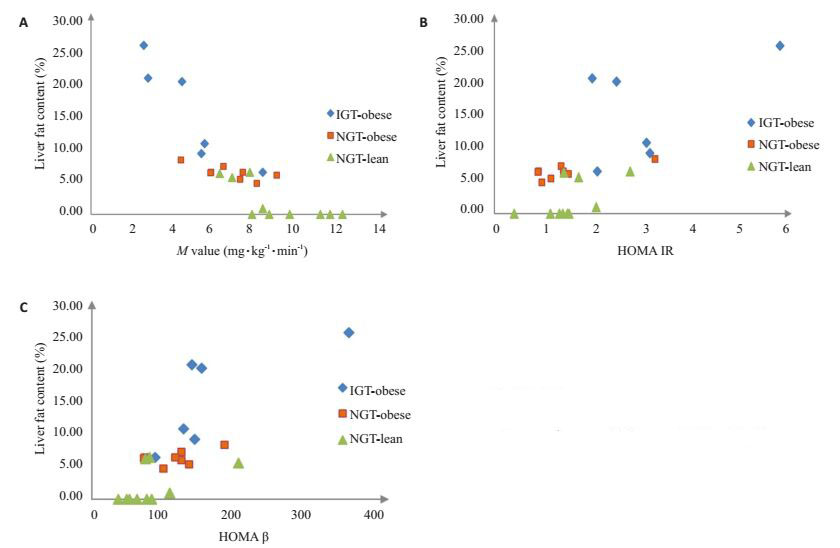
|
图 1 肝脏脂肪含量与胰岛素敏感性、胰岛细胞功能相关性 Figure 1 Correlation analysis of liver fat content with insulin sensitivity and islet β-cell function. |
其余指标线性相关分析提示M值与2 hPG(r=-0.549,P<0.01)、LDL-c(r=-0.448,P<0.05)等血清学指标存在显著负相关;与HDL-c(r=0.449,P<0.05)存在显著正相关。以M值作为因变量将肝脏脂肪含量以及上述相关指标进行线性多元逐步回归分析法建立回归模型。模型中只有肝脏脂肪含量进入最后的回归方程,是胰岛素敏感性的独立危险因素(Y=9.007-30.562X,F=56.06,P<0.01),模型R2为0.717,提示M值作为胰岛素敏感性判断标准时肝脏脂肪含量可以解释71.7%胰岛素敏感性的改变。
3 讨论肝脏和骨骼肌是肥胖人群异位脂肪沉积常见部位,研究显示异位脂肪沉积是肥胖人群出现胰岛素抵抗和2型糖尿病的机制之一,且异位脂肪沉积可显著增加心脑血管疾病风险[16]。多年来大量研究者致力于对比不同部位脂肪沉积尤其是肝脏和骨骼肌脂肪沉积对胰岛素抵抗和糖代谢的影响,但至今仍未得到统一的认识[17-18]。由于肝脏和骨骼肌脂肪含量测定技术复杂、胰岛素抵抗评估方法繁多且各种不同方法评估结果相差甚远等原因,更增加了研究的难度[19-20]。本研究采用了胰岛素敏感性评估的金标准即高胰岛素-正常葡萄糖钳夹实验评估胰岛素抵抗,同时采用1HMRS定量测定肝脏和骨骼肌脂肪含量,使研究结果具有较高准确性和参考价值。
1HMRS可以无创实时、准确地对肝脏和骨骼肌脂肪含量进行定量测定,而且可以准确区分骨骼肌肌细胞内脂肪含量和肌纤维细胞外脂肪含量[21]。有创活检方法是测定肝脏脂肪含量的金标准,但对患者创伤较大;目前临床上常用的无创检查方法包括B超、CT以及MRI抑脂序列,但均不能对肝脏脂肪含量做出定量分析[22-23]。骨骼肌脂肪含量包括骨骼肌肌细胞内脂肪含量和骨骼肌肌细胞外脂肪含量,骨骼肌肌细胞内和肌细胞外脂肪的脂肪含量对胰岛素抵抗的影响不尽相同,但是目前活检和CT等方法均无法区分骨骼肌肌细胞内和肌纤维细胞外脂肪,而1HMRS是目前唯一一种可以清晰的鉴别肌细胞内的脂肪和肌细胞外的脂肪的检测方法[24]。因此本研究采用1HMRS测量肝脏和骨骼肌肌细胞内外脂肪含量,研究结果具有较高的准确性和临床参考价值。该研究结果显示肥胖受试者肝脏脂肪含量和胫骨前肌肌细胞内脂肪含量显著增加,而胫骨前肌肌细胞外脂肪含量和比目鱼肌肌细胞内外脂肪含量在不同体型不同糖耐量状态的人群中无显著差异。
肥胖目前是全球性问题[16],在肥胖青少年研究显示肝脏和骨骼肌肌细胞内异位脂肪沉积均与胰岛素抵抗、2型糖尿病发生显著相关[11, 25]。但在成年人的研究中肝脏和骨骼肌异位脂肪沉积与胰岛素抵抗的研究结果却不甚一致。部分成年人研究显示肝脏脂肪和骨骼肌肌内脂肪含量与胰岛素抵抗、2型糖尿病发生密切相关[26-27],而Kotronen等[28]研究显示糖耐量正常的肥胖成年人肝脏脂肪沉积与胰岛素抵抗密切相关但骨骼肌脂肪沉积与胰岛素抵抗不存在相关性,而且通过饮食运动等方法减轻体质量显示肝脏脂肪含量显著下降、胰岛素抵抗改善,但骨骼肌脂肪含量则未见明显改变[29]。上述研究结果的不一致可能与研究方法不同以及研究对象基线资料异质性有关,如不同人种、不同糖代谢状态以及不同体质量指数等。本研究则是第1次探讨不同糖耐量肥胖中国人群,异位脂肪沉积与胰岛素敏感性的相关性,对探讨肥胖与2型糖尿病的相关性以及研究2型糖尿病发病机制具有重要意义。
本组数据显示肥胖人群肝脏和胫骨前肌肌内脂肪含量显著增加,肥胖合并糖耐量异常的人群肝脏脂肪含量较肥胖但糖耐量正常的人群显著增加,而骨骼肌肌细胞内外脂肪含量未见明显增加。以高胰岛素-正常葡萄糖钳夹实验M值和HOMAIR作为胰岛素敏感性判断标准,以HOMAβ作为胰岛β细胞功能判断标准,相关性研究显示肝脏脂肪含量与胰岛素敏感性和胰岛β细胞功能分别存在负相关和正相关,这提示肥胖人群随着肝脏脂肪含量增加,胰岛素敏感性下降,而胰岛β细胞功能呈现代偿性增高趋势。但骨骼肌肌内脂肪含量虽然在肥胖人群中显著增加,但是在糖耐量异常人群未见明显增加而且其与胰岛素敏感性和胰岛β细胞功能均不存在相关性。线性多元回归分析校正混杂因素结果提示只有肝脏脂肪含量进入最后的回归方程。因此提示肝脏脂肪含量是胰岛素敏感性的独立危险因素,是肝脏脂肪含量而不是骨骼肌脂肪含量与胰岛素敏感性、胰岛β细胞功能以及糖代谢异常密切相关。而且我们研究显示在糖耐量正常非肥胖人群、糖耐量正常的肥胖人群以及糖耐量异常的肥胖人群,肝脏脂肪含量均与胰岛素敏感性显著相关,其中糖耐量异常的肥胖人群肝脏脂肪含量与胰岛素敏感性相关性最高。上述结果表明糖耐量正常或糖尿病前期的肥胖人群中即已出现明显胰岛素抵抗,且胰岛素抵抗的程度随着肝脏脂肪沉积的增加而加重,同时伴随胰岛β细胞功能代偿性增强;而胰岛素抵抗程度加重和持续,胰岛β细胞功能最终失代偿将进展为2型糖尿病。因此,可以推测在肥胖人群中肝脏脂肪沉积早于2型糖尿病的发生,肝脏脂肪沉积可能是肥胖人群2型糖尿病发生发展的始动因素之一。本研究结果与既往多个研究结果相一致[27-28],但其机制尚不明确,据推测其可能的机制是肥胖人群肝脏脂肪沉积损伤炎症信号通路、氧化应激激活、线粒体功能不全以及丝氨酸-苏氨酸蛋白激酶激活等[30-31],确切机制仍需进一步的研究和探讨。
综上所述,肝脏脂肪含量而不是骨骼肌脂肪含量与胰岛素抵抗、糖代谢异常发生密切相关且肥胖人群中肝脏脂肪沉积早于2型糖尿病的发生,肝脏脂肪沉积可能是肥胖人群2型糖尿病发生发展的始动因素之一。早期评估肝脏脂肪含量有助于识别2型糖尿病高危人群。
| [1] | Stenka A. Selected proposed treatment methods for obesity. Report from 13th congress of the international association for the study of obesity in stockholm[J]. Forum Zaburzen Metabolicznych, 2010, 1(4): 196-200. |
| [2] | Bhupathiraju SN, Hu FB. Epidemiology of obesity and diabetes and their cardiovascular complications[J]. Circ Res, 2016, 118(11): 1723-35. DOI: 10.1161/CIRCRESAHA.115.306825. |
| [3] | Pischon T, Boeing H, Hoffmann K, et al. General and abdominal adiposity and risk of death in Europe[J]. N Engl J Med, 2008, 359(20): 2105-20. DOI: 10.1056/NEJMoa0801891. |
| [4] | Al-Goblan AS, Al-Alfi MA, Khan MZ. Mechanism linking diabetes mellitus and obesity[J]. Diabetes Metab Syndr Obes, 2014, 7(4): 587-91. |
| [5] | Janghorbani M, Salamat MR, Amini M, et al. Risk of diabetes according to the metabolic health status and degree of obesity[J]. Diabetes Metab Syndr, 2017(1 April): pii: S1871-4021(17)30029-2. |
| [6] | Yang WY, Lu JM, Weng JP, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090-101. DOI: 10.1056/NEJMoa0908292. |
| [7] | Primeau V, Coderre L, Karelis AD, et al. Characterizing the profile of obese patients who are metabolically healthy[J]. Int J Obes (Lond), 2011, 35(7): 971-81. DOI: 10.1038/ijo.2010.216. |
| [8] | Hinnouho GM, Czernichow S, Dugravot A, et al. Metabolically healthy obesity and risk of mortality: does the definition of metabolic health matter?[J]. Diabetes Care, 2013, 36(8): 2294-300. DOI: 10.2337/dc12-1654. |
| [9] | Eckel RH, Kahn SE, Ferrannini E, et al. Obesity and type 2 diabetes: what can be unified and what needs to be individualized[J]. Diabetes Care, 2011, 34(6): 1424-30. DOI: 10.2337/dc11-0447. |
| [10] | Weiss R. Fat distribution and storage: how much, where, and how[J]. Eur J Endocrinol, 2007(157 Suppl 1): S39-45. |
| [11] | Larson-Meyer DE, Newcomer BR, Ravussin E, et al. Intrahepatic and intramyocellular lipids are determinants of insulin resistance in prepubertal children[J]. Diabetologia, 2011, 54(4): 869-75. DOI: 10.1007/s00125-010-2022-3. |
| [12] | Savage DB, Petersen KF, Shulman GI. Disordered lipid metabolism and the pathogenesis of insulin resistance[J]. Physiol Rev, 2007, 87(2): 507-20. DOI: 10.1152/physrev.00024.2006. |
| [13] | Goda A, Masuyama T. Obesity and overweight in Asian People[J]. Circ J, 2016, 80(12): 2425-6. DOI: 10.1253/circj.CJ-16-1087. |
| [14] | International Diabetes Institute/Western Pacific World Health Organization/International, A. for the study of O. I. O. T. Force, The Asia-Pacific perspective: redefining obesity and its treatment. Geneva, Switzerland: World Health Organization, 2000: 56. |
| [15] | 程时武, 陆菊明, 杨国庆, 等. 高胰岛素-正常葡萄糖钳夹技术的建立[J]. 第四军医大学学报, 2007, 28(22): 2082-4. DOI: 10.3321/j.issn:1000-2790.2007.22.021. |
| [16] | Ali AT, Crowther NJ. Body fat distribution and insulin resistance[J]. Nutrients, 2013, 5(6): 2019-27. DOI: 10.3390/nu5062019. |
| [17] | Wolf P, Winhofer Y, Anderwald CH, et al. Intracellular lipid accumulation and shift during diabetes progression[M]. Wiener Medizinische Wochenschrift, 2014: 320-29. |
| [18] | Gastaldelli A. Role of beta-cell dysfunction, ectopic fat accumulation and insulin resistance in the pathogenesis of type 2 diabetes mellitus[J]. Diabetes Res Clin Pract, 2011, 93(Suppl 1): S60-5. |
| [19] | Amati F, Dubé JJ, Alvarez-Carnero E, et al. Skeletal muscle triglycerides, diacylglycerols, and ceramides in insulin resistance another paradox in endurance-trained athletes[J]. Diabetes, 2011, 60(10): 2588-97. DOI: 10.2337/db10-1221. |
| [20] | Sinha R, Dufour S, Petersen KF, et al. Assessment of skeletal muscle triglyceride content by 1H nuclear magnetic resonance spectroscopy in lean and obese adolescents relationships to insulin sensitivity, total body fat, and central adiposity[J]. Diabetes, 2002, 51(4): 1022-27. DOI: 10.2337/diabetes.51.4.1022. |
| [21] | Nissen A, Fonvig CE, Chabanova E, et al. 1H-MRS measured ectopic fat in liver and muscle is associated with the metabolic syndrome in danish girls but not in boys with overweight and obesity[J]. Obes Sci Pract, 2016, 2(4): 376-84. DOI: 10.1002/osp4.v2.4. |
| [22] | Mehta SR, Thomas EL, Bell JD, et al. Non-invasive means of measuring hepatic fat content[J]. World J Gastroenterol, 2008, 14(22): 3476-83. DOI: 10.3748/wjg.14.3476. |
| [23] | Szczepaniak LS, Nurenberg P, Leonard D, et al. Magnetic resonance spectroscopy to measure hepatic triglyceride content: prevalence of hepatic steatosis in the general population[J]. Am J Physiol Endocrinol Metab, 2005, 288(2): E462-8. DOI: 10.1152/ajpendo.00064.2004. |
| [24] | Boesch C, Machann J, Vermathen P, et al. Role of proton Mr for the study of muscle lipid metabolism[J]. NMR Biomed, 2006, 19(7): 968-88. DOI: 10.1002/(ISSN)1099-1492. |
| [25] | Caprio S, Perry R, Kursawe R. Adolescent obesity and insulin resistance: roles of ectopic fat accumulation and adipose inflammation[J]. Gastroenterology, 2017, 152(7): 1638-46. DOI: 10.1053/j.gastro.2016.12.051. |
| [26] | Jacob S, Machann J, Rett K, et al. Association of increased intramyocellular lipid content with insulin resistance in lean nondiabetic offspring of type 2 diabetic subjects[J]. Diabetes, 1999, 48(5): 1113-9. DOI: 10.2337/diabetes.48.5.1113. |
| [27] | Kantartzis K, Machann J, Schick F, et al. The impact of liver fat vs visceral fat in determining categories of prediabetes[J]. Diabetologia, 2010, 53(5): 882-9. DOI: 10.1007/s00125-010-1663-6. |
| [28] | Kotronen A, Seppälä-Lindroos A, Bergholm R, et al. Tissue specificity of insulin resistance in humans: fat in the liver rather than muscle is associated with features of the metabolic syndrome[J]. Diabetologia, 2008, 51(1): 130-8. |
| [29] | Larson-Meyer D, Heilbronn LK, Redman LM, et al. Effect of calorie restriction with or without exercise on insulin sensitivity, β-cell function, fat cell size, and ectopic lipid in overweight subjects[J]. Diabetes Care, 2006, 29(6): 1337-44. DOI: 10.2337/dc05-2565. |
| [30] | Sattar N, Gill JM. Type 2 diabetes as a disease of ectopic fat[J]. BMC Med, 2014, 12(1): 123-8. DOI: 10.1186/s12916-014-0123-4. |
| [31] | Rotman Y, Neuschwander-Tetri BA. Liver fat accumulation as a barometer of insulin responsiveness again points to adipose tissue as the culprit[J]. Hepatology, 2017, 65(4): 1088-90. DOI: 10.1002/hep.29094. |
 2017, Vol. 37
2017, Vol. 37

