目前的研究认为动脉粥样硬化(AS)是一种渐进性疾病,发病过程中脂质沉积,内膜层增厚,形成动脉粥样硬化斑块[1]。动脉粥样硬化形成机制复杂,大量研究表明细胞凋亡在AS的产生机制中起重要作用[2-3]。在AS的病理过程中,脂质的氧化修饰和炎症反应的调节均涉及到细胞凋亡,Fortilin蛋白可以通过减少巨噬细胞凋亡而促进动脉粥样硬化的进程[4]。血管平滑肌细胞和巨噬细胞的凋亡增殖比例与动脉硬化斑块的形成和破裂有密切关系[5-6]。
Bcl-2蛋白是外在和内在细胞凋亡信号通路的主要调节蛋白[7],在AS过程中的脂类物质的氧化应激和炎症细胞的增殖凋亡中发挥重要的调节作用[8]。近年研究发现他汀类药物可通过影响AS血管的细胞凋亡和增殖而发挥抗AS作用[9],但其详细机制尚不清楚。本研究拟通过免疫组化法检测AS大鼠血管壁中凋亡相关基因Bcl-2的蛋白表达及应用原位末端TUNEL法检测细胞AI,探讨AS过程中细胞凋亡的变化、细胞凋亡机制在动脉粥样硬化中所起的作用以及辛伐他汀独立于调脂之外的对AS的可能干预作用,为临床治疗提供理论依据。
1 材料和方法 1.1 实验动物与试剂SD雄性健康大鼠36只,清洁级,体质量80~100 g,购自浙江省实验动物中心。维生素D3(通用药业);丙基硫氧嘧啶(朝晖药业);胆酸钠及胆固醇(天启化工科技);辛伐他汀(舒降之,默沙东);猪油为市售食用猪油。
1.2 模型建立所有大鼠应用标准饲料适应性喂养1周,随机分为对照组10只,干预组13只,实验组13只。对照组喂以普通饲料,干预组和实验组均于实验前一次性腹腔内注射维生素D3(600 000 U/kg),再喂以高脂饲料(配方为:0.2%丙硫氧嘧啶、0.5%胆酸钠、3%胆固醇、5%白糖、10%猪油、81.3%基础饲料)。6周以后,干预组在原喂养基础上加用辛伐他汀5 mg/(kg·d)灌胃,对照组和实验组则给予相同体积的生理盐水进行灌胃,继续喂养4周。所有大鼠均按实验室标准流程饲养。
1.3 标本处理与收集饲养11周后,所有动物于实验结束时,10%水合氯醛溶液以0.3 mL/100 g腹腔注射麻醉下,剖胸取胸主动脉,所取标本组织应用10%缓冲福尔马林固定液固定,常规石蜡包埋、切片、HE染色,光镜下观察胸主动脉标本组织形态。
1.4 免疫组化法Bcl-2试剂盒购自Santa Cruz公司,应用免疫组化Elivision法对各组组织标本进行Bcl-2蛋白表达检测,操作步骤按试剂说明书进行。
1.5 TUNEL细胞凋亡原位检测原位细胞凋亡(TUNEL)检测试剂盒购自Roche公司,应用TUNEL法对各组组织标本进行凋亡细胞检测,操作步骤按试剂说明书进行。
1.6 结果判断Bcl-2蛋白检测:Bcl-2蛋白阳性着色通常位于血管壁内膜层或中膜层淋巴细胞、血管平滑肌细胞、血管内皮细胞和巨噬细胞的胞浆或胞膜上,呈现为棕黄色颗粒样物质。采用半定量法进行统计,每张切片随机观察10个高倍视野,每个视野计数200个细胞,观察阳性细胞的显色度并统计阳性细胞数量,按阳性细胞所占百分比进行统计评分。细胞不着色为0分,浅黄色为1分,黄色为2分,棕褐色为3分;阳性细胞<10%计0分,10%~50%计1分,51%~75%计2分,>75%计3分,两者分数相乘,得分为0分为阴性(-),1~4分为弱阳性(+),>4分为强阳性(++)。
TUNEL结果判定:阳性着色细胞呈棕黄色,位于细胞核,为固缩状,高倍镜下呈现碎点或碎块样,每张切片随机观察10个高倍视野,每个视野计数200个细胞,统计阳性细胞数量,计算AI,AI=凋亡细胞个数/所有细胞个数×100%,以AI反映各组细胞凋亡的程度,AI<5%为阴性(-),AI为5%~10%为弱阳性(+),AI>10%为强阳性(++)。
1.7 统计学处理应用IBM SPSS软件进行统计分析,计数资料采用秩和检验,当P<0.05认为差异有统计学意义。
2 结果在整个动物饲养实验过程中出现4只大鼠死亡,分别是对照组1只,干预组1只,实验组2只。
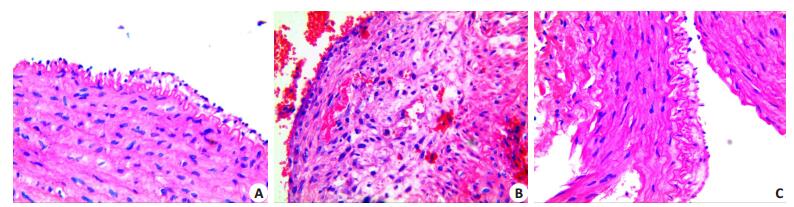
2.1 病理形态学改变光镜下对照组主动脉组织内膜、中膜、外膜3层结构完整,层次分界清楚,内膜层薄、未见斑块;干预组内膜层局部有斑块形成、泡沫细胞较少,内膜增生程度较轻,弹力纤维和胶原纤维排列较对照组紊乱。实验组内膜层结构较前两组明显增厚,脂质斑块浸润,并见有较多泡沫细胞聚集,平滑肌细胞、弹力纤维和胶原纤维排列较紊乱,中膜弹力纤维也较对照组和干预组增粗(图 1)。
|
图 1 血管组织HE染色结果 Figure 1 HE staining of the aortic tissue in different groups. A: Control group; B: Experimental group; C: Intervention group (HE staining, original magnification: ×100). |
免疫组化结果表明,Bcl-2蛋白的阳性颗粒主要存在于血管壁内膜层和中膜层淋巴细胞、血管平滑肌细胞、血管内皮细胞和巨噬细胞的胞浆或胞膜上,呈现出棕黄色颗粒样物质。在3组中Bcl-2蛋白均有不同程度的表达,表达水平在实验组明显低于对照组及干预组(P均<0.05),干预组和对照组比较无统计学意义(表 1、图 2)。
| 表 1 各组Bcl-2蛋白的表达水平比较 Table 1 Expression level of Bcl-2 protein in the 3 groups |

|
图 2 Bcl-2蛋白在各组的表达结果 Figure 2 Expression level of Bcl-2 protein in the aortic tissue in the 3 groups. A: High expression of Bcl-2 protein in the control group; B: Lower expression of Bcl-2 protein in the experimental group; C: High expression of Bcl-2 protein expression in the intervention group (Elivision method, ×100). |
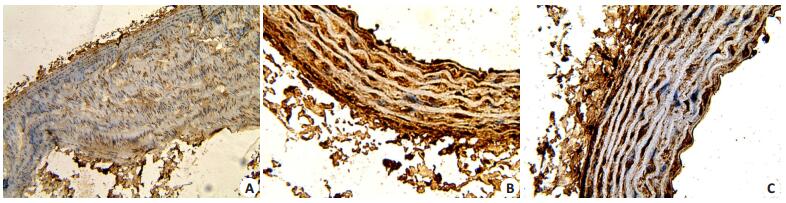
凋亡细胞的细胞核呈棕黄色、固缩状,高倍镜下呈碎块状或碎点状,主要发生于血管平滑肌细胞、血管内皮细胞及巨噬细胞,实验结果表明实验组AI明显高于对照组及干预组(P均<0.05),对照组与干预组比较无统计学意义(表 2、图 3)。
| 表 2 各组细胞凋亡指数比较 Table 2 The level of AI in the 3 groups |
|
图 3 各组的细胞凋亡指数 Figure 3 The level of AI of the aortic endothelial cells in the 3 groups. A: Moderate level of AI in the control group; B: High level of AI in the experimental group; C: Moderate level of AI in the intervention group (Elivision method, ×100). |
近年研究表明细胞凋亡在AS的形成和发展中发挥重要作用,在AS斑块上的血管平滑肌细胞、巨噬细胞、血管内皮细胞、T淋巴细胞均有细胞凋亡现象发生[1-4]。本研究发现在3组大鼠的血管壁中均检测到的凋亡细胞,主要是血管内皮细胞、血管平滑肌细胞以及巨噬细胞,实验组AI明显高于对照组及干预组大鼠(P<0.05)。研究也发现实验组Bcl-2蛋白表达明显低于对照组及干预组(P<0.05),然而,AI及Bcl-2蛋白表达在干预组与对照组间无统计学意义。
在本研究中光镜下对照组主动脉组织内膜、中膜、外膜3层结构完整,层次分界清楚,内膜层薄、未见斑块;干预组内膜层局部有斑块形成、泡沫细胞较少,内膜增生程度较轻,弹力纤维和胶原纤维排列较对照组紊乱。实验组内膜层结构较前两组明显增厚,脂质斑块浸润,并见有较多泡沫细胞聚集,平滑肌细胞、弹力纤维和胶原纤维排列较紊乱,中膜层胶原纤维和弹力纤维也较对照组和干预组增粗。
血管内皮细胞的损伤和功能障碍是AS的始动因素,参与启动AS过程,血管平滑肌细胞和巨噬细胞的凋亡则可导致动脉粥样硬化斑块的不稳定[10]。在不稳定斑块上有大量的凋亡细胞,并可导致斑块破裂,诱发急性冠脉综合征的发生,特别是对血管壁中T细胞的功能影响[11]。有报道指出血管内皮细胞的凋亡可通过miR-155蛋白表达调节,同时也与低密度脂蛋白的氧化密切相关[12-13]。本研究中我们应用TUNEL法在实验组大鼠的血管壁中检测到较多的凋亡细胞,主要是淋巴细胞、血管内皮细胞、血管平滑肌细胞以及巨噬细胞,实验组AI明显高于对照组大鼠,结果表明在AS过程中有细胞凋亡机制参与,并且在AS过程细胞凋亡明显增加。
凋亡调节异常是AS病变进展中的重要因素,参与斑块的发生,以及斑块的稳定性[14-15]。细胞凋亡已被确认是AS的重要特征,通过干预细胞凋亡过程可发挥抗AS作用[15]。有研究表明细胞凋亡过程受Bax和Bcl-2基因表达比例的调控,Bcl-2为抗凋亡基因,而Bax为促凋亡基因,两者比例增加,表现为细胞增殖[16],反之,凋亡增加[17]。Bcl-2主要参与细胞凋亡的线粒体途径,其表达增加可引起细胞增殖,表达下调则导致凋亡增加[18-19]。研究表明在AS斑块中,Bcl-2参与血管平滑肌细胞、血管内皮细胞和巨噬细胞的凋亡过程,特别是对巨噬细胞的细胞凋亡发挥重要作用[20]。Thorp[21]通过研究apoE基因敲除的AS小鼠,发现Bcl-2在巨噬细胞的凋亡过程中发挥抗凋亡作用。在糖尿病大鼠动物模型中也发现了同样的现象[22]。我们研究发现实验组Bcl-2蛋白表达明显低于对照组(P<0.05),并且主要表达于血管壁的血管平滑肌细胞、淋巴细胞和巨噬细胞的胞膜或胞浆内,结果表明Bcl-2蛋白在AS血管壁中的低表达表明其通过促进细胞凋亡在AS过程中发挥作用。我们还发现,实验组的AI显著高于干预组,Bcl-2蛋白表达明显低于干预组,而AI及Bcl-2蛋白表达在干预组与对照组间无统计学意义,这表明辛伐他汀可通过上调Bcl-2基因表达发挥抗AS作用。既往研究证实他汀类药物可直接影响细胞的生存,具有独立于调脂之外的抗炎性反应的作用,通过抑制炎性反应从而调控淋巴细胞、巨噬细胞细胞凋亡过程[23]。同时早期应用他汀类药物后,激活的T淋巴细胞对血管内皮细胞的损伤明显被抑制,血管内皮细胞的凋亡也明显减少,破裂、破溃的不稳定斑块逐渐趋于稳定,可预防心脑血管事件的发生[24]。应用他汀类药物干预后的患者冠心病的死亡率和心肌梗死的发生率均明显下降,特别是急性冠脉综合征的发生率也明显降低[25]。
总之,在AS过程中有细胞凋亡机制参与,辛伐他汀可以抑制大鼠AS的细胞凋亡,从而延缓或阻碍AS的发展,其作用机制可能是通过上调Bcl-2基因表达发挥抗AS作用,本文研究结果为辛伐他汀在抗AS中提供可能的新理论依据。
| [1] | Linton MF, Babaev VR, Huang J, et al. Macrophage apoptosis and efferocytosis in the pathogenesis of atherosclerosis[J]. Circ J, 2016, 80(11): 2259-68. DOI: 10.1253/circj.CJ-16-0924. |
| [2] | Karaflou M, Lambrinoudaki I, Christodoulakos G. Apoptosis in atherosclerosis: a mini-review[J]. Mini Rev Med Chem, 2008, 8(9): 912-8. DOI: 10.2174/138955708785132765. |
| [3] | Su G, Sun G, Liu H, et al. Niacin suppresses progression of atherosclerosis by inhibiting vascular inflammation and apoptosis of vascular smooth muscle cells[J]. Med Sci Monit, 2015, 21: 4081-9. DOI: 10.12659/MSM.895547. |
| [4] | Pinkaew D, Le RJ, Chen Y, et al. Fortilin reduces apoptosis in macrophages and promotes atherosclerosis[J]. Am J Physiol Heart Circ Physiol, 2013, 305(10): H1519-29. DOI: 10.1152/ajpheart.00570.2013. |
| [5] | Ping S, Li Y, Liu S, et al. Simultaneous increases in proliferation and apoptosis of vascular smooth muscle cells accelerate diabetic mouse venous atherosclerosis[J]. PLoS One, 2015, 10(10): e0141375. DOI: 10.1371/journal.pone.0141375. |
| [6] | Bobryshev YV, Ivanova EA, Chistiakov DA, et al. Macrophages and their role in atherosclerosis: pathophysiology and transcriptome analysis[J]. Biomed Res Int, 2016, 2016(5): 9582430. |
| [7] | Moya A, Sakamaki K, Mason BM, et al. Functional conservation of the apoptotic machinery from coral to man: the diverse and complex Bcl-2 and caspase repertoires of Acropora millepora[J]. BMC Genomics, 2016, 17(1): 62. DOI: 10.1186/s12864-015-2355-x. |
| [8] | Qin B, Xiao B, Liang D, et al. MicroRNAs expression in ox-LDL treated HUVECs: MiR-365 modulates apoptosis and Bcl-2 expression[J]. Biochem Biophys Res Commun, 2011, 410(1): 127-33. DOI: 10.1016/j.bbrc.2011.05.118. |
| [9] | Crisby M, Nordin-Fredriksson G, Shah PK, et al. Pravastatin treatment increases collagen content and decreases lipid content, inflammation, metalloproteinases, and cell death in human carotid plaques: implications for plaque stabilization[J]. Circulation, 2001, 103(7): 926-33. DOI: 10.1161/01.CIR.103.7.926. |
| [10] | Tabas I, Seimon T, Timmins J, et al. Macrophage apoptosis in advanced atherosclerosis[J]. Ann N Y Acad Sci, 2009, 1173(Suppl 1): E40-5. |
| [11] | Milasta S, Dillon CP, Sturm OE, et al. Apoptosis-Inducing-FactorDependent mitochondrial function is required for T cell but not B cell function[J]. Immunity, 2016, 44(1): 88-102. DOI: 10.1016/j.immuni.2015.12.002. |
| [12] | Lee HJ, Lee EJ, Seo M. Galpha12 protects vascular endothelial cells from serum Withdrawal-Induced apoptosis through regulation of miR-155[J]. Yonsei Med J, 2016, 57(1): 247-53. DOI: 10.3349/ymj.2016.57.1.247. |
| [13] | Fan J, Zhang W, Liu Q. Human cytomegalovirus-encoded miR-US25-1 aggravates the oxidised low density lipoprotein-induced apoptosis of endothelial cells[J]. Biomed Res Int, 2014, 2014: 531979. |
| [14] | Babaev VR, Ding L, Zhang Y, et al. Macrophage IKKα deficiency suppresses Akt phosphorylation, reduces cell survival, and decreases early atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2016, 36(4): 598-607. DOI: 10.1161/ATVBAHA.115.306931. |
| [15] | Zhang Y, Qin W, Zhang L, et al. MicroRNA-26a prevents endothelial cell apoptosis by directly targeting TRPC6 in the setting of atherosclerosis[J]. Sci Rep, 2015, 5: 9401. DOI: 10.1038/srep09401. |
| [16] | Foight GW, Keating AE. Locating herpesvirus Bcl-2 homologs in the specificity landscape of Anti-Apoptotic Bcl-2 proteins[J]. J Mol Biol, 2015, 427(15): 2468-90. DOI: 10.1016/j.jmb.2015.05.015. |
| [17] | O'neill KL, Huang K, Zhang J, et al. Inactivation of prosurvival Bcl-2 proteins activates Bax/Bak through the outer mitochondrial membrane[J]. Genes Dev, 2016, 30(8): 973-88. DOI: 10.1101/gad.276725.115. |
| [18] | Lindqvist LM, Heinlein M, Huang DC, et al. Prosurvival Bcl-2 family members affect autophagy only indirectly, by inhibiting Bax and Bak[J]. Proc Natl Acad Sci USA, 2014, 111(23): 8512-7. DOI: 10.1073/pnas.1406425111. |
| [19] | Kang J, Chong SJ, Ooi VZ, et al. Overexpression of Bcl-2 induces STAT-3 activation via an increase in mitochondrial superoxide[J]. Oncotarget, 2015, 6(33): 34191-205. |
| [20] | Kutuk O, Basaga H. Bcl-2 protein family: implications in vascular apoptosis and atherosclerosis[J]. Apoptosis, 2006, 11(10): 1661-75. DOI: 10.1007/s10495-006-9402-7. |
| [21] | Thorp E, Li Y, Bao L, et al. Brief report: increased apoptosis in advanced atherosclerotic lesions of Apoe-/-mice lacking macrophage Bcl-2[J]. Arterioscler Thromb Vasc Biol, 2009, 29(2): 169-72. DOI: 10.1161/ATVBAHA.108.176495. |
| [22] | Wang J, Han L, Wang ZH, et al. Overexpression of STAMP2 suppresses atherosclerosis and stabilizes plaques in diabetic mice[J]. J Cell Mol Med, 2014, 18(4): 735-48. DOI: 10.1111/jcmm.2014.18.issue-4. |
| [23] | Matsuo K, Akakabe Y, Kitamura Y, et al. Loss of apoptosis regulator through modulating IAP expression (ARIA) protects blood vessels from atherosclerosis[J]. J Biol Chem, 2015, 290(6): 3784-92. DOI: 10.1074/jbc.M114.605287. |
| [24] | Sato K, Nuki T, Gomita K, et al. Statins reduce endothelial cell apoptosis via inhibition of TRAIL expression on activated CD4 T cells in acute coronary syndrome[J]. Atherosclerosis, 2010, 213(1): 33-9. DOI: 10.1016/j.atherosclerosis.2010.03.034. |
| [25] | Tabas I, Bornfeldt KE. Macrophage phenotype and function in different stages of atherosclerosis[J]. Circ Res, 2016, 118(4): 653-67. DOI: 10.1161/CIRCRESAHA.115.306256. |
 2017, Vol. 37
2017, Vol. 37

