2. 安徽省感染与免疫重点实验室(蚌埠医学院);
3. 蚌埠医学院科研中心,安徽 蚌埠 233030;
4. 解放军123医院传染科,安徽 蚌埠 233010;
5. 蚌埠市传染病医院呼吸科,安徽 蚌埠 233010
2. Anhui Provincial Key Laboratory of Infection and Immunity;
3. Science Research Center, Bengbu Medical College, Bengbu 233030, China;
4. Department of Infectious Disease, 123 Hospital of PLA, Bengbu 233010, China;
5. Department of Respiratory Medicine, Bengbu Infection Hospital, Bengbu 233010, China
结核杆菌耐热抗原(Mtb-HAg)是将Mtb无毒株H37Ra经121 ℃热处理后,从菌体胞浆释放到上清液中的一种多肽类抗原,研究证实该抗原可体外特异性激活和扩增人γδT细胞[1-2]。本实验室在前期研究中应用流式细胞术检测发现Mtb-HAg刺激下肺结核(PTB)患者外周血Mtb-HAg特异性γδT细胞中IFN-γ和TNF-α产生细胞比例显著低于结核潜伏感染者(LTBI)和健康者[3-4]而PTB患者和LTBI者外周血总T细胞中两种细胞因子的表达没有显著差异。Mtb-HAg-10k是从Mtb-HAg中提取的相对分子质量在10 000~14 000的小分子成分,在活化人γδT细胞中起主要作用,而Mtb-HAg中的大分子成分则主要激活αβT细胞[1, 5]。因此我们推测以Mtb-HAg-10k为刺激剂可能对外周血αβT细胞产生细胞因子的激活作用更弱,从而使IFN-γ和TNF-α更多的来源于γδT细胞。本研究以Mtb-HAg-10k为刺激剂,并以Mtb-HAg、多克隆刺激剂植物血凝素(PHA)作为对照,通过多色流式细胞技术比较刺激后外周血T细胞亚群IFN-γ和TNF-α产生细胞的数量和分布特点,酶联免疫斑点技术(ELISPOT)检测分析PTB患者和LTBI者外周血单个核细胞(PBMC)中IFN-γ产生细胞的数量差异,初步探讨Mtb-HAg-10k作为诊断抗原鉴别PTB和LTBI的可行性。
1 资料和方法 1.1 标本正常成人外周血采集自蚌埠医学院教职工和学生,年龄21~55岁,近期无感染性疾病史,体检胸部X线检查正常,并排除PTB、肿瘤、自身免疫病等疾病。16例正常人外周血经结核杆菌感染T细胞酶联免疫斑点试剂盒检测,从阳性检测结果筛选出LTBI者6例,其余10例作为健康对照(HC)。具体判断标准[3]:阳性:如阴性对照孔斑点数为0~5个,测试孔A和(或)测试孔B的斑点数减去阴性对照孔斑点数≥6个。如阴性对照孔斑点数≥6个,测试孔A和(或)测试孔B的斑点数必须≥2倍阴性对照斑点数。13例PTB患者外周血来自蚌埠市传染病医院呼吸科,年龄23~61岁,均符合中华医学会结核病学分会2001年《肺结核诊断和治疗指南》中肺结核病诊断标准,且无肿瘤、自身免疫病、艾滋病等其他合并疾病。每份标本均获得本人的知情同意,并且通过蚌埠医学院伦理委员会批准。
1.2 材料APC标记的小鼠抗人CD3单克隆抗体(CD3-APC)及PE标记的小鼠IgG1同型抗体(mIgG1-PE)(Invitrogen);APC vio770标记的小鼠抗人TCRγδ单克隆抗体(TCRγδ-APC vio770)、FITC标记的小鼠抗人IFN-γ单克隆抗体(IFN-γ-FITC)(Miltenyi Biotec);莫能霉素(Monensin)、PE标记的小鼠抗人TNF-α(Biolegend);FITC标记的小鼠IgG1同型抗体(mIgG1-FITC)(天津协科生物技术);透膜缓冲液(eBioscience);结核杆菌感染T细胞酶联免疫斑点诊断试剂盒(Human TB IFN-γ precoated ELISPOT kit),产品编号:DKWTB-1002-096(strips)(深圳达科为);PHA(Sigma);淋巴细胞分离液(天津灏洋生物科技);小牛血清(杭州四季青);染色缓冲液(SB)、封闭液、固定液(2%多聚甲醛)均由本实验室自制。快速液相蛋白分离纯化系统(AKTA Explorer 100)(GE);流式细胞仪(FACS Verse)(BD);荧光酶联免疫斑点检测分析仪(S6)(CTL)。
1.3 Mtb-HAg-10k小分子多肽抗原的制备参照文献[6],从本实验室培养的H37Ra无毒菌株中提取制备Mtb-HAg,将Mtb-HAg通过截留相对分子质量为30 000、10 000、3000超滤管进行离心超滤,收取Mtb-HAg低分子组分,即可通过10 000超滤管,但3000超滤管截留部分,离心收取的上清液经0.22 μm微孔滤膜过滤并测定浓度,经快速蛋白液相色谱分析为含10 000~ 14 000 Mtb-HAg小分子多肽(Mtb-HAg-10k),4 ℃保存备用。
1.4 分离人PBMC肝素钠抗凝全血与等体积RPMI 1640培养液混匀,缓慢叠加在淋巴细胞分离液上,2000 r/min,离心15 min。获取PBMC,加入含10%小牛血清的RPMI 1640培养液,1500 r/min,离心10 min后,弃去上清液。用含10%小牛血清的RPMI 1640培养液调整细胞浓度后备用。
1.5 流式细胞术检测Mtb-HAg-10k特异性γδT细胞中TNF-α和IFN-γ产生细胞比例和细胞因子分布特点调整PBMCs浓度为(1~1.5)×106/mL,取500 μL/孔置于48孔培养板中,。按实验设计分为4组(3复孔/组):1、阴性对照组:不加任何刺激剂;2、PHA刺激组:加入PHA(终浓度2.5 μg/mL);3、Mtb-HAg刺激组:加入Mtb-HAg(终浓度10 μg/mL);4、Mtb-HAg-10k刺激组:加入Mtb-HAg-10k(终浓度10 μg/mL)。各组细胞置于37 ℃、5% CO2培养箱中培养14 h后,加入高尔基体阻断剂Monensin(终浓度5 μmol/L)继续培养6 h以阻止细胞因子分泌到细胞外。培养结束后收集各组细胞,用SB洗涤2次后,弃上清每管加入500 μL SB重悬细胞,吸取100 μL细胞悬液(约1×105细胞)加入到流式管中,依次加入TCRγδ-APC vio770、CD3-APC进行表面分子染色,混匀后4 ℃避光反应30 min。每管洗涤1次后,加2%多聚甲醛200 μL固定30 min。,再洗涤1次,尽可能弃上清,加透膜缓冲液100 μL,同时加入3.5 μL封闭液(由小鼠血清和10%牛血清白蛋白按1:4混合而成)混匀避光30 min,在检测管内加入TNF-α-PE、IFN-γ-FITC作胞内染色,同型对照管中加入等量的同型对照抗体mIgG1-PE和mIgG1-FITC,4 ℃避光反应30 min。洗涤2次后弃上清,加2%多聚甲醛300 μL重悬细胞,应用流式细胞仪检测样本,检测数据用flowjo软件进行分析。
1.6 ELISPOT技术检测Mtb-HAg-10k特异性PBMCs中IFN-γ产生细胞数量调整PBMCs浓度为2.5×106/mL,取100 μL/孔加入ELISPOT检测试剂盒中的96孔板内,共计6孔。6孔分别为阴性对照孔:只加细胞培养液,不加任何刺激剂;阳性对照孔:加入PHA(终浓度2.5 μg/mL);Mtb-HAg孔:加入Mtb-HAg(终浓度10 μg/mL);Mtb-HAg-10k孔:加入Mtb-HAg-10k(终浓度10 μg/mL);结核杆菌抗原A孔(加MTB特异性混合多肽A 10 μL);结核杆菌抗原B孔(加MTB特异性混合多肽B 10 μL)。将细胞悬液置于5% CO2、37 ℃培养箱内培养20 h后,每孔加入4 ℃去离子水200 μL 10 min以裂解细胞;每孔加入200 μL洗涤液洗板5次,每孔加入100 μL生物素标记的抗人INF-γ抗体孵育1 h;洗板5次,每孔加入100 μL辣根过氧化物酶标记的酶联亲和物孵育1 h。洗板5次,每孔加入显色底物液100 μL,室温避光放置25 min。加入去离子水洗板2次中止显色。检测板放置在通风处自然晾干。荧光酶联免疫斑点检测分析仪(S6)进行斑点计数和数据分析。
1.7 统计学方法各实验组数据以均数±标准差表示,使用SPSS18.0软件进行处理,采用方差分析和q检验,P < 0.05具有统计学意义。
2 结果 2.1 Mtb-HAg-10k特异性诱导人外周血γδT细胞产生TNF-α和IFN-γ流式细胞术检测γδT细胞产生细胞因子TNF-α和IFN-γ水平,结果显示Mtb-HAg-10k特异性γδT细胞中TNF-α产生细胞和IFN-γ产生细胞比例分别为(13.41± 3.01)%,(7.18 ± 1.77)%显著高于PHA对照组[(6.99 ± 3.23)%,(2.62±1.64)%,P < 0.01];而Mtb-HAg-10k特异性αβT细胞中TNF-α产生细胞和IFN-γ产生细胞比例分别为(0.15±0.17)%,(0.06±0.04)%显著低于PHA对照组[(3.65±1.33)%,(0.61±0.28)%,P < 0.01],Mtb-HAg-10k特异性αβT细胞中IFN-γ产生细胞比例(0.06±0.04)%显著低于Mtb-HAg刺激组[(0.14 ± 0.03)%,P < 0.01],Mtb-HAg-10k刺激下αβT细胞中TNF-α产生细胞比例与Mtb-HAg刺激组、阴性对照组均无显著性差异(图 1、2)。
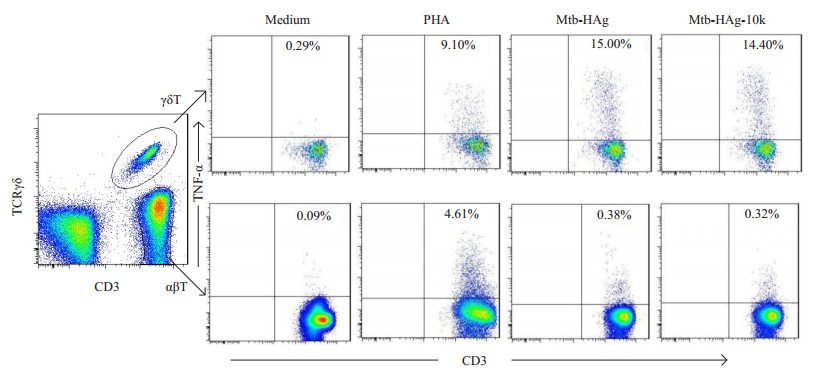
|
图 1 不同刺激剂作用下外周血γδT和αβT细胞中TNF-α产生细胞比例 Figure 1 Proportion of TNF-α-producing cells in γδT and αβ T cells following different stimulations. |
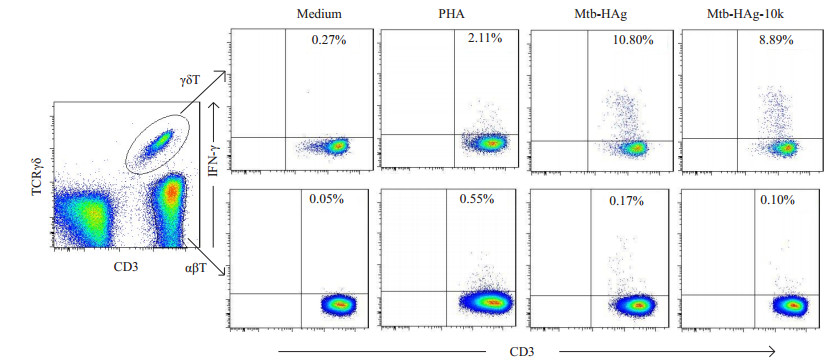
|
图 2 不同刺激剂作用下外周血γδT和αβT细胞中INF-γ产生细胞比例 Figure 2 Proportion of INF-γ-producing cells in γδT and αβT cells following different stimulations. |
Mtb-HAg-10k组和Mtb-HAg组在γδT细胞中TNF-α产生细胞的比例分别为(13.41±3.01)%,(15.86±4.15)%均显著高于IFN-γ产生细胞比例[(7.18±1.77)%,(9.18± 3.40)%,P < 0.01];PHA组αβT细胞中产生TNF-α细胞比例(3.65 ± 1.33)%显著高于产生IFN-γ细胞比例[(0.61±0.28)%,P < 0.01],而Mtb-HAg-10k组和Mtb-HAg组αβT细胞中TNF-α产生细胞比例(0.15 ± 0.17)%,(0.25 ± 0.14)%与同组IFN-γ产生细胞比例(0.06 ± 0.04)%,(0.14±0.03)%比较,均无显著性差异(P>0.05)。
2.3 Mtb-HAg-10k特异性γδT细胞产生细胞因子TNF-α和IFN-γ的分布特点在Mtb-HAg组、Mtb-HAg-10k组、PHA组中γδT细胞共表达TNF-α和IFN-γ的比例分别为:(8.05±3.09)%,(6.21±1.78)%,(1.93±1.42)%,三组IFN-γ+γδT细胞中同时表达TNF-α的细胞比例分别是:(85.82±6.43)%,(87.47±7.13)%,(69.64±16.58)%,Mtb-HAg-10k组、Mtb-HAg组显著高于PHA组(P < 0.05),Mtb-HAg组与Mtb-HAg(10k)组之间的差异无统计学意义(P>0.05,图 3)。
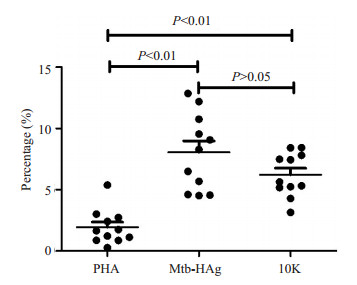
|
图 3 不同刺激剂作用下γδT中共表达TNF-α和INF-γ的细胞比例 Figure 3 Proportion of INF-γ-and TNF-α-producing cells in γδT cells following different stimulations. |
分别以Mtb-HAg-10k、Mtb-HAg、PHA为刺激剂作用于PBMCs 20 h后,应用ELISPOT技术检测PBMCs中IFN-γ产生细胞数量。结果显示,同一群体中MtbHAg-10k组IFN-γ产生细胞数均显著低于PHA刺激组(P < 0.01)和Mtb-HAg刺激组(P < 0.01)。Mtb-HAg-10k刺激下肺结核患者PBMCs中IFN-γ产生细胞数显著低于LTBI者(P < 0.01)和HC(P < 0.01),而在Mtb-HAg组、PHA刺激组各人群间没有差异(P>0.05,表 1)。
| 表 1 不同人群PBMCs中IFN-γ产生细胞数量 Table 1 Number of IFN-γ-producing cells in PBMCs from different subjects |
γδT细胞是表达TCRγδ的一类特殊T细胞亚群,约占人外周血T淋巴细胞总数的5%,它识别抗原没有MHC限制性,经嗜乳脂蛋白(BTN)3A1等分子递呈的磷酸类抗原刺激而被快速活化增殖[7-8],可通过释放穿孔素和颗粒酶等细胞毒性物质直接杀伤靶细胞[9-10],也可通过分泌细胞因子发挥免疫调节作用[11],因此γδT细胞能较αβT细胞更早更迅速在感染性疾病免疫应答中发挥关键作用[12-13]。研究发现在抗结核感染免疫中TNF-α和INF-γ是两种关键细胞因子[14-15],而γδT细胞是其重要来源细胞[16-17]。
目前体外活化扩增γδT细胞的刺激剂主要是磷酸类抗原[18]。本实验室及其他研究者证实Mtb-HAg也可使人外周血γδT细胞活化增殖[1, 19]。其作用方式可能是通过与TCRγδ直接结合诱导TCRγδ分子发生局部聚集化,导致功能性脂筏形成并促进Src蛋白激酶及其下游的信号分子快速活化从而激活γδT细胞[20]。其中刺激人γδT细胞增殖的活性成分主要存在于相对分子质量在10 000~14 000之间,非分泌性、对蛋白水解酶敏感的小分子多肽中[1, 21],即Mtb-HAg-10k。本研究中我们通过流式细胞术检测发现Mtb-HAg-10k可优势诱导人γδT细胞产生TNF-α和INF-γ,这与我们前期关于Mtb-HAg的研究结果一致[4, 22]。进一步比较Mtb-HAg-10k刺激下αβT细胞中IFN-γ产生细胞比例显著低于Mtb-HAg刺激组,Mtb-HAg-10k刺激下αβT细胞中TNF-α产生细胞比例与Mtb-HAg刺激组、阴性对照组均无显著性差异,这提示着以Mtb-HAg-10k为刺激剂不但能象Mtb-HAg一样使γδT细胞优势产生IFN-γ和TNF-α,同时由于它不含有优势激活αβT细胞的Mtb-HAg大分子组分,从而使得Mtb-HAg-10k诱导的产生TNF-α和IFN-γ的T细胞更多的来源于γδT细胞。
本研究中我们通过流式细胞术检测分析发现Mtb-HAg-10k刺激组总T细胞中TNF-α和IFN-γ产生细胞比例与Mtb-HAg刺激组相比没有显著性差异,这可能与TNF-α和IFN-γ产生细胞在总T细胞中所占比例太少有关(0.40%~1.05%)。但通过ELISPOT技术检测结果显示Mtb-HAg-10k刺激下正常人群PBMCs中分泌IFN-γ细胞数量显著低于Mtb-HAg和PHA刺激组,这是由于ELISPOT比流式细胞术具有更高检测灵敏度(可达到1/104细胞),使得Mtb-HAg-10k和Mtb-HAg刺激下的斑点形成细胞数量差异明显具有统计学意义。
近年来,IFN-γ释放试验已被广泛用于MTB感染的诊断,可用于评估人群中MTB感染率[23-24]。其中结核感染T细胞斑点试验(T-SPOT.TB)就是应用ELISPOT技术检测经结核杆菌特异性抗原ESAT-6或CFP-10刺激后产生IFN-γ的效应性或记忆性αβT细胞数量的方法来判断受试者是否感染MTB,但无法有效区分PTB和LTBI。本研究中我们以Mtb-HAg-10k为刺激剂应用ELISPOT技术检测PTB患者PBMCs中IFN-γ分泌细胞数量显著低于LTBI和HC,这一现象可能与PTB患者γδT细胞在结核分枝杆菌的反复刺激下导致的细胞凋亡和功能异常有关[25]。
综上所述,我们的研究结果表明Mtb-HAg-10k可特异性诱导人外周血γδT细胞产生TNF-α和IFN-γ,应用ELISPOT技术检测Mtb-HAg-10k刺激下PTB患者IFN-γ产生细胞数量显著低于LTBI。这提示基于ELISPOT技术的Mtb-HAg-10k特异性IFN-γ释放试验可有助于区分PTB和LTBI。
| [1] | Boom WH, Balaji KN, Nayak R, et al. Characterization of a 10-to 14-kilodalton protease-sensitive Mycobacterium tuberculosis H37Ra antigen that stimulates human γ δ T cells[J]. Infect Immun, 1994, 62(12): 5511-8. |
| [2] | 朱安友, 吕合作, 张伦军, 等. 结核分枝杆菌耐热抗原激活的人γδT细胞Th2极性分化特征以及T-bet/GATA-3对分化的调控作用[J]. 细胞与分子免疫学杂志, 2015, 31(1): 72-6. |
| [3] | 唐洁, 陈策, 查成, 等. 肺结核患者外周血中结核分枝杆菌耐热抗原特异性的TNF-α+ γδ T细胞数量和亚群分析[J]. 细胞与分子免疫学杂志, 2016, 32(11): 1527-31. |
| [4] | 徐志庆, 夏惠, 李柏青. 不同刺激剂对健康人和结核患者外周血T细胞产生γ干扰素和肿瘤坏死因子-α的影响[J]. 蚌埠医学院学报, 2016, 41(3): 288-91. |
| [5] | 陈勇, 胡建国, 吕合作, 等. 可激活人γδT细胞的结核杆菌耐热多肽抗原的初步纯化与活性鉴定[J]. 免疫学杂志, 2002, 18(3): 176-9, 182. |
| [6] | 孙悝, 陈勇, 徐志庆, 等. 结核分枝杆菌蛋白抗原刺激人γδT细胞的活性单位的计算方法[J]. 免疫学杂志, 2013, 29(4): 341-5. |
| [7] | Rhodes DA, Reith W, Trowsdale J. Regulation of immunity by butyrophilins[J]. Annu Rev Immunol, 2016, 34: 151-72. DOI: 10.1146/annurev-immunol-041015-055435. |
| [8] | Rhodes DA, Chen HC, Price AJ, et al. Activation of human γδ T cells by cytosolic interactions of BTN3A1 with soluble phosphoantigens and the cytoskeletal adaptor periplakin[J]. J Immunol, 2015, 194(5): 2390-8. DOI: 10.4049/jimmunol.1401064. |
| [9] | Dieli F, Troye-Blomberg M, Ivanyi J, et al. Granulysin-dependent killing of intracellular and extracellular Mycobacterium tuberculosis by Vγ9/Vδ2 T lymphocytes[J]. J Infect Dis, 2001, 184(8): 1082-5. DOI: 10.1086/jid.2001.184.issue-8. |
| [10] | Spencer CT, Abate G, Sakala IG, et al. Granzyme a produced by γ(9) δ(2) T cells induces human macrophages to inhibit growth of an intracellular pathogen[J]. PLoS Pathog, 2013, 9(1): e1003119. DOI: 10.1371/journal.ppat.1003119. |
| [11] | Wang L, Das H, Kamath A, et al. Human V γ 2V δ 2 T cells produce IFN-γ and TNF-α with an on/off/on cycling pattern in response to live bacterial products[J]. J Immunol, 2001, 167(11): 6195-201. DOI: 10.4049/jimmunol.167.11.6195. |
| [12] | Bai H, Gao X, Zhao L, et al. Respective IL-17A production by γδ T and Th17 cells and its implication in host defense against chlamydial lung infection[J]. Cell Mol Immunol, 2016, 13: 1-12. DOI: 10.1038/cmi.2015.94. |
| [13] | Chien YH, Meyer C, Bonneville M. γδ T cells: first line of defense and beyond[J]. Annu Rev Immunol, 2014, 32: 121-55. DOI: 10.1146/annurev-immunol-032713-120216. |
| [14] | Dorhoi A, Kaufmann SH. Tumor necrosis factor alpha in mycobacterial infection[J]. Semin Immunol, 2014, 26(3): 203-9. DOI: 10.1016/j.smim.2014.04.003. |
| [15] | Green AM, Difazio R, Flynn JL. IFN-γ from CD4 T cells is essential for host survival and enhances CD8 T cell function during Mycobacterium tuberculosis infection[J]. J Immunol, 2013, 190(1): 270-7. DOI: 10.4049/jimmunol.1200061. |
| [16] | Yao S, Huang D, Chen CY, et al. Differentiation, distribution and γδ T cell-driven regulation of IL-22-producing T cells in tuberculosis[J]. PLoS Pathog, 2010, 6(2): e1000789. DOI: 10.1371/journal.ppat.1000789. |
| [17] | Cheng M, Hu S. Lung-resident γδ T cells and their roles in lung diseases[J]. Immunology, 2017, 151(4): 375-84. DOI: 10.1111/imm.2017.151.issue-4. |
| [18] | Zocchi MR, Costa D, Venè R, et al. Zoledronate can induce colorectal cancer microenvironment expressing BTN3A1 to stimulate effector γδ T cells with antitumor activity[J]. Oncoimmunology, 2017, 6(3): e1278099. DOI: 10.1080/2162402X.2016.1278099. |
| [19] | 陈立, 夏惠, 汪洪涛, 等. 结核分枝杆菌抗原和TCRγδ抗体诱导人γδT细胞分化并产生IL-17[J]. 细胞与分子免疫学杂志, 2015, 31(2): 226-30. |
| [20] | 陈勇, 李柏青. 人γδT细胞TCR分子与结核杆菌多肽抗原特异性结合的证据[J]. 中华微生物学和免疫学杂志, 2005, 25(1): 15-20. |
| [21] | 陈勇, 吕合作, 胡建国. 刺激人γδ T细胞增殖的结核杆菌多肽抗原的生物学特性分析[J]. 细胞与分子免疫学杂志, 2003, 19(2): 121-3. |
| [22] | 盛玲玲, 夏惠, 孙悝, 等. 不同结核杆菌抗原刺激外周血T细胞亚群产生干扰素的比较[J]. 蚌埠医学院学报, 2014, 39(4): 426-8,432. |
| [23] | Auguste P, Tsertsvadze A, Pink J, et al. Accurate diagnosis of latent tuberculosis in children, People who are immunocompromised or at risk from immunosuppression and recent arrivals from countries with a high incidence of tuberculosis: systematic review and economic evaluation[J]. Health Technol Assess, 2016, 20(38): 1-678. DOI: 10.3310/hta20380. |
| [24] | Auguste P, Tsertsvadze A, Pink J, et al. Comparing interferon-γ release assays with tuberculin skin test for identifying latent tuberculosis infection that progresses to active tuberculosis: systematic review and meta-analysis[J]. BMC Infect Dis, 2017, 17(1): 200. DOI: 10.1186/s12879-017-2301-4. |
| [25] | Li B, Bassiri H, Rossman MD, et al. Involvement of the Fas/Fas ligand pathway in activation-induced cell death of mycobacteria-reactive human γ δ T cells: a mechanism for the loss of γ δ T cells in patients with pulmonary tuberculosis[J]. J Immunol, 1998, 161(3): 1558-67. |
 2017, Vol. 37
2017, Vol. 37

