白细胞介素-21(IL-21)是一种具有多样性免疫调节功能的细胞因子,其与IL-2、IL-4、IL-7、IL-9和IL-15同属于Ⅰ型细胞因子家族成员[1]。IL-21主要由多种活化的CD4+T细胞分泌,包括Th17、NKT和Tfh等细胞亚群[2-4]。既往在慢性淋巴细胞脉络丛脑膜炎病毒(LCMV)感染小鼠模型以及人类免疫缺陷病毒感染人群中的研究发现[5-8],病毒特异性CD4+T和CD8+T细胞功能出现部分耗竭,表现为IL-21分泌不足,而增加IL-21表达可提高病毒特异性CD8+T细胞应答能力,进而控制病毒复制,表明IL-21在慢性病毒感染中对病毒控制和疾病转归有着重要的影响。本课题组前期的研究结果表明[9],发生HBeAg血清学转换的非活动性携带期(IC)患者血清IL-21水平显著高于HBeAg阳性的免疫耐受期(IT)患者,提示血清IL-21表达上调可能是机体应对慢性感染和控制病毒过度复制的体现。另外,研究发现HBV DNA低水平的慢性乙型肝炎(CHB)患者其血清IL-21水平较病毒载量高水平患者升高[10]。本课题组对两个独立队列的研究也发现CHB患者抗病毒治疗12周血清IL-21水平可以预测52周HBeAg血清学转换,提示IL-21可能通过调控多种免疫细胞参与了HBV清除和疾病转归[9]。在慢性HBV感染中IL-21通过维持HBV特异性CD8+T细胞的功能抑制病毒复制[10]。可见,在人慢性HBV感染中IL-21对病毒控制起了重要作用,并有望成为慢性HBV感染疾病免疫治疗的新靶点。近期体外研究发现外源性IL-21可增强HBV特异性CD8+T细胞的功能并促进其对HBV的控制,揭示了在慢性HBV感染疾病中IL-21具有一定的潜在治疗价值[11-14]。然而,由于体外研究脱离了体内的微环境,其结果未能很好地外推到完整的机体中,且目前关于外源性IL-21在慢性HBV感染小鼠体内作用的研究尚未见报道,因此本研究我们将通过尾静脉注射绿色荧光蛋白(GFP)和小鼠IL-21双基因共表达的重组腺病毒(AdGFP-mIL-21)至HBV持续表达小鼠模型体内,观察IL-21对体内HBV相关抗原和抗体产生的作用,为IL-21在慢性HBV感染疾病中的治疗应用提供初步的理论依据。
1 材料和方法 1.1 实验动物野生型C57BL/6小鼠(6~8周龄,SPF级),购于南方医科大学实验动物中心。携带1.3拷贝HBV基因组(ayw亚型)的重组8型腺相关病毒(rAAV8-1.3HBV)采用尾静脉注射至野生型C57BL/6小鼠体内构建HBV持续表达小鼠模型[15-16],注射剂量为2×1010 vg/200 µL/只。每只小鼠在注射第0、1、2、3、4、6、8、10、12周进行眼眶后采血,收集血清样品用于HBsAg检测。根据第12周血清HBsAg定量水平将建模小鼠分为实验组和对照组,实验组给予尾静脉注射小鼠IL-21-GFP重组腺病毒(Ad-GFP-mIL21,1×109 PFU/200 µL/只),对照组给予尾静脉注射空载GFP重组腺病毒(Ad-GFP,1×109 PFU/200 µL/只)或PBS(200 µL/只),所有小鼠均在注射第1、4、7、10、13天眼眶后取血留取血清进行后续实验。实验动物的使用获得南方医科大学南方医院动物实验伦理会批准。
1.2 实验试剂rAAV8-1.3HBV(批号:AMV-002 2016041201)购于北京五加和分子医学研究所有限公司,HBsAg(批号:B20150818)、HBsAb(批号:R20151211)和HBcAb(批号:KS20150101)检测试剂盒购于北京万泰生物药业股份有限公司,小鼠IL-21检测试剂盒(批号:4271535)购于eBioscience。
1.3 实验技术 1.3.1 Ad-GFP-mIL-21体外感染HepG2.2.15细胞采用不同浓度(0、0.5×107、1×107、3×107、5×107、10×107、20×107 PFU)的Ad-GFP-mIL-21感染HepG2.2.15细胞,利用荧光显微镜观察重组腺病毒载体感染情况,并于感染后不同时间点(0、12、24、48、72 h)收集培养上清,采用ELISA检测mIL-21浓度;利用Western blot检测靶细胞内mIL-21的表达。
1.3.2 HBsAg、HBsAb、HBcAb以及mIL-21检测根据各试剂盒说明书采用酶联免疫试验(ELISA)方法进行检测,并根据相应的标准曲线换算后进行分析比较。
1.3.3 组织荧光染色取实验组小鼠各器官组织采用OCT(批号:SAKURA 4583)包埋,置于-80 ℃保存,冰冻切片后滴加4,6-二氨基-2-苯基吲哚(DAPI)(批号:ZLI-9557)进行荧光染色。
1.4 统计学处理所有数据采用Graphpad Prism 5.0进行处理和构图。计量资料采用中位数(四分位数间距)表示,两个或多个相关样本的比较分别采用Mann-Whitney U检验或Friedman M检验,配对样本不同处理的计量资料采用Wilcoxon符号秩检验。P<0.05表示差异具有统计学意义。
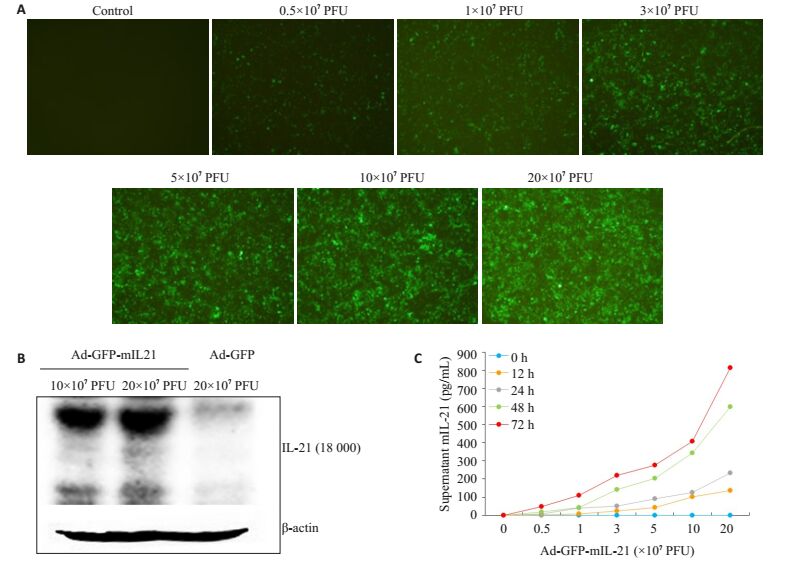
2 结果 2.1 HepG2.2.15细胞表达mIL-21水平与感染Ad-GFPmIL21病毒量相关采用不同浓度的Ad-GFP-mIL21感染HepG2.2.15细胞,感染后24 h时HepG2.2.15细胞内即可见明亮绿色荧光,且随着感染病毒载体浓度的增加,可表达绿色荧光蛋白GFP的靶细胞数量增加(图 1A)。Western blot检测发现感染Ad-GFP-mIL21的HepG2.2.15细胞在相对分子质量约为18 000处可见阳性印记条带(即mIL-21),而感染空病毒载体的HepG2.2.15细胞在目的条带处未见任何信号(图 1B)。ELISA检测发现AdGFP-mIL21感染HepG2.2.15细胞后可产生mIL-21,且细胞培养上清中mIL-21的浓度随着病毒载体浓度和感染时间的延长而增加,呈现浓度时间依赖性;Ad-GFPmIL21(20×107 PFU)感染HepG2.2.15细胞72 h后,上清中mIL-21浓度可高达813.9 pg/mL(图 1C)。
|
图 1 Ad-GFP-mlL21感染HepG2.2.15细胞后检测上清和细胞mlL-21的表达 Figure 1 Expression of mlL-21 in culture supernatant and cytoplasm in HepG2.2.15 cells after infection by Ad-GFPmIL21. A: Observation under fluorescent microscope at 24 h after infection; B: Expression of mIL-21 in the cytoplasm after infection; C: Concentration of mIL-21 in the culture supernatant after infection. |
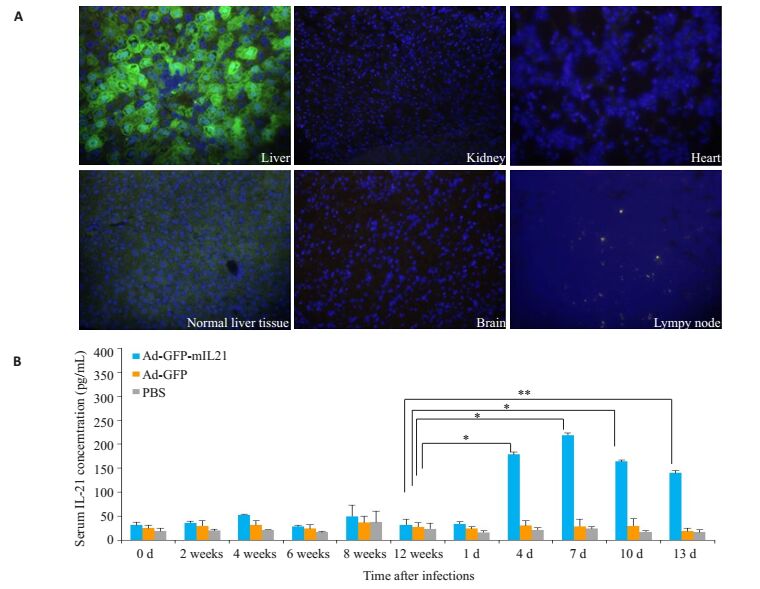
通过尾静脉注射Ad-GFP-mIL21至HBV持续感染小鼠后观察其在体内的分布,结果发现仅肝细胞可表达绿色荧光蛋白GFP,而其他脏器组织,如肾脏、心脏、脑以及淋巴结等均未见绿色荧光表达(图 2A);此外,AdGFP-mIL21予尾静脉注射后第4天,小鼠血清mIL-21水平较处理前显著升高(137.1 pg/mL vs 31.83 pg/mL,P<0.05,图 2A),而注射Ad-GFP或PBS的小鼠血清mIL-21水平未见明显变化(图 2B)。
|
图 2 Ad-GFP-mIL21在HBV持续感染小鼠体内各器官的表达以及血清mIL-21在各组的表达水平 Figure 2 GFP expression in different organs 4 days after injection of Ad-GFP-mIL-21 (A) and changes in serum levels of mIL-21 (B) after tail vein injection of Ad-GFP-mIL-21, Ad-GFP, or PBS in mice with persistent HBV infection.*P < 0.05, **P < 0.01. |
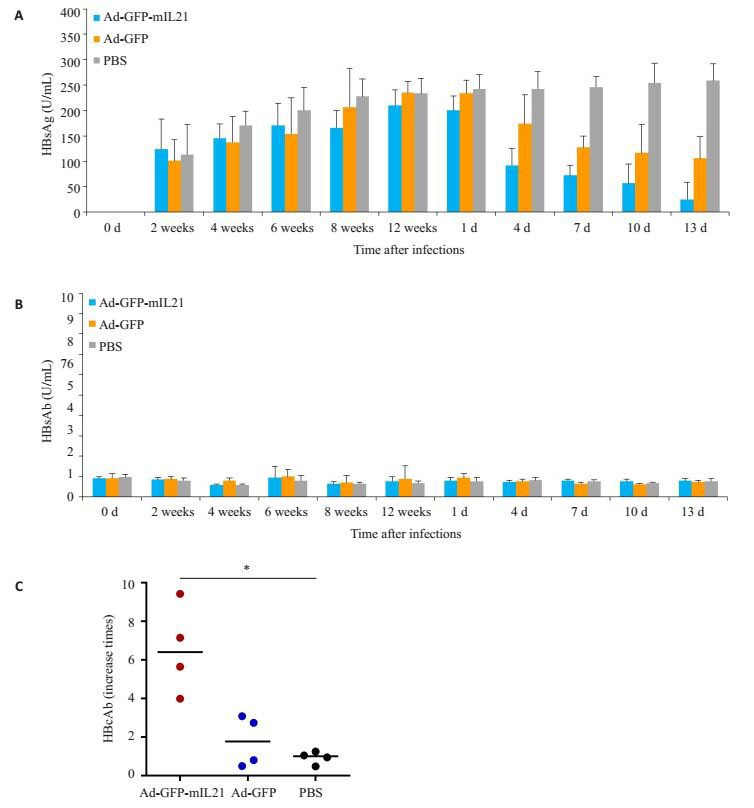
ELISA检测发现注射rAAV8-1.3HBV至C57BL/6小鼠12周后血清HBsAg滴度为220.2 U/mL(216.2~262.4 U/mL),而予Ad-GFP-mIL21、Ad-GFP或PBS处理前小鼠血清HBsAg滴度分别为218.2 U/mL(150.7~262.1 U/mL)、228.3 U/mL(217.2~259.1 U/mL)、233.6U/mL(204.9~262.4 U/mL),组间差异无统计学意义。Ad-GFP尾静脉注射第4天小鼠血清HBsAg滴度为177 U/mL(119.9~224.9 U/mL),而予Ad-GFP-mIL21注射第4天小鼠血清HBsAg滴度为91.61 U/mL(26.03~157.9 U/mL),较处理前下降更明显(图 3A)。第13天时Ad-GFP-mIL-21注射小鼠血清HBsAg滴度较Ad-GFP处理小鼠显著下降[27.49 U/mL(9.938~38.04 U/mL)vs 102.3 U/mL(66.82~148.1 U/mL),P<0.05]。各组小鼠在处理后第13天检测血清HBsAb均为阴性(图 3B),但Ad-GFP-mIL21处理小鼠其血清HBcAb水平较注射Ad-GFP或PBS的小鼠显著升高(图 3C)。
|
图 3 小鼠血清HBsAg、HBsAb和HBcAb的表达水平 Figure 3 Serum levels of HBsAg (A), HBsAb (B), and HBcAb (C) in mice with persistent HBV infection after tail vein injection of Ad-GFP-mIL-21, Ad-GFP, and PBS. |
IL-21是具有强大免疫调节功能的Ⅰ型细胞因子,可调控多种免疫细胞如B细胞、T细胞的功能,在慢性病毒感染疾病中对病毒控制发挥重要作用[5-7, 17-19]。研究表明急性HBV感染患者血清IL-21的水平显著高于慢性HBV持续感染者[20-21],当慢性HBV感染者发生HBsAg血清学转换时其血清IL-21水平较未发生HBsAg血清学转换的患者升高[22],可见IL-21是影响慢性HBV感染转归的重要因素之一。Publicover等[23]在HBV转基因小鼠模型中的研究发现,与幼年小鼠相比,成年受体小鼠肝内IL-21表达水平升高,能诱导有效的细胞免疫和体液免疫应答,肝内CD8+T细胞和B细胞数量增加且功能增强,最终导致HBsAg清除;当过继转移IL-21R缺陷小鼠的脾淋巴细胞后,成年受体小鼠则无法产生HBsAb,导致HBV抗原持续表达,表明在不同年龄阶段发生HBV感染时,体内IL-21水平与预后密切相关,此研究揭示了IL-21信号通路在控制慢性HBV感染中发挥了作用。虽然最近研究显示IL-21可在体外抑制HBV复制[24],然而在慢性HBV持续感染时,外源性给予IL-21能否在体内直接发挥抗病毒效应尚不明确。因此本研究我们借助HBV持续表达的成年小鼠,探讨外源性IL-21在慢性HBV感染时的作用。由于商品化的重组IL-21价格昂贵,且体内易于降解需多次注射,而重组腺病毒具有构建方便且可稳定表达外源性基因[25],因此本研究中我们选用Ad-GFP-mIL-21重组腺病毒进行研究。
本研究结果表明基于腺病毒载体构建的Ad-GFPmIL-21在体外可高效感染HepG2.2.15细胞并能产生mIL-21。Ad-GFP-mIL-21通过尾静脉注射到HBV持续表达小鼠模型后发现Ad-GFP-mIL-21腺病毒载体具有嗜肝性,此结果与Tomko等[26-27]的研究一致。此外我们还发现其在体内感染肝细胞后可产生高浓度mIL-21并可显著降低小鼠血清HBsAg滴度。可见,Ad-GFPmIL-21不仅在体内外均可高效感染靶细胞,且其表达的mIL-21可显示生物学效应,具有应用的潜能。
与Publicover等[24]的研究结果一致,本研究发现HBV持续感染小鼠给予IL-21重组腺病毒注射后其血清HBsAg表达水平逐渐降低,HBcAb滴度明显增加,这一结果表明IL-21可激发体内的体液免疫反应发挥清除病毒作用,且可促进HBV特异性抗体产生。然而,不同于Publicover等[24]在HBV转基因小鼠中的研究结果,本研究中注射了IL-21重组腺病毒的小鼠其血清HBsAb水平仍然处于检测下限,考虑可能是由于小鼠模型不一致所致。本研究中的HBV持续表达小鼠模型通过rAAV8-1.3HBV体内转导法构建,该小鼠模型由于AAV8载体易于诱导免疫耐受导致HBV特异性的体液免疫反应未被充分激活[15],因此在外周血中无法检测到HBsAb。另外,我们考虑亦有可能是体内存在的HBsAg与HBsAb发生了中和反应,致使目前检测手段无法对HBsAb进行定量。此外,由于腺病毒空载体本身可诱导较强烈的天然免疫反应[28-29],给予小鼠注射空载重组腺病毒后亦可发现血清HBsAg水平有所降低。
综上所述,本研究结果显示mIL-21重组腺病毒能在体内成功表达mIL-21,且可降低血清HBsAg水平并促进HBcAb产生,表明此重组腺病毒能在慢性HBV小鼠模型中发挥控制病毒的作用,有望成为慢性HBV感染免疫治疗的手段,其在体内发挥作用的具体机制有待后续进一步研究。
| [1] | Monteleone G, Pallone F, Macdonald TT. Interleukin-21 (IL-21)-mediated pathways in T cell-mediated disease[J]. Cytokine Growth Factor Rev, 2009, 20(2): 185-91. DOI: 10.1016/j.cytogfr.2009.02.002. |
| [2] | Muneta Y, Kikuma R, Uenishi H, et al. Molecular cloning, chromosomal location, and biological activity of porcine interleukin-21[J]. J Vet Med Sci, 2004, 66(3): 269-75. DOI: 10.1292/jvms.66.269. |
| [3] | Coquet JM, Kyparissoudis K, Pellicci DG, et al. IL-21 is produced by NKT cells and modulates NKT cell activation and cytokine production[J]. J Immunol, 2007, 178(5): 2827-34. DOI: 10.4049/jimmunol.178.5.2827. |
| [4] | Fröhlich A, Kisielow J, Schmitz I, et al. IL-21R on T cells is critical for sustained functionality and control of chronic viral infection[J]. Science, 2009, 324(5934): 1576-80. DOI: 10.1126/science.1172815. |
| [5] | Yi JS, Du M, Zajac AJ. A vital role for interleukin-21 in the control of a chronic viral infection[J]. Science, 2009, 324(5934): 1572-6. DOI: 10.1126/science.1175194. |
| [6] | Elsaesser H, Sauer K, Brooks DG. IL-21 is required to control chronic viral infection[J]. Science, 2009, 324(5934): 1569-72. DOI: 10.1126/science.1174182. |
| [7] | Chevalier MF, Jülg B, Pyo A, et al. HIV-1-specific interleukin-21+ CD4+ T cell responses contribute to durable viral control through the modulation of HIV-specific CD8+ T cell function[J]. J Virol, 2011, 85(2): 733-41. DOI: 10.1128/JVI.02030-10. |
| [8] | Ma SW, Huang X, Li YY, et al. High serum IL-21 levels after 12 weeks of antiviral therapy predict HBeAg seroconversion in chronic hepatitis B[J]. J Hepatol, 2012, 56(4): 775-81. DOI: 10.1016/j.jhep.2011.10.020. |
| [9] | 王绢华, 顾锡炳, 朱银芳, 等. 慢性乙型肝炎患者血清HBV DNA水平无滤泡辅助性T淋巴细胞的关系和意义[J]. 中华实验和临床病毒学杂志, 2013, 27(5): 351-3. |
| [10] | Li L, Liu M, Cheng LW, et al. HBcAg-specific IL-21-producing CD4+ T cells are associated with relative viral control in patients with chronic hepatitis B[J]. Scand J Immunol, 2013, 78(5): 439-46. DOI: 10.1111/sji.2013.78.issue-5. |
| [11] | Ren G, Esser S, Jochum C, et al. Interleukin 21 augments the hepatitis B virus-specific CD8+ T-cell response in vitro in patients coinfected with HIV-1[J]. AIDS, 2012, 26(17): 2145-53. DOI: 10.1097/QAD.0b013e328359b7ae. |
| [12] | Jie L, Ren WH, Wei M, et al. Inerleukin-21 response in patients with chronic hepatitis B[J]. J Interferon Cykine Res, 2015, 35(2): 134-42. DOI: 10.1089/jir.2013.0119. |
| [13] | 成利伟, 孔歌, 李莉, 等. 慢性乙型肝炎患者PB MC中H BV特异性IL-21表达及其对CD8+T淋巴细胞功能的影响[J]. 肝脏, 2014, 19(4): 246-9, 253. |
| [14] | 董小岩, 尉迟捷, 王刚, 等. 高嗜肝性8型重组腺相关病毒体内转导法制备乙型肝炎病毒持续感染小鼠模型[J]. 病毒学报, 2010(6): 425-31. |
| [15] | 王刚, 董小岩, 田文洪, 等. 用rAAV8-1.3HBV制备两种品系乙型肝炎病毒感染模型的比较研究[J]. 病毒学报, 2012(5): 541-7. |
| [16] | Pallikkuth S, Parmigiani A, Pahwa S. Role of IL-21 and IL-21 receptor on B cells in HIV infection[J]. Crit Rev Immunol, 2012, 32(2): 173-95. |
| [17] | Micci L, Ryan ES, Fromentin R, et al. Interleukin-21 combined with ART reduces inflammation and viral reservoir in SIV-infected macaques[J]. J Clin Invest, 2015, 125(12): 4497-513. DOI: 10.1172/JCI81400. |
| [18] | Feng G, Zhang JY, Zeng QL, et al. HCV-specific interleukin-21+ CD4+ T cells responses associated with viral control through the modulation of HCV-specific CD8+ T cells function in chronic hepatitis C patients[J]. Mol Cells, 2013, 36(4): 362-7. DOI: 10.1007/s10059-013-0181-z. |
| [19] | 潘庆春, 余永胜, 汤正好, 等. IL-21在急性乙型肝炎中的表达与临床意义[J]. 胃肠病学和肝病学杂志, 2013, 22(4): 367-70. |
| [20] | 王驭风, 钱卫, 夏澍. HBV不同感染状态者血清IL-21、IFN-γ水平变化及其临床意义[J]. 山东医药, 2017, 57(4): 71-3. |
| [21] | Vyas AK, Sharma BC, Sarin SK, et al. Immune correlates of hepatitis B surface antigen spontaneous seroconversion in hepatitis B e antigen negative chronic hepatitis B patients[J]. Liver Int, 2017, 25(4): 13475. |
| [22] | Publicover J, Goodsell A, Nishimura S, et al. IL-21 is pivotal in determining age-dependent effectiveness of immune responses in a mouse model of human hepatitis B[J]. J Clin Invest, 2011, 121(3): 1154-62. DOI: 10.1172/JCI44198. |
| [23] | Li HJ, Kang FB, Li BS, et al. Interleukin-21 inhibits HBV replication in vitro[J]. Antivir Ther, 2015, 20(6): 583-90. DOI: 10.3851/IMP2950. |
| [24] | Mcneish IA, Bell SJ, Lemoine NR. Gene therapy progress and prospects: Cancer gene therapy using tumour suppressor genes[J]. Gene Ther, 2004, 11(6): 497-503. DOI: 10.1038/sj.gt.3302238. |
| [25] | Tomko R P XR, MCAR. The human and mouse cellular receptors for subgroup C adenoviruses and group B coxsackieviruses[J]. Proc Natl Acad Sci USA, 1997, 94(7): 3352-6. DOI: 10.1073/pnas.94.7.3352. |
| [26] | 王鸣, 郭建文, 习东, 等. 腺病毒载体在小鼠肝脏的分布及其表达规律的研究[J]. 实用肝脏病杂志, 2012(3): 216-9. |
| [27] | Gao GP, Yang Y, Wilson JM. Biology of adenovirus vectors with E1 and E4 deletions for liver-directed gene therapy[J]. J Virol, 1996, 70(12): 8934-43. |
| [28] | Allweiss L, Dandri M. Experimental in vitro and in vivo models for the study of human hepatitis B virus infection[J]. J Hepatol, 2016, 64(1 Suppl): S17-31. |
 2017, Vol. 37
2017, Vol. 37

