2. 新疆医科大学公共卫生学院儿少卫生与妇幼保健学教研室, 新疆 乌鲁木齐 830000;
3. 解放军总医院第一附属医院 病理科, 北京 100047
2. Department of Maternal, Child and Adolescent Health, School of Public Health, Xinjiang Medical University, Urumqi 830000, China;
3. Department of Pathology, First Affiliated Hospital of General Hospital of PLA, Beijing 100047, China
乳腺癌是全世界范围内严重危害女性身心健康的恶性肿瘤之一,浸润性乳腺癌是乳腺癌的主要类型[1]。免疫组化结果根据ER、PR、HER2表达结果及Ki-67值不同,将其定义为5型[2-3]:Luminal A型、Luminal B HER2(-)型、Luminal B HER2(+)型、HER2过表达型和三阴型。临床证据已证实不同亚型的乳腺癌对化疗反应各异[4],生物学预后因子也影响乳腺癌预后及对治疗方案的选择。近年来MRI功能成像逐渐成为研究热点,扩散加权成像(DWI)中,表观扩散系数(ADC)值能够直观地反映水分子运动,从分子水平反映人体病理生理状态下组织结构的空间组成信息的改变。我们推测ADC值与肿瘤的预后因素间也可能存在相关性。目前国内外对于浸润性乳腺癌预后因子及5种分子亚型与ADC值关系的研究较少,DWI图像分辨率较低,小肿瘤及非肿块样肿瘤由于体积小,或肿瘤不均质性,常混杂脂肪和腺体组织,影响准确测量ADC值,因此研究结果存在差异。本研究旨在探讨肿块样表现的浸润性乳腺癌平均ADC值与5种分子亚型及其生物学预后因子的相关性,尽可能排除容积效应和肿瘤异质性的干扰,以期鉴别不同分子亚型的浸润性乳腺癌并评估预后。
1 资料和方法 1.1 研究对象收集2015年5月~2016年12月解放军总医院第一附属医院收治的64例经病理证实的女性浸润性乳腺癌患者,年龄25~75(50.14±10.01)岁(,均有完整的病理及术前MRI资料。64例患者共69个病灶,其中5例患者为双乳单灶。纳入标准:① 所有患者行影像学检查前未进行任何干预;② 患者于月经后7~10 d进行检查;③ 经磁共振检查明确为肿块样病变;④ HER2(++)或(++ ~+++)行免疫荧光原位杂交(FISH)检测。排除标准:① 不能耐受或配合MRI检查;② 肿瘤较小,ADC值难以测量;③ 病灶呈灶性强化或非肿块样分布;④ MR检查前行活检、新辅助化疗或内分泌治疗。
1.2 仪器与方法采用Siemens Skyra 3.0T超导MRI扫描仪,4通道乳腺专用表面线圈。患者取俯卧位,双乳自然悬垂。常规扫描采用FSE T1WI,扫描参数:TR 6 ms,TE 2.46 ms,层厚1.2 mm,间隔0 mm;FSE T2WI脂肪抑制,扫描参数:TR 4000 ms,TE 54 ms,层厚4.0 mm,间隔1.0 mm;DWI扫描参数:TR 8400 ms,TE 73.2 ms,b值取800 s/mm2,层厚4.0 mm,间隔20%;动态增强扫描采用T1 flash3d序列,扫描参数:TR8.65 ms,TE4.4 ms,层厚0.8 mm,间隔0.16 mm扫描,矩阵340×340。分8个时相采集图像,每个时相扫描58 s,从第2个时相扫描开始注入对比剂,对比剂为钆喷酸葡胺注射液,剂量0.4 mmol/kg,注射速度2 mL/s,随后注射生理盐水20 mL。
1.3 图像分析数据处理在西门子Syano multimodality workplace进行。由两位有5年以上乳腺诊断经验的主治医师进行测量。利用mean curve软件在增强的T1WI图上选定强化明显区域(ROI),描绘时间-信号强度曲线。选取DWI图像b=800 s/mm2时ADC图,对照增强的T1WI,在ADC图上以病灶最大层面,画感兴趣区(ROI),ROI大于3个像素,面积理论上不小于2 mm2,尽可能包含完整病灶并避开坏死出血区。每个ROI重复测量3次,取平均ADC值。
1.4 病理分析与免疫组化检查所有病理标本均行HE染色,ER、PR、HER2、Ki-67采用免疫组化SP染色获得。依据肿瘤细胞胞核染色阳性细胞数来判读结果。阳性细胞≥10%为ER、PR阳性,反之为阴性;HER2结果判定以3+为阳性,0/1+为阴性,2+或2~3+时经荧光原位杂交检测,基因拷贝数扩增亦定义为阳性,否则为阴性[5]。Ki-67结果判定以阳性细胞≥14%为阳性,反之为阴性;乳腺癌分子分型定义为如下5型:Luminal A型(ER阳性和/或PR阳性,HER2阴性并且Ki-67 < 14%)、Luminal B HER2(-)型(ER阳性和/或PR阳性,HER2阴性并且Ki-67≥14%)、Luminal B HER2(+)型(ER阳性和/或PR阳性,HER2阳性)、HER2过表达型(ER阴性/PR阴性/HER2阳性)、三阴型(ER阴性/PR阴性/HER2阴性)[2]。
1.5 统计学方法采用SPSS 19.0软件,生物学预后因子ER、PR、HER2、Ki-67间ADC值比较采用独立样本t检验,不同分子亚型间ADC值比较采用方差分析,ADC值与生物学预后因子及不同分子亚型的相关性采用Spearman相关分析。P < 0.05表示差异有统计学意义。
2 结果64例浸润性乳腺癌患者,肿块样强化病灶69个;其中浸润性导管癌59个,浸润性癌3个,浸润性小叶癌5个,不典型髓样癌2个,ADC值为(0.584~1.940)×10-3 mm2/s,平均0.994×10-3 mm2/s;49个癌灶ER阳性(71%),20个癌灶ER阴性(29%);36个癌灶PR阳性(52%),33个癌灶PR阴性(48%);27个癌灶HER2阳性(39%),42个癌灶HER-2阴性(61%);56个癌灶Ki-67指数≥14%(81%),13个癌灶Ki-67指数 < 14%(19%)(图 1)。ER、PR、HER2阳性、阴性者ADC值差异均无统计学意义(t=0.725、P=0.447,t=0.715、P=0.477,t=1.087、P=0.281),HER2阳性者ADC值高于阴性者;Ki-67阳性、阴性者ADC值差异有统计学意义(t=2.324、P=0.023),阴性者ADC值明显高于阳性,两者之间呈负相关(r=-0.249,P= 0.039)。乳腺癌5种分子亚型间ADC值差异无统计学意义(F=1.505,P=0.211,表 1、2)。
|
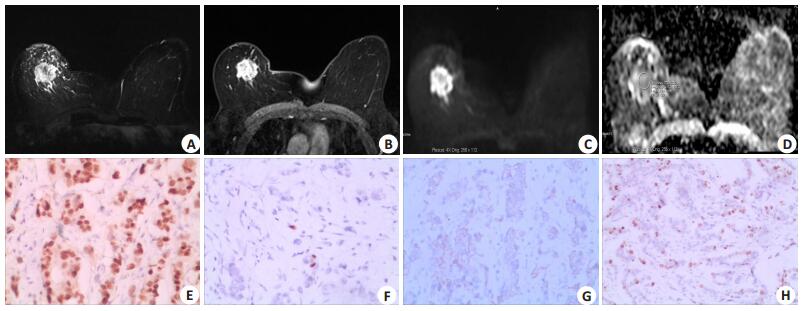
图 1 56岁女患者右乳肿块型浸润性导管癌Ⅲ级(HER2过表达型)MRI和免疫组化结果 Figure 1 MRI and immunohistochemical data of invasive ductal carcinoma (histological grade Ⅲ) in the right breast of a 56-year-old female patient. A: Axial T2WI showing a high-intensity mass in the outer upper quadrant with ill defined margins and speculate boundary; B: The second phase of axial dynamic enhancement showing obvious enhancement in the mass; C: DWI (b value, 800 s/ mm2) showing a high-intensity mass. D: Axial ADC map showing a low signal intensity in the same lesion. The ADC value within the tumor ROI was 0.928×10-3 mm2/s. E, F, G, H: Immunohistochemical staining (EnVision, ×100) showing ER and PR negativity and HER2 (3+) and Ki-67 (+60%) positivity. |
| 表 1 69个乳腺癌病灶预后因子表达及各分子亚型与ADC值的关系 Table 1 Relation between ADC values and prognostic factors and molecular subtypes in 69 breast cancer lesions (n=69) |
| 表 2 69个乳腺癌病灶ER、PR、HER2、Ki-67表达与ADC值相关性 Table 2 Correlation of ADC values with ER, PR, HER2 and Ki-67 in 69 breast cancer lesions (n=69) |
目前,对于乳腺癌的病因、发生、发展机制及规律的探索已经深入到基因和分子水平。近年来已有不少研究分析肿块的形态、边缘、强化方式与肿瘤预后因子之间的关系,但结果并不统一。目前比较公认的是边缘较光滑的单灶肿块并伴有环形强化,对三阴性乳腺癌的诊断有重要意义[6]。肿瘤边缘毛刺征普遍认为是乳腺癌一个较为特异性的恶性征象,但它与癌肿恶性程度的关系仍然存在争议。有研究[7-8]表明毛刺的出现预示肿瘤具有更低的侵袭性行为,毛刺与生物因子之间没有相关性。这些研究结果的差异说明肿瘤的形态学特征与预后因子间没有稳定的相关性。随着MRI在临床中的应用越来越广泛,乳腺癌的研究已逐渐从传统的形态学研究转向功能与形态学相结合的方向发展。分析肿瘤的组织病理学改变与影像学表现之间的关系,从分子和细胞水平检测疾病特征,可以更准确辅助临床进行治疗,并判断其预后。
DWI是一种反映活体水分子微观运动的功能成像方法,其ADC值是一个定量指标,与水分子的弥散与微循环灌注相关,水分子扩散快,信号衰减快,DWI呈低信号,则ADC值高;反之,ADC值越低。ADC值与肿瘤细胞密度呈负相关。恶性肿瘤细胞增值快,细胞密度较高,ADC值较低。影响ADC值的因素主要包括细胞数量、液体的黏滞度、细胞内外水肿、运动或流动的方向性[9-10]和一些成像参数,如磁敏感性、空间分辨率和信噪比[11]。肿瘤的生物学预后指标与细胞构成及灌注相关,因此,ADC值的高低可能会反映乳腺癌的预后并辅助临床进行治疗。
目前公认的乳腺癌患者的常规免疫组化检查指标主要包括雌激素受体(ER)和孕激素受体(PR)、HER2、Ki-67,它们在乳腺癌的发生、发展及恶性转化中起着重要作用。Ki-67是增殖细胞相关核抗原,不出现在静止期的细胞中,阳性结果说明肿瘤增值活跃,与乳腺癌的预后关系密切。通常使用14%作为界值定义高或者低增殖指数[12]。Ki-67表达越高,乳腺癌复发率越高,淋巴结转移越严重,远处转移机会越大,生存期越短[13-14]。如肿瘤中有超过50%的细胞Ki-67过表达,则其复发危险性会明显增大[15]。本研究结果显示69个肿块型病灶中Ki-67指标阳性、阴性者ADC值差异有统计学意义,阳性者ADC值明显低于阴性患者,两者之间呈负相关。这表明Ki-67指数增加的情况下,癌细胞增殖旺盛,细胞密度增高,限制了水分子的扩散,ADC值降低,与既往文献报道相符[11, 13, 16]。Molinari1等[17]将≥20%作为Ki-67阳性的界值,通过对115例乳腺癌研究发现,Ki-67阳性者ADC值与阴性者有显著差异(P < 0.0001),并呈明显负相关,以0.95×10-3 mm2/s作为鉴别Ki-67阴阳性的阈值,敏感性为83%,特异性为66.1%,这说明ADC值可以在预测Ki-67的表达方面发挥作用。
ER、PR在乳腺癌中的表达情况与肿瘤患者预后明显相关, 并且用以指导内分泌治疗[18]。ER/PR阳性的患者复发率低, 生存期长,内分泌治疗敏感。Kamitani等[19]报道由于ER、PR抑制肿瘤血管生成途径,导致肿瘤微血管灌注效应减低,因此ADC值降低。刘春玲等[14]将ER、PR的表达标准按照≥1%癌细胞核染色为阳性,以着色强度分为+,++,+++三个等级,对82例浸润性导管癌的研究发现,ER不同阳性强度组间ADC值存在差异,ADC值与ER阳性表达百分比间存在负相关性。本研究未显示同样的结果,ER、PR阳性、阴性者ADC值差异无统计学意义。笔者分析,由于本研究按目前临床所采用的标准将ER、PR的表达按≥10%癌细胞核染色分为阳性和阴性两组,不同的分组标准,可能会导致结果差异;另外,笔者认为肿瘤细胞增殖是多种因素共同作用的结果,对于每一个肿瘤来说,这些因素各自的独立作用难以评价,而病变的ADC值是对病变总体的反映,其影响因素较多,也可能是导致该结果的原因。
HER2又称C-erbB-2基因,是细胞生长、分化和存活的重要调节因子,其高表达提示细胞增殖旺盛,侵袭力强,是判断乳腺癌预后的指标之一。文献报道HER-2高表达与瘤组织分级、淋巴结转移、分期呈正相关, 与ER、PR表达呈负相关,表达越高, 预后越差,复发率升高[20]。恶性肿瘤的ADC值比良性肿瘤更易受到灌注的影响[21],并且与肿瘤坏死和高血管密度相关,因此肿瘤内高的血管分布可能导致ADC值增高[22]。Bogner等[23]认为HER2的过表达促进了血管内皮因子(VEGF)诱导血管生成,而新生血管粗大,管壁脆弱,导致细胞外液增加,ADC值增高。本研究中HER2阳性、阴性者ADC值差异无统计学意义,与Kim [24]及Park [11]等多数文献报道一致。HER2表达受多种因素影响,包括肿瘤血管的高灌注、肿瘤血管壁不稳定及血管源性水肿等利于水分子弥散的因素及其他限制水分弥散如细胞密度增大等多种反作用因素。恶性肿瘤细胞密度增高,水分子弥散受限,ADC值降低,而肿瘤内新生血管的异常增殖,可导致细胞外液增加,ADC值增高,这些作用与反作用因素,都有可能使ADC值不能有效地反映HER2表达[25]。
不同亚型的乳腺癌对化疗的反应各异。Luminal A/B型对激素治疗反应良好,尤其HER-2阳性患者中,对他莫昔芬的疗效明显差于luminal A型患者;HER2过表达型对靶向治疗药物反应良好;三阴性乳腺癌所占比例最低,内分泌治疗无效。Luminal A型是最常见的类型,但本组研究中,Luminal B型患者较Luminal A型多见。ADC值与乳腺癌分子亚型之间的相关性国内外文献报道较少。Kim等[16]对175例乳腺癌研究认为各分子亚型间ADC值有明显差异。Molinari C等[17]研究118乳腺癌发现,Luminal B-HER2(+)组平均ADC值最低,Luminal A组平均ADC值最高,但仅Luminal A与Luminal B-HER2(-)组ADC值的差异有统计学意义。本研究显示乳腺癌各分子亚型ADC值差异无统计学意义,与Park及谢宗玉报道一致[11, 26]。笔者分析可能与本研究样本量较小有关。另外本研究的病例中包含了除浸润性导管癌外其他种类浸润性乳腺癌,由于乳腺癌的不均质性,多种标记物在同一肿瘤中不同程度的表达, 从而导致ADC值无明显规律性;与前述部分文献不同,本组研究为避免容积效应等因素影响,更加准确测量ADC值,排除了非肿块型癌灶,仅选取肿块型癌灶入组。
本研究结果显示,DWI及ADC值能反映浸润性乳腺癌癌灶内部的特点,并与部分预后因子(Ki-67)存在一定相关性,Ki-67指数越低,ADC值越高,能为患者制定治疗方案提供一定的帮助,但ADC值并不能对乳腺癌分子亚型进行预测。在下一步的研究中会增加样本量,并进一步研究乳腺癌组织学分级及淋巴结转移情况与ADC值的关系。
| [1] | 汪登斌. 乳腺MRI应用现状和我国乳腺MRI应用中存在的问题[J]. 中华放射学杂志, 2014, 48(3): 177-9. |
| [2] | Siegel RL, Miller KD, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2015, 65(1): 5-29. DOI: 10.3322/caac.21254. |
| [3] | Goldhirsch A, Wood WC, Coates AS, et al. Strategies for subtypesdealing with the diversity of breast cancer:highlights of the St. Gallen International Expert Consensus on the Primary Therapyof Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-47. DOI: 10.1093/annonc/mdr304. |
| [4] | Carey LA, Dees EC, Sawyer L, et al. The triple negative paradox; primary tumor chemosensitivity of breast cancer subtypes[J]. Clin Cancer Res, 2007, 13(8): 2329-34. DOI: 10.1158/1078-0432.CCR-06-1109. |
| [5] | 《乳腺癌HER2检测指南》编写组, 霍临明. 乳腺癌HER2检测指南[J]. 中华病理学杂志, 2006, 35(10): 631-33. DOI: 10.3760/j.issn:0529-5807.2006.10.015. |
| [6] | Uemasu T, Kasami M, Yuen S. Triple-negative breast cancer:correlation between MR imaging and pathologic findings[J]. Radiology, 2009, 250(3): 638-47. DOI: 10.1148/radiol.2503081054. |
| [7] | Szabo BK, Aspelin P, Kristoffersen Wiberg M, et al. Invasive breast cancer:correlation of dynamic MR features with prognostic factors[J]. Eur Radiol, 2003, 13: 2425-35. DOI: 10.1007/s00330-003-2000-y. |
| [8] | 陈倩, 沈玉英, 蔡庆, 等. 乳腺癌MRI表现与CerbB-2、Ki-67表达的相关性研究[J]. 临床反射学杂志, 2016, 35(10): 1486-9. |
| [9] | Marini C, Iacconi C, Giannelli M, et al. Quantitative diffusionweighted MR imaging in the differential diagnosis of breast lesion[J]. Euro Radiol, 2007, 17(10): 2646-55. DOI: 10.1007/s00330-007-0621-2. |
| [10] | Partridge SC, Mullins CD, Kurland BF, et al. Apparent diffusion coefficient values for discriminating benign and malignant breast MRI lesions:effects of lesion type and size[J]. Am J Roentgenol, 2010, 194(6): 1664-73. DOI: 10.2214/AJR.09.3534. |
| [11] | Park EK, Cho KR, Bo Seo K, et al. Prognostic factors of breast cancer:correlation with the apparent diffusion coefficient[J]. Iran J Radiol, 2016, 13(1): e33133. |
| [12] | Ding SL, Sheu LF, Yu JC, et al. Expression of estrogen receptor-alpha and ki67 in relation to pathological and molecular features in early-onset infiltrating ductal carcinoma[J]. J Biomed Sci, 2004, 11(6): 911-9. |
| [13] | Mori N, Ota H, Mugikura S, et al. Lumina-type breast cancer:correlation of apparent diffusion coefficients with the Ki-67 labeling index[J]. Radiology, 2015, 274(1): 66-73. DOI: 10.1148/radiol.14140283. |
| [14] | 刘春玲, 何晖, 刘再毅, 等. ADC值与乳腺浸润性导管癌预后标记物间相关性的探讨[J]. 临床放射学杂志, 2014, 33(2): 194-8. |
| [15] | Yerushalmi R, Woods R, Ravdin PM, et al. Ki67 in breast cancer:prognostic and predictive potentia[J]. Lancet Oncol, 2010, 11(2): 174-183. DOI: 10.1016/S1470-2045(09)70262-1. |
| [16] | Kim EJ, Kim SH, Park GE, et al. Histogram analysis of apparent diffusion coefficient at 3.0 T:Correlation with prognostic factors and subtypes of invasive ductal carcinoma[J]. J Magn Reson imaging, 2015, 42(6): 1666-78. DOI: 10.1002/jmri.24934. |
| [17] | Molinari C, Clauser P, Girometti R, et al. MR mammography using diffusion-weighted imaging in evaluating breast cancer:a correlation with proliferation index[J]. Radiol Med, 2015, 120(10): 911-8. DOI: 10.1007/s11547-015-0527-z. |
| [18] | Bauer KR, Brown M, Cress RD, et al. Descriptive analysis of estrogenreceptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype:a population-based study from the California cancer Registry[J]. Cancer, 2007, 109(9): 1721-8. DOI: 10.1002/(ISSN)1097-0142. |
| [19] | Kamitani T, Matsuo Y, Yabuuchi H, et al. Correlations between apparent diffusion coefficient values and prognostic factors of breast cancer[J]. Magn Reson Med Sci, 2013, 12(3): 193-9. DOI: 10.2463/mrms.2012-0095. |
| [20] | Choi SY, Chang YW, Park HJ, et al. Correlation of the apparent diffusion coefficiency values on diffusion-weighted imaging with prognostic factors for breast cancer[J]. Br J Radiol, 2012, 85(1016): e474-9. DOI: 10.1259/bjr/79381464. |
| [21] | Woodhams R, Matsunaga K, Iwabuchi K, et al. Diffusion-weighted imaging of malignant breast tumors-the usefulness of apparent diffusion coefficient(ADC)value and ADC map for the detection of malignant breast tumors and evaluation of cancer extension[J]. J Comput Assist Tomogr, 2005, 29(5): 644-649. DOI: 10.1097/01.rct.0000171913.74086.1b. |
| [22] | Leek RD, Landers RJ, Harris AL, et al. Necrosis correlates with high vascular density and focal macrophage infiltration in invasive carcinoma of the breast[J]. Br J Cancer, 1999, 79(5-6): 991-5. DOI: 10.1038/sj.bjc.6690158. |
| [23] | Bogner W, Gruber S, Pinker K, et al. Diffusion-weighted MR for differentiation of breast lesions at 3.0 T:how does selection of diffusion protocols affect diagnosis?[J]. Radiology, 2009, 253(2): 341-51. DOI: 10.1148/radiol.2532081718. |
| [24] | Kim SH, Cha ES, Kim HS, et al. Diffusion-weighted imaging of breast cancer:correlation of the apparent diffusion coefficient value with prognostic factors[J]. J Magn Reson Imaging, 2009, 30(3): 615-20. DOI: 10.1002/jmri.v30:3. |
| [25] | 陈雅青, 陈建军, 王兆宇. ADC值与肿块样强化乳腺非特殊型浸润性癌预后因子相关性研究[J]. 影像诊断与介入放射学, 2016, 25(4): 287-92. |
| [26] | 谢宗玉, 马宜传, 姚明, 等. 扩散加权成像表观扩散系数值与乳腺浸润性导管癌分子亚型的关系[J]. 中国医学影像学杂志, 2016, 24(4): 277-80. |
 2017, Vol. 37
2017, Vol. 37

