肌肉减少症于1988年由Rosenberg首次提出,是一种以骨骼肌质量减少、肌肉力量及耐力显著下降为主要特征的衰老性机能减退[1-2]。流行病学资料显示,65岁以上的老年人群中,肌肉减少症的发病率高达15%,在超过80岁的高龄老年人群中,肌肉减少症的发病率高达50% [3]。肌肉减少症严重影响老年人的机体功能和日常生活,增加老年人发生跌倒、骨折、失能和住院的风险[4],增加了社会经济负担,提高了老年人的死亡率。然而,肌肉减少症是可防可治的,主要的方法是通过运动和营养的干预。近年来,肌肉减少症已逐渐成为老年医学领域研究的热点之一。肌肉减少症的发生涉及细胞凋亡[5]、蛋白合成减少[6]、激素分泌不足[7]、运动神经元失能[8]等多种因素,其具体发生机制目前尚不清楚。
白藜芦醇是一种生物性很强的非黄酮类多酚化合物,主要来源于花生、葡萄、虎杖、桑椹等植物。白藜芦醇具有多种药理作用,既往研究表明,白藜芦醇是一种纯天然的抗氧化剂,可以上调内源性抗氧化因子,降低骨骼肌细胞内的氧化剂负载,从而减弱与肌肉负重和衰老相关的氧化损伤[9-10]。研究发现,白藜芦醇具有抑制骨骼肌纤维蛋白降解以及改善骨骼肌萎缩的作用[11-14],白藜芦醇对改善肌肉废用性萎缩具有一定的保护作用[15]。但是白藜芦醇对老年大鼠骨骼肌的影响尚未见报道,本实验旨在探讨白藜芦醇对老年大鼠肌肉力量和结构的影响及其可能的分子机制。
1 材料和方法 1.1 实验试剂及仪器白藜芦醇(天津尖峰公司),兔抗大鼠AMPK单克隆抗体(CST公司),兔抗大鼠p-AMPK单克隆抗体(CST公司),兔抗大鼠sirt1单克隆抗体(Santa公司),兔抗大鼠GAPDH单克隆抗体(中杉金桥),电子抓力仪(cat.47200, Ugo Basil),透射电子显微镜(Hitachi-7500)。
1.2 实验动物和分组30只SPF级SD雄性大鼠购于重庆医科大学实验动物中心,其中25月龄大鼠20只,体质量500~700 g;6月龄大鼠10只,体质量300~400 g。将25月龄大鼠随机分成老年对照组(OC组,n=10)和老年白藜芦醇组(OR组,n=10),另外10只6月龄的大鼠作为青年对照组(YC组)。实验过程中大鼠分笼饲养,每笼5只,自由饮食、饮水。饲养环境12 h明/暗周期,恒温20±2 ℃,相对湿度(55±5)%。
1.3 给药方法白藜芦醇(纯度99%)的给药剂量为150 mg/(kg·d),饲料给药,将OR组大鼠单笼饲养,根据每只大鼠的体质量和进食量,将白藜芦醇混入饲料中,制成相应浓度的饲料,并加入适量奶粉,确保每只大鼠吃掉,连续给予6周。
1.4 大鼠前肢抓力的测量将大鼠前肢平放在电子抓力仪的感应杆上,当大鼠牢牢抓住感应杆后,平行拖拽大鼠的尾巴,直到松开为止,抓力仪会自动记录大鼠的最大抓力。重复测量3次,取最大值为大鼠的抓力,每周测量1次。
1.5 透射电子显微镜动物处死后,迅速取下新鲜的完整腓肠肌组织放入戊二醛固定液中,4 ℃保存1 h以上,随机在表面取下3块1 mm3的组织,放在固定液中用冰盒运到重庆医科大学生命科学院,由技术人员进行脱水、包埋、固化和超薄切片。每张切片由技术人员帮助使用透射电子显微镜随机拍10张图像,总共30张图像,技术人员采用盲法。放大倍数为15 000倍。
1.6 Western blotting提取各组肌肉组织总蛋白,BCA法测定蛋白浓度。等量上样至SDS-PAGE凝胶中,电泳电压设置为80V出孔后转120 V,100 min。蛋白经湿转法转至PVDF膜上,TBST漂洗膜3次,5%胎牛血清(BSA)室温封闭1 h,将膜置于溶有AMPK、P-AMPK、sirt1或GAPDH的一抗稀释液中4 ℃过夜。次日用TBST漂洗膜3次,将膜放入已稀释的二抗中室温1 h,TBST漂洗膜3次。ECL显影,调节Bio-1D软件(VilberLourmat, 法国)凝胶成像仪的参数进行曝光,采图。Image J软件分析,测定并计算出AMPK、P-AMPK、sirt1与GAPDH条带吸光度值比值,进行统计学分析。
1.7 统计分析实验数据由Excel 2007,SPSS 21统计软件处理,先用Excel 2007对数据进行简单处理,然后用SPSS 21进行统计学分析,用Excel 2007作图。结果均采用Mean±SD表示,并用单因素方差分析(one-way ANOVA)比较不同组间结果的显著性差异,用重复测量方差分析比较6周以来抓力的变化。P < 0.05为差异有统计学意义。
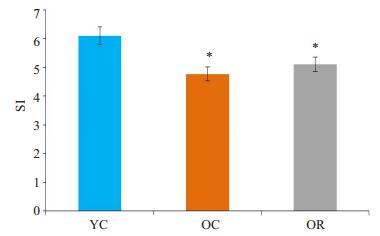
2 结果 2.1 白藜芦醇对大鼠腓肠肌质量的影响本实验采用SI(Sarcopenia Index)值判断大鼠肌肉减少症模型是否成功。SI值定义为靶骨骼肌的质量(mg)/受试体质量(g)求得的值,并以此作为评价指标[16],参照Baumgartner等[17]的方法(老年组SI值与青年组相比显著降低,且差异大于2倍SD)进行判定。OC组SI值(4.77±0.39)较YC组SI值(6.10±0.59)显著下降(P < 05),且下降幅度大于2倍SD,说明老年组大鼠肌肉减少症模型成功;OR组SI值(5.10±0.26)较OC组差异无统计学意义(P > 0.05,图 1)。
|
图 1 白藜芦醇对大鼠SI值的影响 Figure 1 Effect of resveratrol on SI value in rats. SI: Sarcopenia Inedx; YC: Young control group; OC: Old control group; OR: Old-resveratrol-treated group. *P < 0.05 vs YC. |
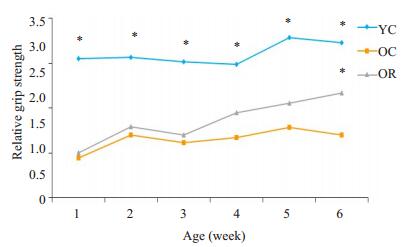
由于青年鼠与老年鼠体质量差异较大,本实验采用相对抓力,即抓力/体质量,通过体质量来校正结果。YC组的抓力明显大于OC组(P < 0.05)。在前5周,OR组与OC组相比,抓力未见明显差异(P > 0.05),从第4周开始,OR组抓力出现上升的趋势,在第6周时,OR组的抓力显著大于OC组(P < 0.05,图 2)。
|
图 2 白藜芦醇对大鼠前肢抓力的影响 Figure 2 Effect of resveratrol on forelimb grip strength in rats. *P < 0.05 vs OC. |
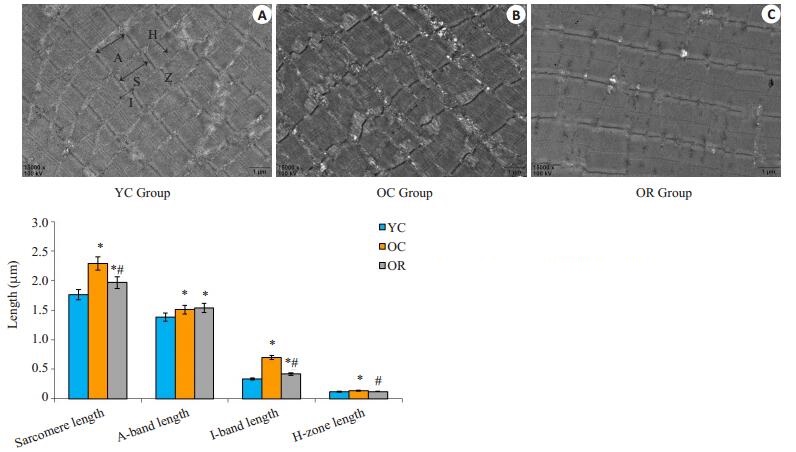
OC组的肌小节显著长于YC组(P < 0.05),OR组的肌小节显著短于OC组(P < 0.05),但是OR组的肌小节仍旧显著高于YC组(P < 0.05)。OR组与OC组之间暗带长度无显著性差异(P > 0.05),均显著长于YC组(P < 0.05)。OC组的明带长度显著长于YC组(P < 0.05),OR组的明带长度显著短于OC组(P < 0.05),但是OR组的明带长度仍旧显著高于YC组(P < 0.05)。OC组的H带长度显著长于YC组(P < 0.05),OR组的H带长度显著短于OC组(P < 0.05),OR组于YC组之间差异无统计学意义(P > 0.05,图 3)。
|
图 3 白藜芦醇对大鼠骨骼肌肌原纤维的影响 Figure 3 Effect of resveratrol on myofibril in skeletal muscle in rats. Representative TEM pictures of microstructure of gastrocnemius myofibersfromYC (Original magnification: × 15 000) (A), OC (B) and OR (C). Z, Z-line; S, sarcomeres; A, A-band; I, I-band; H, H-zone. *P < 0.05 vs YC, #P < 0.05 vs OC. |
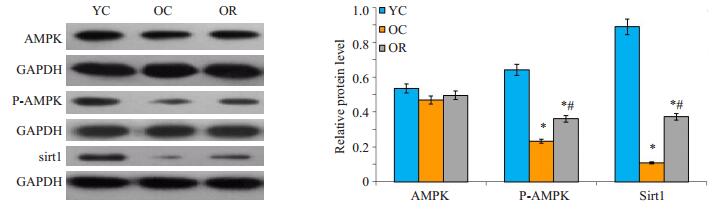
各组间AMPK的表达量无显著性差异(P > 0.05),P-AMPK的表达OC组显著低于YC组(P < 0.05),OR组显著高于OC组(P < 0.05),sirt1的表达OC组显著低于YC组(P < 0.05),OR组显著高于OC组(P < 0.05,图 4)。说明白藜芦醇显著增加了肌肉中p-AMPK,sirt1的表达量。
|
图 4 白藜芦醇对大鼠AMPK、P-AMPK、sirt1蛋白表达的影响 Figure 4 Effect of resveratrol treatment on AMPK、P-AMPK and sirt1protein expression in rats. *P < 0.05 vs YC, #P < 0.05 vs OC. |
白藜芦醇具有抗氧化、抗凋亡、心血管保护、神经保护等多种功效[18-19],本实验通过对老年大鼠进行白藜芦醇干预,发现白藜芦醇可以增强老年大鼠的肌肉力量,但不能增加老年老鼠的肌肉质量。
SD大鼠的一般寿命为30~36月,6月龄大鼠相当于人类18~20岁,24月龄大鼠相当于人类65~70岁,故本实验OC组及OR组SD大鼠(25月龄)均已步入老年阶段。临床上肌肉减少症的诊断标准[20]包括两个方面:(1)骨骼肌质量下降,(2)骨骼肌肌力减退。本实验借鉴肌肉减少症的临床诊断标准,采用腓肠肌SI值判定肌肉质量、前肢抓力判定肌力大小,结果发现白藜芦醇未能有效增加(肌肉质量)SI值,但可以改善老年大鼠的抓力,证明白藜芦醇在一定程度上可以改善老年大鼠肌肉减少症。
肌原纤维是骨骼肌细胞的收缩单位,由构成暗带的粗肌丝(肌球蛋白)和构成明带的细肌丝(肌动蛋白)组成,肌原纤维的组成成分直接影响着肌肉的生物学功能。研究发现,当机体衰老时,肌原纤维出现相应的老化改变,表现为肌小节长度增加,暗带不变,明带增加[21],本实验结果再次验证了老年大鼠骨骼肌老化这一超微结构的改变。同时,白藜芦醇治疗后显著缩短了老年大鼠骨骼肌细胞中肌小节、明带、H带长度,从肌原纤维超微结构上证明了白藜芦醇的肌肉保护效应。
沉默信息调控因子1(sirt1)广泛存在于哺乳动物中,是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白脱乙酰酶,是sirtuins家族的成员之一,与细胞增殖、分化、衰老、凋亡和代谢密切相关。Sirt1已经被证实参与抑制炎症[19]、促进长寿[22]、改善线粒体功能和数量[23]、调节抗氧化酶和改善氧化应激[22, 24]等多种生理功能。其中,sirt1通过抑制PPARγ促进白色脂肪细胞中脂肪动员,并且通过下调肌细胞标志基因的表达从而抑制成肌细胞分化,提示sirt1不仅仅是与机体“长寿”密切相关的调控因子,而且在动物脂肪沉积和肌肉发育中也起着关键的调控作用。既往研究表明,白藜芦醇是一种天然的sirt1激动剂[25],本研究结果显示,老年大鼠肌肉组织中sirt1的表达较青年大鼠显著降低,表明随着年龄的增长,sirt1的表达逐渐下降。白藜芦醇干预后,老年大鼠的肌肉中sirt1表达显著升高,同时伴随着老年大鼠肌肉力量的上升和肌原纤维超微结构的改善。因此,我们推测白藜芦醇提高老年大鼠肌肉力量和改善肌原纤维超微结构作用可能与白藜芦醇激活AMPK/sirt1信号通路密切相关,但其具体分子机制还有待进一步研究。
综上所述,白藜芦醇并未能增加肌肉减少症大鼠的骨骼肌质量,但是可以增强肌肉减少症大鼠的抓力,这可能与其激活AMPK/sirt1信号通路和改善老化的肌原纤维超微结构有关。本实验的创新之处在于首次观察了白藜芦醇对大鼠肌原纤维超微结构的改变,并探讨了其可能的分子机制,但是其具体潜在的分子机制有待进一步深入研究。
| [1] | Marzetti E, Leeuwenburgh C. Skeletal muscle apoptosis, sarcopenia and frailty at old age[J]. Exp Gerontol, 2006, 41(12): 1234-8. DOI: 10.1016/j.exger.2006.08.011. |
| [2] | Morley JE, Baumgartner RN, Roubenoff R, et al. Sarcopenia[J]. J Lab Clin Med, 2001, 137(4): 231-43. DOI: 10.1067/mlc.2001.113504. |
| [3] | Cohen S, Nathan JA, Goldberg AL. Muscle wasting in disease:molecular mechanisms and promising therapies[J]. Nat Rev Drug Discov, 2015, 14(1): 58-74. |
| [4] | Cosquéric G, Sebag A, Ducolombier C, et al. Sarcopenia is predictive of nosocomial infection in care of the elderly[J]. Br J Nutr, 2006, 96(5): 895-901. |
| [5] | Marzetti E, Calvani R, Bernabei R, et al. Apoptosis in skeletal myocytes:a potential target for interventions against sarcopenia and physical frailty-a mini-review[J]. Gerontology, 2012, 58(2): 99-106. DOI: 10.1159/000330064. |
| [6] | Gatineau E, Savary-Auzeloux I, Migné C, et al. Chronic intake of sucrose accelerates sarcopenia in older male rats through alterations in insulin sensitivity and muscle protein synthesis[J]. J Nutr, 2015, 145(5): 923-30. DOI: 10.3945/jn.114.205583. |
| [7] | Kovacheva EL, Hikim AP, Shen R, et al. Testosterone supplementation reverses sarcopenia in aging through regulation of myostatin, c-Jun NH2-terminal kinase, Notch, and Akt signaling pathways[J]. Endocrinology, 2010, 151(2): 628-38. DOI: 10.1210/en.2009-1177. |
| [8] | Kung TA, Cederna PS, Van Der Meulen JH, et al. Motor unit changes seen with skeletal muscle sarcopenia in oldest old rats[J]. J Gerontol A Biol Sci Med Sci, 2014, 69(6): 657-65. DOI: 10.1093/gerona/glt135. |
| [9] | Jackson JR, Ryan MJ, Hao Y, et al. Mediation of endogenous antioxidant enzymes and apoptotic signaling by resveratrol following muscle disuse in the gastrocnemius muscles of young and old rats[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 299(6): R1572-81. DOI: 10.1152/ajpregu.00489.2010. |
| [10] | Ryan MJ, Jackson JR, Hao Y, et al. Suppression of oxidative stress by resveratrol after isometric contractions in gastrocnemius muscles of aged mice[J]. J Gerontol A Biol Sci Med Sci, 2010, 65(8): 815-31. |
| [11] | Wyke SM, Russell ST, Tisdale MJ. Induction of proteasome expression in skeletal muscle is attenuated by inhibitors of NFkappaB activation[J]. Br J Cancer, 2004, 91(9): 1742-50. |
| [12] | Russell ST, Wyke SM, Tisdale MJ. Mechanism of induction of muscle protein degradation by angiotensin Ⅱ[J]. Cell Signal, 2006, 18(7): 1087-96. DOI: 10.1016/j.cellsig.2005.09.009. |
| [13] | Wyke SM, Tisdale MJ. Induction of protein degradation in skeletal muscle by a phorbol ester involves upregulation of the ubiquitinproteasome proteolytic pathway[J]. Life Sci, 2006, 78(25): 2898-910. DOI: 10.1016/j.lfs.2005.11.014. |
| [14] | Alamdari N, Aversa Z, Castillero E, et al. Resveratrol prevents dexamethasone-induced expression of the muscle atrophy-related ubiquitin ligases atrogin-1 and MuRF1 in cultured myotubes through a SIRT1-dependent mechanism[J]. Biochem Biophys Res Commun, 2012, 417(1): 528-33. DOI: 10.1016/j.bbrc.2011.11.154. |
| [15] | Bennett BT, Mohamed JS, Alway SE. Effects of resveratrol on the recovery of muscle mass following disuse in the plantaris muscle of aged rats[J]. PLoS One, 2013, 8(12): e83518. DOI: 10.1371/journal.pone.0083518. |
| [16] | Sarcopenia EE. E Edstrom Sarcopenia[M]. Stockholm, 2005:12-24. |
| [17] | Baumgartner RN, Koehler KM, Gallagher D, et al. Epidemiology of sarcopenia among the elderly in New Mexico[J]. Am J Epidemiol, 1998, 147(8): 755-63. DOI: 10.1093/oxfordjournals.aje.a009520. |
| [18] | Delmas D, Solary E, Latruffe N. Resveratrol, a phytochemical inducer of multiple cell death pathways:apoptosis, autophagy and mitotic catastrophe[J]. Curr Med Chem, 2011, 18(8): 1100-21. DOI: 10.2174/092986711795029708. |
| [19] | Ghanim H, Sia CL, Abuaysheh S, et al. An antiinflammatory and reactive Oxygen species suppressive effects of an extract of Polygonum cuspidatum containing resveratrol[J]. J Clin Endocrinol Metab, 2010, 95(9): E1-8. DOI: 10.1210/jc.2010-0482. |
| [20] | Chen LK, Lee WJ, Peng LN, et al. Recent advances in sarcopenia research in Asia:2016 update from the Asian working group for sarcopenia[J]. J Am Med Dir Assoc, 2016, 17(8): 767.e1-7. DOI: 10.1016/j.jamda.2016.05.016. |
| [21] | Sayed RK, De Leonardis EC, Guerrero-Martínez JA, et al. Identification of morphological markers of sarcopenia at early stage of aging in skeletal muscle of mice[J]. Exp Gerontol, 2016, 83: 22-30. DOI: 10.1016/j.exger.2016.07.007. |
| [22] | Lagouge M, Argmann C, Gerhart-Hines ZA, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1 alpha[J]. Cell, 2006, 127(6): 1109-22. DOI: 10.1016/j.cell.2006.11.013. |
| [23] | Kobayashi Y, Furukawa-Hibi Y, Chen C, et al. SIRT1 is critical regulator of FOXO-mediated transcription in response to oxidative stress[J]. Int J Mol Med, 2005, 16(2): 237-43. |
| [24] | Hasegawa K, Wakino S, Yoshioka K, et al. Sirt1 protects against oxidative stress-induced renal tubular cell apoptosis by the bidirectional regulation of catalase expression[J]. Biochem Biophys Res Commun, 2008, 372(1): 51-6. DOI: 10.1016/j.bbrc.2008.04.176. |
| [25] | Stünkel W, Campbell RM. Sirtuin 1(SIRT1):the misunderstood HDAC[J]. J Biomol Screen, 2011, 16(10): 1153-69. DOI: 10.1177/1087057111422103. |
 2017, Vol. 37
2017, Vol. 37

