2. 南方医科大学 组织学与胚胎学教研室, 广东 广州 510515;
3. 南方医科大学 学实验教学管理中心//国家级医学基础实验教学示范中 心//国家级医学形态学虚拟仿真实验教学中心, 广东 广州 510515
2. Department of Histology and Embryology, Southern Medical University, Guangzhou 510515, China;
3. Experimental Teaching and Administration Center/State-level Basic Experimental Teaching Demonstration Center/State-level Virtual Simulation Center for Medical Morphology, College of Basic Medical Sciences, Southern Medical University, Guangzhou 510515, China
原发性开角型青光眼(POAG)以眼压升高、视神经损害、视野缺损为主要临床表现,其发病机制尚未完全明确。POAG眼压升高主要是由于房水经小梁网(-TM)外流阻力的增加造成[1]。透射电镜下可见POAG患者的TM细胞脱落溶解,细胞膜不完整,细胞核肿胀或皱缩,线粒体水肿,基底膜增厚,弹性纤维增多且排列紊乱[2]。可见,TM是POAG的主要成因,亦可成为治疗的靶点。
TM位于巩膜静脉窦内侧,交叉成网格状,由小梁和小梁间隙构成,是房水循环进入巩膜静脉窦的必由之路。关于其组织结构,国内、外教科书一致认为,小梁为胶原纤维,小梁间隙表面覆以内皮[3]。早期对TM结构的大量研究中同样认为TM主要由胶原纤维和内皮细胞构成,如邹欢[4]研究显示TM是一种类海绵状板层结构,由多孔扁平的胶原纤维构成,眼压波动TM会发生一定形态结构变化;近年来,Koudouna等[5]认为TM的细胞片层是由胶原纤维和少量小梁内皮细胞组成,其间所充斥的细胞外基质分子包括,弹性蛋白、胶原蛋白和一些高密度电子的黑色颗粒物质。在仔细观察眼球壁切片时,我们发现,TM显色与巩膜胶原纤维有明显差异,而与睫状肌一致且连续。有研究表明TM细胞具有收缩活动以及机械压力[6-7],并且这种收缩活动与房水流动及眼内压密切相关[8];TM具有不均一的α-SMA强阳性显色[9]。万尚韬等[10]研究发现TM处CD31、CD34阴性显色,同时α-SMA阴性显色。
由于现有研究对TM结构描述存在争议,观察切片后我们对TM是否由胶原纤维和内皮细胞构成也产生疑问,并且猜测TM内可能存在平滑肌纤维。为证明该猜想,我们采用不同的染色法对此进行了初步的探索。
1 材料和方法 1.1 实验动物取自南方医科大学实验动物中心健康成年家兔、SD大鼠和小鼠各3只。
1.2 实验方法整个实验采用多种染色方法验证TM组织结构,摘取眼球[11]、切片后随机将切片分为5组,进行以下染色:HE染色、VG染色、Masson染色以及免疫组化染色。其中VG染色是针对胶原纤维最主要的特异性染色方法;Masson染色可以同时观察并区分平滑肌细胞、胶原纤维和内皮细胞;又分别采用α-SMA、CD31两种特异性抗体鉴别平滑肌与内皮细胞[12-13]。
1.2.1 石蜡切片动物处死后立即摘取眼球,并迅速放入固定液中固定24 h。常规梯度脱水、浸腊、包埋。标本用轮转切片机进行切片,厚度4 μm,每种动物标本切片10片。
1.2.2 HE染色切片脱蜡至水,置Harris苏木精中染色,1%盐酸乙醇中分化,流水冲洗返蓝,置伊红染液中,梯度乙醇脱水,二甲苯透明,中性树胶封固,光学显微镜观察摄片。
1.2.3 VG染色切片脱蜡至水,置Weigert氏铁苏木精染色(A、B液1:1混合,使用前混合),充分水洗,用Van Gieson氏溶液染色,快速水洗,吹干,梯度乙醇脱水,二甲苯透明,中性树胶封固,光学显微镜观察摄片。
1.2.4 Masson染色切片脱蜡至水,置丽春红酸性复红染液染色,以1%磷钼酸水溶液分化处理,不水洗,直接用2%亮绿染液染色,快速水洗,电吹风吹干,中性树胶封固,光学显微镜观察摄片。
1.2.5 α-SMA免疫组化切片脱蜡至水,双氧水室温下处理,消除内源性过氧化酶活性,清洗后进行抗原修复,吸去封闭液加入第一抗体,4 ℃冰箱过夜,清洗后加入第二抗体温育,DAB显色,苏木素复染封片。阴性对照除不加入第一抗体外,其余步骤同上。阳性对照选择实验组眼球内睫状肌。一抗(1:200稀释,小鼠抗)和二抗均购自博士德(羊抗)。
1.2.6 CD31免疫组化切片脱蜡至水,双氧水室温下处理,消除内源性过氧化酶活性,清洗后进行抗原修复,吸去封闭液加入第一抗体,4 ℃冰箱过夜,清洗后加入第二抗体温育,DAB显色,苏木素复染封片。阴性对照除不加入第一抗体外,其余步骤同上。阳性对照选择实验组眼球内血管内皮细胞。一抗购自Abcam(ab28364,1: 50稀释,兔抗);二抗购自博士德(羊抗)。
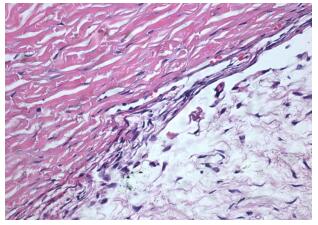
2 结果 2.1 HE染色3种动物TM呈紫红色粗丝状结构,交织成网,与睫状肌纤维胞质染色高度一致;TM表面附着的细胞界限不清,核扁,细长,呈深紫色,其胞质与TM无明显界限。睫状肌为典型的平滑肌,按不同方向成束排列。纵切的细胞呈扁平状,胞质紫红色,核扁,细长。巩膜内胶原纤维呈红色,深染;成纤维细胞依附胶原纤维,长轴与胶原纤维长轴一致,轮廓不清,核细长呈线样,深紫蓝色。血管内皮细胞胞质呈淡紫色,核深染,由于切面原因形状不一,突于腔内(图 1),TM类似睫状肌,而与胶原纤维差异明显,网格中核类似平滑肌核。
|
图 1 家兔眼球壁示TM H.E.染色 Figure 1 HE staining of the TM in rabbit eyeball (Original magnification: × 40). TM of all the three species stains purplish red, which is highly consistent with ciliary muscle fibers. |
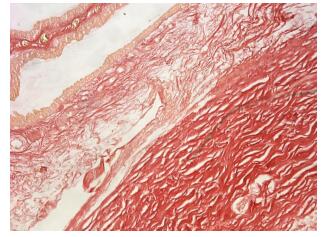
TM呈现淡红色,细丝状,而胶原纤维呈亮红色(图 2),TM内胶原蛋白阳性。
|
图 2 家兔眼球壁示TM VG染色 Figure 2 VG staining of the TM in rabbit eyeball (× 20). TM stains reddish and the collagen fibers bright red. |
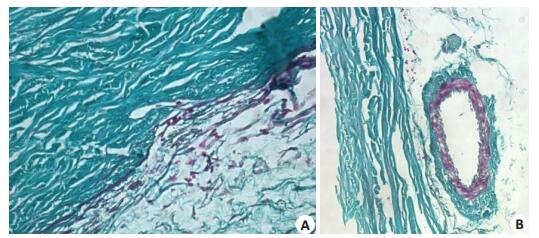
TM呈红绿相间状,以红色结构为主,巩膜胶原纤维呈绿色波浪状,睫状体的平滑肌纤维呈紫红色(图 3A),血管内皮细胞呈绿色扁平状(图 3B),TM内存在较多的平滑肌纤维,亦可见胶原纤维。
|
图 3 家兔眼球壁示TM Masson染色 Figure 3 Masson staining of the TM in rabbit eyeball. A: TM stains dark red with an extremely thin greenish tissue surrounding the red fibers (×40); B: Endothelial cells are green and flat (×20). |
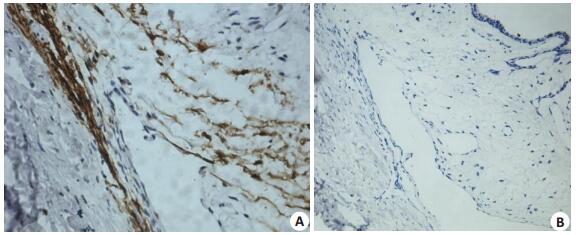
TM部分呈强阳性反应,胞质呈棕黄色颗粒(图 4A)。巩膜内胶原纤维及血管内皮细胞呈阴性,睫状体内的平滑肌纤维呈强阳性。阴性对照不着色(图 4B),TM内存在平滑肌纤维。
|
图 4 家兔眼球壁示TM α-sm IHC Figure 4 IHC for α-sm in the TM in rabbit eyeball. A: Part of TM along with the ciliary smooth muscle fibers shows strong positive reaction with brown granules in the cytoplasm (×40); B: The scleral collagen fibers and vascular endothelial cells are negative (×20). |
3种动物染色结果虽略有差异,但均为阴性(图 5A),且血管内皮细胞呈阳性反应(图 5B),阴性对照不着色(图 5C),TM内不存在血管内皮细胞。
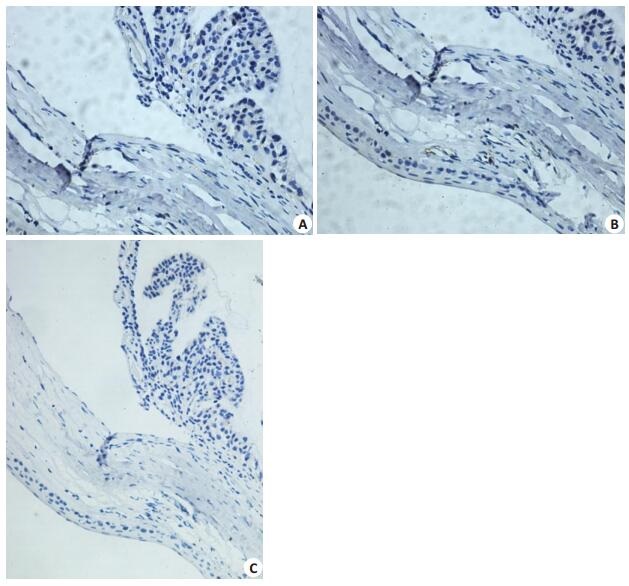
|
图 5 鼠眼球壁CD31 IHC Figure 5 IHC for CD31 in the TM in rabbit eyeball. A: TM from all the animals show negative reaction (× 40); B: Endothelial cells show positive reaction (× 40); C: Negative control (×20). |
TM主要由与睫状肌延续而来的平滑肌纤维组成,其间有少量细丝状的胶原纤维;无内皮细胞。3种实验动物TM结构完整,且在五种染色中显色一致,说明其结构有生物共性。
3 讨论在常规HE染色切片上我们发现,TM染色与睫状肌内的平滑肌纤维相似,似乎TM由平滑肌细胞组成。而且,TM似乎由睫状肌延续而来。进一步地,我们通过α-SM免疫组化和Masson染色证实:TM中存在较多的平滑肌纤维,其染色与睫状肌一致且连续。为了排除TM由胶原纤维组成,我们进行了胶原蛋白特异性的VG染色和Masson染色,结果仅在TM表面发现少量胶原纤维。我们推测,这极有可能为平滑肌纤维的肌内膜。为了证明TM小梁间隙表面不存在内皮细胞,我们用血管内皮细胞的特异性抗原CD31进行免疫组化染色,结果均为阴性,从而证实TM内根本不存在内皮细胞。实际上,之前已经有实验证明,人、猪、狗、牛眼球TM中内皮细胞特异性的凝血因子Ⅷ,CD31和CD34免疫组化阴性表达[14-15],与我们实验结果一致。但这些文献中均未给出合理的解释,也没有否认TM中内皮细胞的存在。
综上所述,通过多种组织切片,我们可初步断定TM主要由睫状肌延续而来的平滑肌纤维构成,外周包绕微量胶原纤维即肌内膜,不存在内皮细胞。该现象在家兔、大鼠和小鼠无差异,具有普遍性。就现有文献显示,透射电镜下可明显观察到小梁网组织有明暗交替的周期性横纹,作者认为其为肌内膜的Ⅵ型胶原原纤维[5]。后续可通过电镜术或/和其他分子标记术甚至功能学进行深入研究。
众所周知,TM是房水循环的关键部位,而当房水外流受阻时,房水聚积在眼内,引起眼压升高,这是青光眼性视神经损害的主要危险因素[16]。目前POAG的主要治疗手段是通过减少房水生成而降低眼压,但是TM营养物质及氧主要由流经TM的房水提供。Kiland [17]等实验证实,在减少房水生成一段时期后可减少房水外流。从而使提供给TM的氧及营养物质减少,并引起TM处细胞外基质积聚,使病情加重。手术游离TM的效果可能更糟。
当然,这些治疗是建立在“TM由胶原纤维构成”这一基础上的。如果TM为平滑肌呢?实际上,已经有研究证明,TM可被胆碱能药物等多种物质诱导在组织水平上表现出收缩效应[18]。利用特异性的M3受体单克隆抗体,可从原位证实人眼TM细胞表达M3受体[19]。而M3受体主要分布于平滑肌和腺体中[20],介导平滑肌收缩和腺体分泌。这些实验都可辅助证明TM内存在平滑肌纤维。且近年来的研究表明,TM存在平滑肌样的α-肌动蛋白并具有主动收缩功能[21]。
因此,未来青光眼的降眼压治疗应更注重增加TM途径的房水外流,而不是单纯地抑制房水生成,或许TM内的平滑肌纤维可以为治疗POAG提供新的靶点。
| [1] | 安琳, 季健. 原发性开角型青光眼房水外流通路改变的研究进展[J]. 中华眼科杂志, 2011, 47(10): 953-6. DOI: 10.3760/cma.j.issn.0412-4081.2011.10.020. |
| [2] | 杨玉霞, 刘杏, 黄晶晶, 等. 原发性开角型青光眼小梁网组织早衰的初步研究[J]. 中山大学学报:医学科学版, 2014, 35(5): 796-800. |
| [3] | 邹仲之. 组织学与胚胎学[M]. 8版. 北京: 人民卫生出版社, 2013: 87. |
| [4] | 邹欢. 持续高眼压波动引起小梁网结构改变的研究[D]. 重庆: 第三军医大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-90031-1014359949.htm |
| [5] | Koudouna E, Young RD, Ueno M, et al. Three-dimensional architecture of collagen type Ⅵ in the human trabecular meshwork[J]. Mol Vis, 2014, 20: 638-48. |
| [6] | Pattabiraman PP, Rao PV. Hic-5 regulates actin cytoskeletal reorganization and expression of fibrogenic markers and myocilin in trabecular meshwork cells[J]. Invest Ophthalmol Vis Sci, 2015, 56(9): 5656-69. DOI: 10.1167/iovs.15-17204. |
| [7] | Gonzalez J, Ko MK, Pouw A, et al. Tissue-based multiphoton analysis of actomyosin and structural responses in human trabecular meshwork[J]. Sci Rep, 2016, 6: 21315. DOI: 10.1038/srep21315. |
| [8] | Rasmussen CA, Kaufman PL. The trabecular meshwork in normal eyes and in exfoliation glaucoma[J]. J Glaucoma, 2014, 23(8 Suppl 1): S15-9. |
| [9] | Overby DR, Bertrand J, Schicht M, et al. The structure of the trabecular meshwork, its connections to the ciliary muscle, and the effect of pilocarpine on outflow facility in mice[J]. Invest Ophthalmol Vis Sci, 2014, 55(6): 3727-36. DOI: 10.1167/iovs.13-13699. |
| [10] | 万尚韬, 李永平, 张平, 等. 淋巴管内皮标志物D2-40在人眼小梁网的表达[J]. 中华实验眼科杂志, 2015, 33(10): 892-5. DOI: 10.3760/cma.j.issn.2095-0160.2015.10.006. |
| [11] | 孙高军, 王苏宏. 犬眼球摘除术[J]. 山东畜牧兽医, 2009, 30(6): 78. |
| [12] | 魏晓妍. 鉴别胶原纤维与平滑肌纤维染色法的改进[J]. 锦州医学院学报, 2001, 22(4): 33-33. |
| [13] | 王满贵, 宋志宙. HE染色切片的技术操作规范[J]. 大同医学专科学校学报, 2004, 24(2): 21, 25. |
| [14] | 张海涛. 常见实验动物小梁网结构比较、小梁网内皮细胞培养及激光虹膜损伤产物对小梁网内皮细胞影响[D]. 中国协和医科大学北京协和医学院中国医学科学院清华大学医学部, 2002. http://d.wanfangdata.com.cn/Thesis/Y462786 |
| [15] | 万尚韬, 李永平, 张平, 等. 成人眼小梁网内皮细胞具有干细胞/祖细胞的属性[J]. 中国组织工程研究, 2014, 18(14): 2213-8. DOI: 10.3969/j.issn.2095-4344.2014.14.013. |
| [16] | 容芬, 刘旭阳, 陈晓明. 小梁网途径房水外流阻力的成因[J]. 国际眼科纵览, 2008, 32(1): 45-9. |
| [17] | Kiland JA, Gabelt BT, Kaufman PL. Studies on the mechanism of action of timolol and on the effects of suppression and redirection of aqueous flow on outflow facility[J]. Exp Eye Res, 2004, 78(3): 639-51. DOI: 10.1016/j.exer.2003.11.001. |
| [18] | Spurr-Michaud SI, de kater AW. localization of smooth muscle myosin-containing cells in the aqueous outflow pathway[J]. Invest Ophthalmol Vis Sci, 1990, 31(2): 347-53. |
| [19] | 罗书科, 彭大伟, 曾淑君, 等. 正常人和原发性开角型青光眼患者小梁网M_3受体的表达[J]. 中华眼科杂志, 2001, 37(6): 21-3. |
| [20] | Kaufman PL, Gabelt BT. Inhibition of aceclidine-stimulated outflow facility, accommodation and miosis in rhesus monkeys by muscarinic receptor subtype antagonists[J]. Exp Eye Res, 1994, 58(5): 623-30. DOI: 10.1006/exer.1994.1057. |
| [21] | Wiederholt M, Schäfer R, Wagner U, et al. Contractile response of the isolated trabecular meshwork and ciliary muscle to cholinergic and adrenergic agents[J]. Ger J Ophthalmol, 1996, 5(3): 146-53. |
 2017, Vol. 37
2017, Vol. 37

