预防治疗已是重型血友病A的标准治疗[1-2]。欧美等发达国家采用的足量预防治疗(20~40 U/kg,2~3次/周或≥60 U/kg)的突破性出血特点及影响因素研究较多[3-6],其能够将重型血友病A患者关节突破性出血(AJBR)控制在0~1次/年,从而保持几乎正常的骨关节状态[7],但凝血因子消耗量大[8],无法适应中国国情。现时中国重型血友病A成人患者主要接受低剂量预防治疗(10~15 U/kg,2次/周或 < 30 U/kg)和中剂量预防治疗(15~20 U/kg,2~ 3次/周或 < 60 U/kg)[9]。目前低中剂量预防治疗的研究有限,且主要集中在出血次数及关节结局上[10-13],其突破性出血的特点分析尚未见报道。中国成人重型血友病A患者既往治疗不足[14],接受低中剂量三级预防治疗时突破性出血的影响因素可能与国外存在一些不同。研究中国患者现阶段突破性出血特点及影响因素,有助于探讨治疗资源受限条件下低中剂量预防治疗的疗效改善途径。
1 资料和方法 1.1 研究对象将2015年1月~2017年1月在南方医院血友病诊疗中心门诊利用重组人凝血因子FⅧ(拜科奇,批号:270R840;270TGWK)进行低中剂量预防治疗的49例重型血友病A患者纳入研究。年龄为31.53±7.33岁,体质量为62.47±10.45 kg,体质量指数(BMI)为21.94± 3.85 kg/m2,随访前接受预防治疗时间161.63±39.83 d,抑制物检测均为阴性,随访时间为183.57±36.73 d。按照预防治疗方案分为低剂量组和中剂量组,所有的患者均获得了知情同意。
1.2 研究方法本研究为单中心、前瞻性、观察性研究。利用自制的《血友病患者基本资料收集表格》收集患者基本资料,检测72 hFⅧ谷活性及评估活动能力,利用自主设计的“血友管家” APP(软著登字第1615355,1616123,1698561号)对出血和治疗情况进行准确记录随访,随访时间不少于4个月。
1.3 观察指标 1.3.1 年化突破性出血次数(ABR)及年化关节突破性出血次数(AJBR)ABR是指将一定时期内的突破性出血次数进行年化处理,计算公式为ABR=随访时间内的出血次数÷随访时间×365.25;AJBR计算方法类似。
1.3.2 突破性出血原因分为自发性出血和创伤性出血。定义:自发性出血是指无明显诱因发生的出血;创伤性出血是活动后或者明确的外伤如摔倒、割伤等引起的出血。
1.3.3 突破性出血出现时间指预防治疗的患者某次出血时间与其最近一次预防注射时间的差值,以小时(h)为单位。
1.3.4 靶关节参照世界血友病联盟(WFH)对靶关节的定义[2],某一个关节在6月内出血次数达3次或者以上则定义为靶关节,连续12月内该关节出血≤2次则定义为靶关节解除。
1.3.5 72 hFⅧ谷活性预防注射后72 h对患者抽血行F Ⅷ活性检测,每位患者抽血2次检测,采用一期法活化的部分凝血活酶时间(APTT)法进行FⅧ活性测定,结果取平均值;对预防注射间隔为3 d以上的患者进行72 hFⅧ谷活性测定。
1.3.6 临床出血表型在按需治疗情况下,通常用年出血次数及年关节出血次数来表示患者的临床出血表型[15]。本研究利用血友病患者在未接受预防治疗时按需治疗情况下的年出血次数/年关节出血次数(Pre-ABR/PreAJBR)来表示患者的临床出血表型。
1.3.7 活动能力利用血友病功能独立性评分量表(FISH量表)进行活动能力评估,血友病功能独立性评分是一种客观的基于操作能力的评定方法,其评价内容包括自我照顾、转移能力、运动能力3个方面。FISH量表最低分为8分,最高分为32分,分值越高表明功能独立性越好,活动能力也越好。
1.4 统计方法使用SPSS 20.0统计软件对所得数据进行MannWhittney Test、t-test及Spearman相关分析,P < 0.05认为差异有统计学意义。
2 结果 2.1 一般资料低剂量组纳入15例,中剂量组纳入34例。中位随访6月,两组年龄、体质量指数(BMI)、临床出血表型(Pre-ABR/Pre-AJBR)无明显差异(P > 0.05)。与低剂量组相比,中剂量组每月的预防治疗因子消耗高出33.7%,突破性出血治疗因子消耗则减少了15.1%,因子消耗总量高出27.0%(表 1)。
| 表 1 两组的一般资料及比较 Table 1 General information of the patients in the two groups (Mean±SD) |
低剂量组和中剂量组的ABR分别为20.44±13.15次/年和11.43±7.01次/年,AJBR分别为18.79±13.03次/年和9.28±7.02次/年。中剂量组ABR和AJBR均比低剂量组少(P < 0.05,图 1);低剂量组和中剂量组AJBR≤3次/年的患者占比分别为6.67%和11.76%,两组无明显差异(χ2=1.974,P=0.242)。
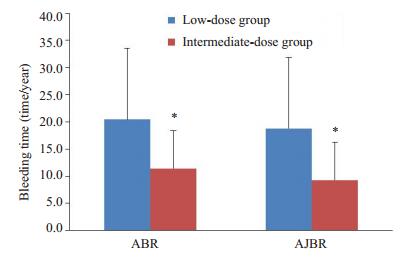
|
图 1 两组的ABR/AJBR的比较 Figure 1 Comparison of ABR and AJBR between the two groups. *P < 0.05 vs low-dose group. |
随访期间,两组的自发性出血比例、存在靶关节患者比例和靶关节出血占比均高,且低剂量组高于中剂量组(P < 0.05,表 2)。预防注射后0~12 h,低剂量组与中剂量组突破性出血发生率均低且无明显差异(4.86% vs 5.18%,χ2=0.018,P=1.000),而预防注射后12~48 h,两组的突破性出血发生率均高,且低剂量组明显高于中剂量组(64.68% vs 47.67% χ2=3.967,P=0.040)。
| 表 2 两组的突破性出血原因分析 Table 2 Analysis of breakthrough bleeding in the two groups |
低剂量组突破性出血出现时间为40.08 h(1.44~ 96.48 h),中剂量组突破性出血出现时间为46.08 h(0.48~124.08 h),低剂量组突破性出血出现时间早于中剂量组(P=0.008,图 2)。
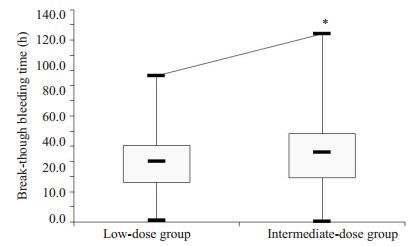
|
图 2 两组突破性出血出现时间比较 Figure 2 Comparison of onset time of breakthrough bleeding between the two groups. *P < 0.05 vs low-dose group. |
49例患者的AJBR为12.19±10.15次/年,每月预防消耗因子量为90.51±27.11 U/kg,AJBR与预防消耗因子量负相关(r=-0.57,P=0.000,图 3)。
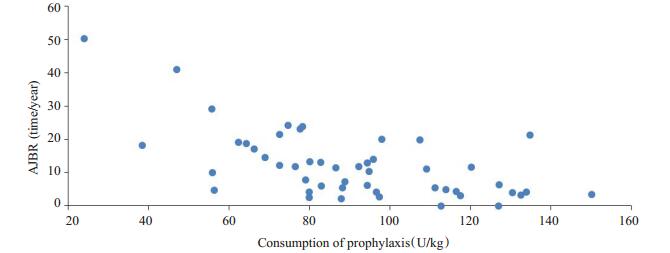
|
图 3 AJBR与预防消耗因子量的关系 Figure 3 Relationship between AJBR and consumption of prophylaxis. |
低剂量组和中剂量组行72 hFⅧ谷活性检测的患者有9例和23例,72 hFⅧ谷活性 < 1%的患者比例分别为44.4%和34.8%。低剂量组AJBR与72 hFⅧ谷活性无相关(r=0.092,P=0.814);中剂量组AJBR与72 hFⅧ谷活性负相关(r=-5.24,P=0.01)。
2.7 AJBR与临床出血表型的关系低剂量组和中剂量组Pre-AJBR为19.20±6.75次/年和27.41±20.96次/年,两组的AJBR均与Pre-AJBR正相关(r=0.618,P=0.014;r=0.352,P=0.041)。
2.8 AJBR与活动能力的关系低剂量组和中剂量组FISH总分为19.40±2.35分和20.16±2.10分,两组的FISH评分无明显差别(P > 0.05);两组的AJBR均与FISH评分负相关(r=-0.596,P= 0.019;r=-0.426,P=0.012)。
3 讨论中国重型血友病A成人患者由于受历史治疗不足的影响,已经存在不同程度的关节病变甚至残疾[16],其主要预防治疗目标是减少关节出血次数,延缓关节病进展,改善生活质量[17]。研究现时中国预防治疗条件下的突破性出血特点及影响因素,有助评判治疗效果和探讨改善途径。
近年中国低中剂量预防治疗的使用经验主要在重型血友病A儿童[10-11, 13],成人报道较少。2015年北京协和医院[12]回顾性分析22例18~50岁重型血友病A患者低剂量预防治疗(5~10 U/kg,2~3次/周)的疗效,其ABR为11.1±7.2次/年;本课题组李志涛等[18]也回顾性分析了16例中位年龄为32岁的重型血友病患者低剂量预防治疗的AJBR为12.2次/年。本研究前瞻性观察结果显示,成人重型血友病A患者低中剂量预防治疗AJBR分别为18.79次/年和9.28次/年,而FISHER等[19]报道的欧美国家重型血友病A成人患者中剂量预防治疗的AJBR为3.3次/年,提示中国重型血友病A成人患者AJBR高于国外,主要原因可能是中国患者儿童期治疗不足,关节功能更差,而欧美国家患者自幼开始接受预防治疗,从而保持了更好的骨关节状态。研究表明,AJBR超过3次/年,关节病变将不断进展[20]。本研究显示,低中剂量预防治疗的中国重型血友病A成人患者仅有6.67%和11.76%能够达到延缓关节病变进展的治疗目标,多数患者的关节突破性出血仍偏高,提示现时中国采用的低中剂量预防治疗有迫切改进的需要。
通过我们前瞻性观察,中国重型血友病A成人患者采用低中剂量预防治疗过程中突破性出血的特点主要体现在以下几个方面:(1)自发性出血比例高, 说明低中剂量预防治疗方案尚不足于改变该疾病反复自发性出血的临床特征;(2)存在靶关节患者比例和靶关节出血占比高,提示低中剂量预防治疗的患者可能无法实现延缓关节病进展和改善生活质量[21]的目标;(3)突破性出血出现时间早。本研究低中剂量预防治疗注射间隔时间分别为3.53 d(84.72 h)及2.85 d(68.40 h)。而突破性出血出现时间分别为40.08 h及46.08 h,提示患者暴露在易出血的时段较长。
本研究突破性出血影响因素分析可见,预防剂量不足是最主要因素,具体表现在:(1)关节突破性出血与预防消耗因子量负相关,提高预防消耗因子量可以减少关节突破性出血。(2)低中剂量预防治疗分别有44.4%及34.8%的患者72 hFⅧ谷活性不能维持在1%以上,提示尚有相当部分成人患者不能达到始终维持体内FⅧ活性大于1%的预防治疗原理[22, 23]。本研究发现突破性出血的其它影响因素还包括:(1)临床出血表型。临床出血表型轻的患者进行低中剂量预防治疗时关节突破性出血少。(2)活动能力。提高活动能力可减少低中剂量预防治疗的AJBR。
本研究观察结果虽然与既往临床经验和国外文献[24]推测一样,预防剂量不足是我国重型血友病A成人患者低中剂量预防疗效尚不佳的最主要影响因素,由于受国情限制,预防剂量不足在短时间内难以改变。但本研究结果提示,下述几个方法是现阶段改善成人患者低中剂量预防疗效的可能途径:(1)减少靶关节。在预防治疗中尽早发现关节出血并及时足量治疗以缩短滑膜炎存在的时间及避免进入出血-滑膜增生-出血的恶性循环[25]、适时进行康复锻炼、同位素滑膜切除术[26]和短期内提高预防剂量[2]等方式来减少靶关节;(2)合理安排作息与预防注射时间。低中剂量预防治疗预防注射后0~12 h内,自发性及创伤性突破性出血发生率均低,患者可将工作、活动及康复锻炼安排在此时间段;(3)适当缩短预防注射间隔。研究表明[27]缩短预防注射间隔,能够在不明显增加因子消耗的情况下提高有效FⅧ谷活性,从而减少突破性出血;(4)改善临床出血表型。在资源受限的国家,重型血友病患者尽早开始低中剂量预防治疗,通过持续的预防治疗改善临床出血表型,亦可提高低中剂量预防治疗的疗效;(5)改善活动能力。在预防注射后0~12 h内进行适当的康复锻炼及在平时活动中携带护腕、护膝等辅助支具,均有助于提升关节功能及肌肉力量,从而改善活动能力,减少突破性出血。
综上所述,预防因子剂量虽然是我国重型血友病A成人患者低中剂量三级预防治疗的疗效的最主要影响因素,但我们依然可以通过减少靶关节、合理安排作息与预防注射时间、缩短预防注射间隔、改善临床出血表型及活动能力等非因子途径来改善疗效。建立包括内科、外科、康复、护理等更多内容的综合关怀模式以及紧密的医患联系途径和三级诊疗新模式也是进一步提高我国血友病患者治疗水平的途径,这些也是资源受限条件下实现个体化治疗的途径。
| [1] | Berntorp E, Boulyjenkov V, Brettler D, et al. Modern treatment of haemophilia[J]. Bull World Health Organ, 1995, 73(5): 691-701. |
| [2] | Srivastava A, Brewer AK, Mauser-Bunschoten E P, et al. Guidelines for the management of hemophilia[J]. Haemophilia, 2013, 19(1): E1-E47. DOI: 10.1111/hae.2012.19.issue-1. |
| [3] | Warren BB, Blades T, Smith NL, et al. Breakthrough Bleeding in Hemophilia a Patients on Prophylaxis[J]. 2016, 128(22):2581. http://www.bloodjournal.org/content/128/22/2581 |
| [4] | Ar MC, Baslar Z, Soysal T. Personalized prophylaxis in people with hemophilia A:challenges and achievements[J]. Expert Rev Hematol, 2016, 9(12): 1203-8. DOI: 10.1080/17474086.2016.1252670. |
| [5] | Collins PW. Personalized prophylaxis[J]. Haemophilia, 2012, 18(Suppl 4): 131-5. |
| [6] | Fischer K, van der Bom JG, Mauser-Bunschoten EP, et al. The effects of postponing prophylactic treatment on long-term outcome in patients with severe hemophilia[J]. Blood, 2002, 99(7): 2337-41. DOI: 10.1182/blood.V99.7.2337. |
| [7] | Manco-Johnson MJ, Abshire TC, Shapiro AD, et al. Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia[J]. N Engl J Med, 2007, 357(6): 535-44. DOI: 10.1056/NEJMoa067659. |
| [8] | Fischer K, Van Den Berg M. Prophylaxis for severe haemophilia:clinical and economical issues[J]. Haemophilia, 2003, 9(4): 376-81. DOI: 10.1046/j.1365-2516.2003.00764.x. |
| [9] | 王鸿利, 王学锋. 血友病诊断和治疗的专家共识[J]. 内科理论与实践, 2009, 4(3): 236-244. |
| [10] | 程洪波, 黄艳辉, 翟保华, 等. 中和低剂量重组人凝血因子Ⅷ防治血友病A关节出血的疗效[J]. 南昌大学学报:医学版, 2013, 53(12): 40-2. |
| [11] | 胡群, 秦秀丽, 刘爱国, 等. 儿童血友病A低剂量预防治疗的疗效观察[J]. 北京医学, 2013, 35(4): 257-9. |
| [12] | 连小赟, 李魁星, 华宝来, 等. 北京地区单中心成人重型血友病A患者的三级预防治疗[J]. 中国医学科学院学报, 2015, 37(4): 398-401. |
| [13] | Tang L, Wu R, Sun J, et al. Short-term low-dose secondary prophylaxis for severe/moderate haemophilia A children is beneficial to reduce bleed and improve daily activity, but there are obstacle in its execution:a multi-centre pilot study in China[J]. Haemophilia, 2013, 19(1): 27-34. DOI: 10.1111/hae.2012.19.issue-1. |
| [14] | 杨仁池. 大力开展预防治疗, 进一步提高我国血友病患者生活质量[J]. 中华血液学杂志, 2015, 36(7): 537-8. DOI: 10.3760/cma.j.issn.0253-2727.2015.07.001. |
| [15] | Santagostino E, Mancuso ME, Tripodi A, et al. Severe hemophilia with mild bleeding phenotype:molecular characterization and global coagulation profile[J]. J Thromb Haemost, 2010, 8(4): 737-43. DOI: 10.1111/jth.2010.8.issue-4. |
| [16] | Ozelo MC, Matta MA, Yang R. Meeting the challenges of haemophilia care and patient support in China and Brazil[J]. Haemophilia, 2012, 18(Suppl 5): 33-8. |
| [17] | Blanchette VS, Key NS, Ljung LR, et al. Definitions in hemophilia:communication from the SSC of the ISTH[J]. J Thromb Haemost, 2014, 12(11): 1935-9. DOI: 10.1111/jth.2014.12.issue-11. |
| [18] | 李志涛, 杨欢, 邱石球, 等. 儿童与成人重型血友病A患者低剂量预防治疗效果的比较[J]. 广东医学, 2016, 37(16): 2406-9. |
| [19] | Fischer K, Steen CK, Petrini P, et al. Intermediate-dose versus highdose prophylaxis for severe hemophilia:comparing outcome and costs since the 1970s[J]. Blood, 2013, 122(7): 1129-36. DOI: 10.1182/blood-2012-12-470898. |
| [20] | Funk MB, Schmidt H, Becker S, et al. Modified magnetic resonance imaging score compared with orthopaedic and radiological scores for the evaluation of haemophilic arthropathy[J]. Haemophilia, 2002, 8(2): 98-103. DOI: 10.1046/j.1365-2516.2002.00585.x. |
| [21] | Mulder K, Llinas A. The target joint[J]. Haemophilia, 2004, 10(Suppl 4): 152-6. |
| [22] | Ahlberg A. Haemophilia in Sweden. Ⅶ. Incidence, treatment and prophylaxis of arthropathy and other musculo-skeletal manifestations of haemophilia A and B[J]. Acta Orthop Scand Suppl, 1965, 73-77: 3-22. |
| [23] | Nilsson IM, Berntorp E, Lofqvist T, et al. Twenty-five years' experience of prophylactic treatment in severe haemophilia A and B[J]. J Intern Med, 1992, 232(1): 25-32. DOI: 10.1111/joim.1992.232.issue-1. |
| [24] | Fischer K. Low-dose prophylaxis for severe haemophilia:a little goes a long way[J]. Haemophilia, 2016, 22(3): 331-3. DOI: 10.1111/hae.2016.22.issue-3. |
| [25] | van Genderen FR, Fischer K, Heijnen L, et al. Pain and functional limitations in patients with severe haemophilia[J]. Haemophilia, 2006, 12(2): 147-53. DOI: 10.1111/hae.2006.12.issue-2. |
| [26] | Beeton K, Rodriguez-Merchan EC, Alltree J. Total joint arthroplasty in haemophilia[J]. Haemophilia, 2000, 6(5): 474-81. DOI: 10.1046/j.1365-2516.2000.00443.x. |
| [27] | Hua B, Lee A, Fan L, et al. Low-dose factor Ⅷ infusion in Chinese adult haemophilia A patients:pharmacokinetics evidence that daily infusion results in higher trough level than with everyother-day infusion with similar factor Ⅷ consumption[J]. Haemophilia, 2017, 23(3): 417-21. DOI: 10.1111/hae.2017.23.issue-3. |
 2017, Vol. 37
2017, Vol. 37

