2. 南方医科大学南方医院 超声科, 广东 广州 510515;
3. 南方医科大学南方医院 消化内科, 广东 广州 510515
2. Department of Ultrasound, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Department of Gastroenterology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
食管静脉曲张(EV)是肝硬化门脉高压主要表现之一。在肝硬化自然病程中,无EV患者年病死率仅1%,有EV患者年病死率升高至3.4%,而有胃肠出血的失代偿期患者年病死率则高达57%[1]。因此,国内外临床诊疗指南明确推荐,对于肝功能失代偿或有红斑征的轻度EV建议予β-受体阻滞剂预防性治疗,对中度、重度EV,即高风险食管静脉曲张(HREV)给予β-受体阻滞剂预防性治疗或内窥镜套扎,以预防首次食管静脉曲张出血(EVB)发生率[2-3]。EVB是肝硬化患者严重的危及生命的并发症,近年来系列临床诊疗方案的持续改进使AVB发生率自1986年统计的超过40%降至至今的15%[4-6]。在肝硬化患者病程中,及早发现和明确EV、HREV,以及时采取有效的预防措施而阻遏患者EVB发生,很关键。然而,迄今明确EV状态仍主要依靠有创性的上消化道内窥镜检查,患者依从性差,因而,探索发展无创性EV、HREV诊断与预测方法,仍是目前需要解决的重要科学问题[7],对EV早期预警、预防EVB发生风险,对提升肝硬化患者尤其是中晚期的救治成效,具有重要价值,亦可减少肝硬化EV病程中不必要的的有创性内窥镜检查。
在临床常规检查指标中,较早研究发现血小板计数(PLT)低和腹水发生是可预测EV的独立因素[8],超声检查肝包膜不规则也可作为EV预测指标[9],门静脉内径(PVD)、脾厚径(SPT)以及胃底静脉内径对肝硬化EV诊断具有一定的提示作用[10]。对胆汁性肝硬化患者EV情况分析发现脾长径、PVD、白蛋白(ALB)等指标与EV相关[11]。肝硬化EV的无创性检测技术,目前主要集中在实用超声诊断技术、振动控制瞬时弹性成像技术(FibroScan®),结合临床常用血液检测指标,进行预测指数模型的构建,取得了系列进展,但EV无创诊断效能仍需提高,其中肝硬化患者不同的个体、人群以及不同的病因,是导致EV无创性指数的诊断效能不同的重要因素之一,因而,需要展开不同人群、不同病因的肝硬化EV预测指数的深入分析,为EV无创诊断技术的临床实际应用奠定基础。
本研究对经我院临床确诊的病因为乙型、丙型肝炎和酒精性肝病的202例肝硬化患者,采集患者肝、胆囊、脾及其血管的超声测量参数,联合血常规、血液生化指标,对肝硬化EV、HREV状态进行预测指数模型的构建与诊断评价,以筛选具有良好诊断效能的EV、HREV相关性无创性检测指数,为肝硬化EV的有效临床诊疗提供科学依据。
1 资料和方法 1.1 病例资料202例病例筛选、纳入条件:为本院感染内科2014年1月~2016年12月经临床确诊的肝硬化住院患者,年龄14~85(42.5±10.3)岁,其中女36(17.8%)例;肝硬化病因包括乙型肝炎、丙型肝炎及酒精性肝硬化;所有患者均无血液系统疾病及上消化道出血病史;患者从未接受内窥镜食管静脉硬化或套扎治疗、外科门脉高压手术或经颈静脉肝内门体分流治疗、普萘洛尔等β-受体阻滞剂治疗。
1.2 资料收集回顾性收集病例数据信息,包括:性别、年龄;肝、胆囊、脾及其血管超声测量参数:SPT(脾门到脾对侧缘径线)、脾静脉内径(SVD)、PVD;血常规:白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HGB)、红细胞比容(HCT)、红细胞分布宽度(RDW)、PLT;生化指标:凝血酶原时间(PT)、国际标准化比值(INR)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、ALB、球蛋白(GLB)、总胆红素(TB)、C反应蛋白(CRP)、肌酐(CRE);乙型肝炎病毒DNA(HBV-DNA)及乙型肝炎核苷(酸)类似物抗病毒疗程(NA therapy)。
1.3 仪器设备及其检测指标评分标准意大利Esaote Mylab型彩色多普勒超声诊断仪,配备凸阵探头CA431,频率1~8 MHz,检查由两位超声诊断医师完成,记录肝、胆囊、脾超声声像,测量ST、SVD、PVD,肝、胆囊超声评分(US)为以下指标评分合计:① 肝包膜:光滑为1分,欠光滑或波纹状为2分,锯齿状为3分;② 肝实质回声:均匀为1分,欠均匀为2分,强弱回声光团为3分;③ 肝血管:清晰为1分,欠清晰为2分,狭窄为3分;④ 胆囊壁:清晰为1分,欠光滑为2分,模糊为3分。
胃镜检查由多位操作者完成,根据胃镜报告按《消化道静脉曲张及出血的内镜诊断和治疗规范试行方案(2009年)》[12]将EV分为无、轻度、中度、重度,其中中度、重度EV定义为HREV。
1.4 统计学方法采用SPSS19.0软件。计量资料根据是否正态分布以均数±标准差或中位值(范围)表达,分别采用t检验或Mann-Whitney U检验,计数资料采用四格表或Fisher精确概率法检验。EV预测模型确定采用Logistic逐步回归分析,EV诊断评价采用受试者工作特征曲线下面积(AUROC)及对应临界值的诊断灵敏度(Se)、特异度(Sp)、阳性预测值(PPV)、阴性预测值(NPV)、阳性似然比(PLR)、阴性似然比(NLR)等指标评价,根据NLR尽可能接近或低于0.1、PLR尽可能高于10原则分别确定排除、确定EV临界值。AUROC比较采用DeLong检验。统计学显著性确定为双侧检验。
2 结果 2.1 患者人口学及临床特征与EV、HREV相关性及诊断模型构建202例[乙型肝炎185例(91.6%)、丙型肝炎12例(5.9%)、酒精性肝病5例(2.5%)]患者中胃镜诊断无、轻度、中度、重度EV分别有34(16.8%)、50(24.8%)、44(21.8%)、74(36.6%)例,EV比例83.2%,HREV比例58.4%。表 1显示纳入回顾性分析患者的人口学及临床特征。EV与非EV(non-EV)、HREV与非HREV(non HREV)患者中US、SPT、SVD、PVD、ALT、PI、INR及血常规五项指标均具有统计学差异(P<0.05)。
| 表 1 纳入回顾性分析的202例肝硬化患者人口学及临床特征 Table 1 Demographic and clinical data of 202 patients with liver cirrhosis |
将上述EV、HREV相关性指标纳入逐步向前法logistic回归分析构建EV、HREV预测模型,US、SPT、WBC、ALB参与构建EV预测指数USWA,SPT、ALB参与构建HREV预测指数SPA,其演算公式如下:
| $ \begin{array}{l} \;\;\;\;\;\;\;\;{\rm{USWA = 0}}{\rm{.401}} \times {\rm{US}} + 0.1 \times {\rm{SPT}}\left( {{\rm{mm}}} \right)-0.333 \times {\rm{WBS}}\\ \left( {{{10}^9}{\rm{/L}}} \right)-0.136 \times {\rm{ALB}}\left( {{\rm{g}}/{\rm{L}}} \right)\\ \;\;\;\;\;\;\;\;\;{\rm{SPA = 0}}{\rm{.080}} \times {\rm{SPT}}\left( {{\rm{mm}}} \right)-0.102 \times {\rm{ALB}}\left( {{\rm{g}}/{\rm{L}}} \right) \end{array} $ |
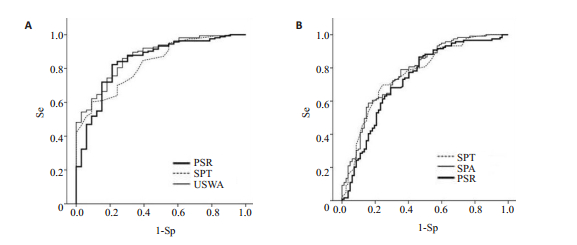
表 2显示各单项指标、诊断模型及年龄>50岁、血小板<150×109/L、AST/ALT>1.0、白蛋白<36 g/L四项指标评分(AAAP)[13]诊断EV、HREV的AUROC,其中诊断模型、血小板/脾厚径比值(PSR)、SPT、US、SVD及PLT诊断EV的AUROC高于0.7;诊断模型、SPA、PSR及SPT诊断HREV的AUROC高于0.7。诊断模型与PSR、SPT无统计学差异(表 2, 图 1)。
| 表 2 食管静脉曲张相关性指标诊断食管静脉曲张受试者操作特征曲线下面积 Table 2 Area under ROC curve (AUROC) of EV related indexes for diagnosis of esophageal varices (EV) |
|
图 1 不同食管静脉曲张指数(A)、高风险食管静脉曲张指数(B)的受试者工作特征曲线 Figure 1 AUROC of the different indexes for EV (A) and HREV (B) prediction. Se: Sensitivity; Sp: Specificity; PSR: Platelet/splenic thickness ratio; SPT: Splenic thickness; USWA: US-SPTWBC-ALB (prediction model for EV); SPA: SPT-ALB (prediction model for HREV). |
表 3显示EV、HREV建议诊断界值及评价指标。在EV诊断中,AAAP<1、USWA<-0.30、PSR>3.646、SPT<37 mm可基本排除EV,USWA≥3.34、PSR≤0.75、SPT≥54 mm可完全确定EV诊断;此外,其他单项指标PLT<50×109/L、US≥10、SDV≥10均可诊断EV,PLT诊断可靠性最高。在HREV诊断中,SPA<-0.68、PSR>3.40、SPT<37 mm可基本排除HREV,SPA≥2.25、SPT≥ 78 mm可完全确定HREV诊断。
将PSR≤0.75、SPT≥54 mm、PLT<50×109/L、US≥ 10、SVD≥10分别赋予分值1,相反分值为0,总分为食管静脉曲张评分(esophageal varices score, EVS),诊断EV的AUROC 0.817(95%可信区间0.748-0.887),EVS≥3完全确定EV诊断,但EVS≥2诊断EV的PLR仅5.2。
| 表 3 食管静脉曲张相关指标(指数)推荐界值及其诊断评价 Table 3 Diagnostic evaluation of the critical values for esophageal varices (EV) indexes |
表 4显示各单项指标(指数)同步联合或序贯联合诊断EV、HREV的效能评价。
| 表 4 管静脉曲张相关指标(指数)联合诊断评价 Table 4 Performance of different combinations of the indexes in diagnosis of esophageal varices |
在确定EV诊断中,SPT≥54 mm、US≥10序贯诊断的PLR仅4.0,无确定诊断价值;SPT≥54 mm、血小板≤ 50×109/L序贯诊断EV的PLR 17.7,统计学上具有确定诊断价值,可诊断患者比例43.1%;尽管SPT≥54 mm序贯联合EVS≥3或PSR<0.75可完全确定诊断,但患者比例仅约37%;SPT≥54 mm序贯联合EV预测诊断模型指数USWA≥3.34可完全确定EV诊断,患者比例亦可达到46%,但该模型有待进一步验证。此外,SPT<37 mm +PSR>3.646、SPT<37 mm+USWA<-0.30同步联合诊断均可完全排除EV诊断,但患者比例约8%。
此外,SPT<37 mm+SPA<-0.68同步联合诊断及SPA≥2.52、SPT≥78 mm序贯诊断分别使6.4%、5.4%患者完全排除或确定HREV诊断。
3 讨论迄今,EV预测研究较多的指标是PSR[14-19]。初期研究发现有、无EV的肝硬化患者PLT、SPT、PSR和肝功能Child-Pugh等级等指标方面有统计学差异,PSR 909预测EV的NPV达100%,且在验证组及代偿性肝病患者中得到进一步的确认[15],并在该研究组的随访患者、多中心前瞻性研究及丙型肝炎患者中证实这一指标的可重复性[16-18],但其他作者证实该PSR 909诊断界值的NPV及PPV分别下降至73%、74%[19],在血吸虫性肝硬化患者EV测试中,PSR 909的NPV和PPV为83.1%和79.5%[20]。肝硬化患者不同的群体和不同的病因,是导致EV无创性指数的诊断效能不同的重要因素之一,
本研究结果提示PSR诊断EV价值与单一SPT无统计学差异。本研究组及其他多项研究也曾尝试将近年广泛应用于肝纤维化、肝硬化诊断的振动控制瞬时弹性成像技术(FibroScan®)应用于筛查EV,但受影响因素较多,诊断效能仍有待提高和进一步评价[21-23];门脉高压Baveno共识Ⅵ建议肝硬度<20 kPa且PLT>150×109/L患者并发HREV的风险是非常低的,可不必行内镜筛查[24],但其实际临床价值仍有待证实。进一步联合SPT、PLT和肝脏硬度指标,分析形成的综合指数应用于门脉高压EV的预测诊断研究仍在探索中[25-26]。此外,研究表明年龄>50岁、PLT<150×109/L、AST/ALT>1.0、ALB<36 g/L为EV独立影响因素,其评分AAAP=1的灵敏度100%,评分0可排除EV[13],本研究验证基本确认AAAP=0排除EV的诊断价值,但与本研究进一步发现的SPT联合PSR或USWA使约半数患者确定EV与否而免于胃镜检查相比,AAAP仅使2%患者确定EV,诊断效能低下。
本回顾性研究显示,在众多的血液、超声常规指标中,SPT诊断EV、HREV的效能高于其他指标,其确定肝硬化患者有或无EV的诊断能力与构建的基于SPT模型无差别(患者比例分别为46.6%、48%);此外,PLT、US及SVD也具有一定的确定EV的诊断效能。本研究筛选的EV、HREV相关性指标/指数应用于肝硬化患者EV诊断,自肝硬化致病机制方面分析具有合理性:排除血液系统疾病的脾脏肿大是肝硬化门脉高压的重要表现,SPT、US、SVD的增加表明肝脏形态学改变的严重程度,提示门脉高压进展,肝硬化患者PLT减少除炎症活动期与PLT生成素水平下降有关外,主要源于门脉高压造成的脾脏肿大和脾功能亢进。
与既往的肝硬化EV无创性诊断探索研究相比,本研究提出具有统计学确定或排除诊断能力的诊断界值,使被诊断肝硬化患者能在一定程度上明确确定或排除EV诊断,避免出现漏诊或误诊现象而影响肝硬化患者的预后甚至导致直接危及生命的情况发生,同时减少不必要的有创性内窥镜检查,减少不必要医疗资源浪费。基于EV、HREV漏诊造成预防措施的缺失可导致EVB发生,而误诊则因普萘洛尔等预防措施的不必要干预而影响患者生活质量。其次,为提高无创诊断的诊断能力,本研究尝试不同指标(指数)的联合应用以提高诊断效能,且诊断准确性不受影响。Jaeschke等[27]提出,在评价诊断试验性能时,诊断界值似然比对确定诊断结果很重要:PLR接近10或NLR接近0.1常常可结论性做出确定或排除诊断,而PLR 2~5或NLR 0.5~0.2确定或排除诊断的可能性小。本研究根据PLR10确定的EV、HREV诊断界值统计学上可确认EV、HREV诊断,因而在联合应用中采用序贯联合,而排除EV、HREV诊断的界值NLR均高于0.1,存在漏诊可能性相对较高,联合应用中采用同步联合以确保排除诊断准确性而避免漏诊现象。
总之,本回顾性研究初步揭示在乙型、丙型肝炎和酒精性肝病引起的肝硬化患者SPT及其他肝、胆囊、脾的超声检测参数,结合临床常规血液指标对EV具有良好的无创性诊断能力,以SPT为基础的EV相关指数的联合应用使半数肝硬化患者可以确定有或无EV而避免胃镜检查,SPT序贯联合PLT或USWA可使超过40%肝硬化患者明确EV而免于胃镜检查,但后者有待于临床实践中进一步扩大病例观察数量进行验证;而无创诊断技术在诊断HREV方面的效能仍需进一步探索以改善诊断效能。
致谢: 作者衷心感谢南方医院感染内科陈永鹏教授的指导。| [1] | Tsochatzis EA, Bosch J, Burroughs AK. Liver cirrhosis[J]. Lancet, 2014, 383: 1749-61. DOI: 10.1016/S0140-6736(14)60121-5. |
| [2] | 中华医学会肝病学分会、消化学分会、内镜学分会. 肝硬化门静脉高压食管胃静脉曲张出血的防治指南[J]. 临床肝胆病杂志, 2016, 32: 203-19. DOI: 10.3969/j.issn.1001-5256.2016.02.002. |
| [3] | Tripathi D, Stanley AJ, Hayes PC, et al. UK guidelines on the management of variceal haemorrhage in cirrhotic patients[J]. Gut, 2015, 64(11): 1680-704. DOI: 10.1136/gutjnl-2015-309262. |
| [4] | Carbonell N, Pauwels A, Serfaty L, et al. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades[J]. Hepatology, 2004, 40(3): 652-9. DOI: 10.1002/hep.20339. |
| [5] | Augustin S, Altamirano J, González A, et al. Effectiveness of combined pharmacologic and ligation therapy in high-risk patients with acute esophageal variceal bleeding[J]. Am J Gastroenterol, 2011, 106(10): 1787-95. DOI: 10.1038/ajg.2011.173. |
| [6] | Seo YS, Park SY, Kim MY, et al. Lack of difference among terlipressin, somatostatin, and octreotide in the control of acute gastroesophageal variceal hemorrhage[J]. Hepatology, 2014, 60(3): 954-63. DOI: 10.1002/hep.v60.3. |
| [7] | Garcia-Tsao G, Bosch J. Varices and variceal hemorrhage in cirrhosis:a new view of an old problem[J]. Clin Gastroenterol Hepatol, 2015, 13(12): 2109-17. DOI: 10.1016/j.cgh.2015.07.012. |
| [8] | NG PH, Wong HY, Loo CK, et al. Prediction of oesophagogastric varices in patients with liver cirrhosis[J]. J Gastroenterol Hepatol, 1999, 14: 785-90. DOI: 10.1046/j.1440-1746.1999.01949.x. |
| [9] | Pilette C, Oberti F, Aubé C, et al. Non-invasive diagnosis of esophageal varices in chronic liver diseases[J]. J Hepatol, 1999, 31(5): 867-73. DOI: 10.1016/S0168-8278(99)80288-8. |
| [10] | 卫晶丽, 姜珏, 周琦, 等. 肝硬化胃底静脉曲张的相关超声参数的分析[J]. 中国超声医学杂志, 2014, 30(8): 713-5. |
| [11] | Gao L, Meng F, Cheng J, et al. Prediction of oesophageal varices in patients with primary biliary cirrhosis by non-invasive markers[J]. Arch Med Sci, 2017, 13(2): 370-6. |
| [12] | 中华医学会消化内镜学分会食管胃静脉曲张学组. 消化道静脉曲张及出血的内镜诊断和治疗规范试行方案(2009年)[J]. 中国继续医学教育, 2010, 2(6): 21-6. |
| [13] | Gentile I, Viola C, Graf M, et al. A simple noninvasive score predicts gastroesophageal varices in patients with chronic viral hepatitis[J]. J Clin Gastroenterol, 2009, 43(1): 81-7. DOI: 10.1097/MCG.0b013e318157464b. |
| [14] | 屈淑平, 刘韵, 杨平华, 等. 血小板/脾双径评估乙型肝炎肝硬化肝癌患者食管静脉曲张的研究[J]. 肝脏, 2015(8): 597-601. |
| [15] | Giannini E, Botta F, Borro P, et al. Platelet count/spleen diameter ratio:proposal and validation of a non-invasive parameter to predict the presence of oesophageal varices in patients with liver cirrhosis[J]. Gut, 2003, 52(8): 1200-5. DOI: 10.1136/gut.52.8.1200. |
| [16] | Giannini EG, Botta F, Borro P, et al. Application of the platelet count/spleen diameter ratio to rule out the presence of oesophageal varices in patients with cirrhosis:a validation study based on follow-up[J]. Dig Liver Dis, 2005, 37(10): 779-85. DOI: 10.1016/j.dld.2005.05.007. |
| [17] | Giannini EG, Zaman A, Kreil A, et al. Platelet count/spleen diameter ratio for the noninvasive diagnosis of esophageal varices:results of a multicenter, prospective, validation study[J]. Am J Gastroenterol, 2006, 101(11): 2511-9. DOI: 10.1111/j.1572-0241.2006.00874.x. |
| [18] | Agha A, Anwar E, Bashir K, et al. External validation of the platelet count/spleen diameter ratio for the diagnosis of esophageal varices in hepatitis C virus-related cirrhosis[J]. Dig Dis Sci, 2009, 54(3): 654-60. DOI: 10.1007/s10620-008-0367-y. |
| [19] | Schwarzenberger E, Meyer T, Golla V, et al. Utilization of platelet count spleen diameter ratio in predicting the presence of esophageal varices in patients with cirrhosis[J]. J Clin Gastroenterol, 2010, 44(2): 146-50. DOI: 10.1097/MCG.0b013e3181a745ff. |
| [20] | Xu XD, Xu CF, Dai JJ, et al. Ratio of platelet count/spleen diameter predicted the presence of esophageal varices in patients with schistosomiasis liver cirrhosis[J]. Eur J Gastroenterol Hepatol, 2016, 28(5): 588-91. DOI: 10.1097/MEG.0000000000000584. |
| [21] | Shi KQ, Fan YC, Pan ZZ, et al. Transient elastography:a metaanalysis of diagnostic accuracy in evaluation of portal hypertension in chronic liver disease[J]. Liver Int, 2013, 33(1): 62-71. DOI: 10.1111/liv.2012.33.issue-1. |
| [22] | Chen YP, Zhang Q, Dai L, et al. Is transient elastography valuable for high-risk esophageal varices prediction in patients with hepatitisB-related cirrhosis?[J]. J Gastroenterol Hepatol, 2012, 27(3): 533-9. DOI: 10.1111/jgh.2012.27.issue-3. |
| [23] | 杨学平. 瞬时弹性成像检测肝脾硬度预测食管静脉曲张的价值[J]. 中国超声医学杂志, 2017, 33(2): 139-42. |
| [24] | De Franchis R, Baveno Ⅵ Faculty. Expanding consensus in portal hypertension:Report of the Baveno Ⅵ Consensus Workshop:Stratifying risk and individualizing care for portal hypertension[J]. J Hepatol, 2015, 63(3): 743-52. DOI: 10.1016/j.jhep.2015.05.022. |
| [25] | Berzigotti A, Seijo S, Arena U, et al. Elastography, spleen size, and platelet count identify portal hypertension in patients with compensated cirrhosis[J]. Gastroenterology, 2013, 144(1): 102-111. DOI: 10.1053/j.gastro.2012.10.001. |
| [26] | Abraldes JG, Bureau C, Stefanescu H, et al. Noninvasive tools and risk of clinically significant portal hypertension and varices in compensated cirrhosis:The "Anticipate" study[J]. Hepatology, 2016, 64(6): 2173-84. DOI: 10.1002/hep.v64.6. |
| [27] | Jaeschke R, Guyatt GH, Sackett DL, et al. Users' guides to the medical literature Ⅲ. how to use an article about a diagnostic test B. what are the results and will they help me in caring for my patients?[J]. JAMA, 271, 9: 703-7. |
 2017, Vol. 37
2017, Vol. 37

