2. 南方医科大学病理生理学教研室, 广东 广州 510515;
3. 南方医科大学第三附属医院 检验科, 广东 广州 510630
2. Department of Clinical Laboratory, Third Affiliated Hospital, Southern Medical University, Guangzhou 510630, China;
3. Department of Pathophysiology, Southern Medical University, Guangzhou 510515, China
冠心病已经成为威胁全人类的第1大死亡病因[1]。研究表明,约半数以上的冠心病患者出现心绞痛(AP)的临床症状[2]。研究显示SAP病人平均年死亡率仅为2% ~3%[3],在临床上并未引起足够的重视。然而,有些SAP患者也同样会进展为急性冠脉综合征,危害性更加严重。目前,对于SAP的临床诊断除了患者的主观症状描述外[4],采用的方法主要是:心电图、心电图负荷试验、冠状动脉造影、二维超声心动图和CT冠状动脉成像术等,其中冠脉血管造影是诊断冠状动脉病变严重程度的有效手段,但是具有创伤性。因此,探讨用于SAP早期筛查、鉴别诊断及预后判断的特异性生物标记物,将是一种更加便捷的途径。
早前诸多学者进行动物实验证实了正常动物与冠心病模型动物之间存在差异蛋白的表达[5-6]。在冠心病心绞痛发病的病理状态下,人体的组织或细胞会分泌一些特异性蛋白进入血液,导致血浆蛋白在结构和数量上的改变,这些蛋白信号或许可以作为对疾病进行早期诊断生物标记物[7-8]。相比于UAP,SAP的病理生理过程更为稳定,其血浆蛋白成分检测更具有可重复性。目前SAP相关的血浆生物标记物方面的研究在国内外尚未见报道,对SAP患者进行血浆/血清蛋白质组学研究将为筛查相关的生物标记物奠定基础。
本研究采用双向凝胶电泳技术分离SAP患者及健康对照组血浆蛋白质组,分析比较两组间的差异蛋白质之后,对这些差异蛋白进行基质辅助激光解析电离-飞行时间/飞行时间质谱鉴定,选取可疑的蛋白进行酶联免疫吸附试验验证,为进一步筛选SAP特异性血浆生物标记物提供实验依据。
1 资料和方法 1.1 实验材料稳定型心绞痛患者血浆由南方医科大学第三附属医院心血管内科提供,健康对照组血浆由南方医科大学第三附属医院健康管理科提供,所有实验标本来源的病人均签署了知情同意书。甲叉双丙烯酰胺、丙烯酰胺、尿素、硫脲、甘氨酸、溴酚蓝、N-三羟基氨甲烷、CHAPS、苯甲基磺酰氟、十二烷基磺酸钠、二硫苏糖醇、碘乙酰胺、考马斯亮蓝G-250、三氟乙酸、质谱级α-氰基-4-羟基苯丙烯酸和ProteoPrep Blue Albumin and IgG Depletion Kit均购自Sigma公司;2-D clean up kit除盐试剂盒、2-D Quant kit蛋白浓度检测试剂盒、固相化24 cm干胶条(pH 3-10,NL)及其它双向电泳试剂均购自GE公司。质谱级胰蛋白酶(Promega)、色谱级乙腈(Thermo Fisher Scientific)、人血红蛋白δ亚基ELISA试剂盒(CUSABIO);其他试剂为国产分析纯;实验用水为ELGA Utrapure water系统制备的18.2 MΩ的超纯级水。IPGphor等电聚焦仪、DALT Six电泳仪、Image scanner Ⅲ光密度成像系统和Spot Picker自动切胶系统均购自GE公司,真空干燥仪购自Chaist公司,ABI 4800基质辅助激光解吸飞行时间质谱仪购自Appied Biosystem公司。
1.2 实验方法 1.2.1 样品处理前加了一段样品的分组采集南方医科大学第三附属医院SAP血浆标本60例,另收集体检科收集的血浆标本作为正常对照组(n=60)。随机取SAP患者组与健康对照组空腹血浆标本各20例(各100 mL),分别等量混合成2组样本,去除血浆高丰度蛋白后,利用双向凝胶电泳技术进行蛋白分离,经差异软件分析后,挖取变化2倍以上的差异蛋白质点,利用基质辅助激光解析电离-飞行时间/飞行时间质谱对差异蛋白点进行鉴定。每组随机各取40例样本,选取差异蛋白血红蛋白δ亚基进行酶联免疫吸附实验验证。
1.2.2 血浆样品的预处理首先利用ProteoPrep Blue Albumin and IgG Depletion Kit、去除血浆样品中的白蛋白和免疫球蛋白等高丰度蛋白(实验步骤按照试剂盒操作说明书)。然后,利用2-D Clean-up Kit除去盐、脂肪、多糖等干扰双向电泳的物质(实验步骤按照试剂盒操作说明书)。接着,用2-D Quant Kit进行蛋白浓度测定(实验步骤按照试剂盒操作说明书),分装后冻存于-80 ℃冰箱待用。
1.2.3 双向凝胶电泳取400 μg蛋白样品与水化液混合,总体积共450 μL上样到24 cm IPG胶条(pH 3-10,NL)上,然后,将胶条槽置于EttanTM IPGPhor进行第一向等电聚焦电泳,在20 ℃条件下按以下设定程序进行:30 V,12 h;100 V,1 h;1000 V,gradient 1 h;8000 V,gradient 2 h;8000 V,50 000 Vh;500 V,Hold。等电聚焦结束后,取出IPG胶条,在进行第二向电泳SDS PAGE前,对IPG胶条依次用二硫苏糖醇SDS平衡液(DTT 10 g/L)和碘乙酰胺SDS平衡液(碘乙酰胺30 g/L)进行平衡,每次各15 min。用EttanTM DALT Six电泳仪进行第二向电泳,将平衡好的IPG胶条放置于12.5%的聚丙稀酰胺胶的上端,用低熔点琼脂糖进行封胶。设置恒定功率,每张胶3 W,电泳45 min,然后,恒定功率每张胶17 W进行电泳,直至溴酚蓝移至凝胶的底部时停止电泳。接着,采用胶体考马斯亮蓝染色法进行凝胶染色。
1.2.4 胶图扫描及图像分析考马斯亮蓝染色后的凝胶用Image Scanner的LabScan软件以数字模式进行透射扫描,胶图数据存储后,采用Image master 2D Platinum 6.0软件进行凝胶的蛋白点检测及匹配,配合三维图象及人工校对等方法,以保证点检测及匹配的准确性。
1.2.5 蛋白胶内酶解及质谱鉴定用Spot Picker自动切胶系统将差异蛋白斑点从胶上切下,置于EP管中。用100 μL 30% ACN/100 mmol/L NH4HCO3脱色5 min,反复3次,直至将颜色脱尽。去上清,每管加100 μL 100% ACN,5 min后吸去。室温开盖放置约5 min,待乙腈挥发完全后加入2 μL胰蛋白酶(Trypsin)(12.5 ng/μL),然后将EP管置于4 ℃冰箱30 min,使胶粒充分吸胀,吸去多余的胰酶。加入30 μL的50 mM NH4HCO3,37 ℃水浴(14~16 h)。吸出胰酶酶解液,转移至新的EP管中,原管加入100 μL 60% ACN/0.1% TFA,超声15 min,吸出管内溶液,加入到前次吸出的胰酶酶解液中,重复3次,将全部吸出的液体(合并包括胰酶酶解液和超声萃取后的溶液),冷冻干燥后,取1 μL含5 mg/mLCHCA的基质和样品蛋白混合,并直接点样到清洁干燥的MALDI样品靶上。晾干形成结晶后,将样品送入MALDI-TOF/ TOF质谱仪中,经内标校正后,进行激光轰击,以获取肽指纹图谱(PMF),最后,使用Mascot软件对蛋白的PMF做数据库检索比对,采用MS/MS二级质谱模式搜索数据库Swissprot,种属数据库为人类数据库。
1.2.6 ELISA验证随机抽取40例SAP患者血浆(男性20例,女性20例)及40例健康对照组血浆(男性20例,女性20例),进行ELISA验证试验,实验步骤按照操作说明书,具体步骤如下:空白孔加样品稀释液100 μL,余孔分别加标准品或待测样品100 μL,室温下摇床上孵育2.5 h;弃去液体并甩干,用超纯水清洗板子四次,每次尽量甩干;每孔加入100 μL带生物素标签的HBD一抗工作液(100倍稀释),室温下摇床上孵育1 h;弃去液体,用超纯水清洗板子4次并甩干;加入100 μL链亲和素-辣根过氧化物酶耦合的缓冲液,室温下摇床上孵育45 min;弃去液体,用超纯水清洗板子4次并甩干;加入100 μL TMB底物,室温下摇床上避光孵育30 min;依序每孔加50 μL终止溶液,终止反应;加终止液后30 min内,设置多光谱微孔板阅读器为450 nm波长,依序测量各孔的光密度(OD值);最后,对实验数据进行统计并作图。
1.2.7 统计学分析使用统计软件SPSS 17.0,统计方法为两独立样本均数t检验,方差齐性检验用Levene检验,取α=0.05为检验标准。所有计量资料用均数±标准差(x±SE)来反映样本均数的离散趋势。
2 结果 2.1 SAP患者与健康对照血浆蛋白质双向电泳图谱在相同条件下,对蛋白质样品进行3次双向电泳,利用Image Master 2D Platinum 6.0软件进行图像的灰度校正、蛋白点检测和匹配等分析,比较后发现,健康组血浆和SAP组血浆平均蛋白质点数分别为1426±65和1512±52;并且以等电点4到9,相对分子质量40 000~ 90 000之间的蛋白斑点分布最多。根据蛋白质点表达量与所有匹配蛋白质点表达量总和的比值大于1.5,且同组3块胶图谱中都出现相同变化的蛋白点,被视为是差异蛋白质点,共检测出8个差异蛋白质点,表达上调和下调的各4个。具体双向电泳图谱及差异蛋白点的位置见图 1。
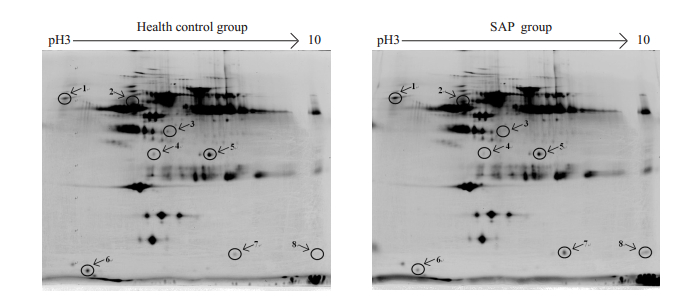
|
图 1 稳定型心绞痛患者和健康对照血浆蛋白质的双向电泳图谱 Figure 1 2DE profiles of plasma proteome of SAP patients and healthy individuals. |
对8个差异蛋白点进行胶内酶解后,经过MALDI TOF/TOF质谱分析,大多数肽质量指纹图谱背景低,峰信号强。通过Mascot软件检索SwissProt数据库鉴定蛋白质,去除鉴定结果相同的蛋白点,共鉴定出7种蛋白质,离子评分可信度均为100%,鉴定结果高度可信。具体蛋白质搜库鉴定结果见表 1。表达上调的蛋白包括血清白蛋白、血红蛋白α亚基和血红蛋白δ亚基(HBD),表达下调的蛋白包括载脂蛋白L1、载脂蛋白C3、载脂蛋白E和补体C4-B。图 2展示的是HBD的PMF图谱。
| 表 1 差异蛋白点的质谱鉴定结果 Table 1 Mass spectrometry results of differentially expressed proteins |
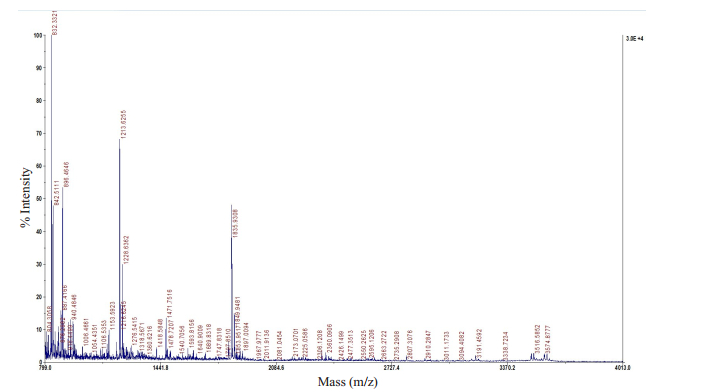
|
图 2 HBD的PMF图谱 Figure 2 Peptide mass fingerprinting of the protein spot of HBD. |
ELISA实验结果经过统计学软件分析后,健康对照组血浆HBD蛋白浓度约为146.7±11.1 ng/mL,但是在SAP组浓度约491.2±20.2 ng/mL,二者有统计学差异(P<0.05)。实验结果表明,HBD在SAP患者组血浆中上调大约3.4倍,与蛋白质组学的实验结果相一致。
3 讨论第1个关于人类冠状动脉的蛋白质组学研究极为简单,利用健康和疾病的冠状动脉进行2DE,并对胶银染,在冠状动脉中发现铁蛋白轻链增加[9];目前国外已经初步阐明急性冠脉综合征的蛋白表达谱[10-13]。国内早期有关冠心病不稳定型心绞痛及心肌梗死的血浆蛋白质组学研究已经有不少相关报道,如类胰蛋白酶和C反应蛋白等[14-15],但是均缺乏特异性。然而,对SAP的血浆蛋白质组学却鲜有报道,SAP的血浆差异蛋白谱也同样具有重要的临床意义。
本研究通过双向电泳联合质谱技术,对SAP患者及健康对照组的血浆差异蛋白质组进行研究,得到了分辨率高及重复性好的双向电泳图谱,经过比较分析及质谱鉴定,最终鉴定出8个差异蛋白点,去除结果相同的蛋白,共包含3种表达上调的蛋白及4种表达下调的蛋白。表达上调的蛋白是血清白蛋白、血红蛋白亚基α和血红蛋白亚基δ;表达下调的蛋白有载脂蛋白C3、载脂蛋白E、载脂蛋白L1和补体C4-B。这些差异蛋白均有可能成为潜在的稳定型心绞痛的血浆生物标记物,将有助于对SAP进行早期筛选及诊断。依据这7种差异蛋白的功能进行分类,可以概述成三大类蛋白,分别是急性时相反应蛋白类、载脂蛋白类和血红蛋白亚基类。
急性时相反应蛋白,可用来鉴别急性、亚急性和慢性病理状态,一定程度上可以反映病理损伤的性质、程度和范围。APR可分为正时相反应蛋白和负时相反应蛋白。C-反应球蛋白、α-1抗胰蛋白酶、α-1酸性糖蛋白、血浆铜蓝蛋白、结合珠蛋白、补体C3、补体C4和纤维蛋白原等正时相反应蛋白,其血浆浓度在炎症、创伤、心肌梗死、感染及肿瘤等急性反应期显著升高;然而,也存在另外一类负相反应蛋白,例如,转甲状腺素蛋白、白蛋白及转铁蛋白等,在急性反应期则出现显著降低[16]。本实验差异蛋白中,血清白蛋白和补体C4-B属于APR。在SAP病人组,血清白蛋白表达上调,补体C4-B表达下调。而这两种蛋白与急性时相反应蛋白的表达趋势是相反的。由此推测,SAP属于冠心病的慢性进展期,这两种急性时相蛋白相反的变化趋势也可能是其慢性病理状况的反映。因此,血清白蛋白的上调联合补体C4-B下调有可能会成为诊断SAP的生物标记物。
载脂蛋白的基本功能是运载脂类物质及稳定脂蛋白的结构,某些载脂蛋白具有激活脂蛋白代谢酶或者识别受体等功能[17]。本实验结果表明,与健康对照组相比,SAP组患者血浆中载脂蛋白C3(ApoC3)、载脂蛋白E(ApoE)和载脂蛋白L1(ApoL1)均发生明显下调。ApoC3是一种脂蛋白脂肪酶(LPL)抑制剂,血浆中高表达APOC3除了可引起脂类代谢紊乱,近年来还作为一个独立的促炎角色被重新认识,它不仅是冠心病的独立风险因子,而且与2型糖尿病、高血压、肥胖的发病风险密切相关[18]。而在SAP患者血浆中ApoC3下降,可能在血脂的代谢平衡中起到一种代偿作用。ApoE和ApoL1在高密度脂蛋白发挥胆固醇逆向转运过程中发挥重要功能,这些蛋白的功能变化或者下调,是加重心血管疾病的危险因素[19-20]。由此推测,ApoE和ApoL1,这两种载脂蛋白的下调,能够加重冠心病SAP的疾病进展,有望成为SAP筛查的分子标记物,并且对揭示SAP的发病分子机制提供了新思路。
血红蛋白α亚基(HBA)和血红蛋白δ亚基(HBD)属于血红蛋白亚基家族,成人98%的血红蛋白为血红蛋白A(HbA),基本组成为α2β2;另外2%的血红蛋白为血红蛋白A2(HbA2),基本组成为α2δ2。有研究发现HBA除了具有携氧功能外,还存在于血管壁内皮细胞,通过调节一氧化氮信号通路来调节血压[21]。HBD的检测可以作为诊断地中海贫血的一个重要指标[22]。本研究中发现HBA和HBD在SAP患者组明显上调。同时,本实验利用ELISA对HBD在血浆中的表达量进行了验证实验,发现HBD在SAP组的表达量明显升高。然而,HBD蛋白发挥何种生物学功能,HBD能否成为SAP筛查及鉴别诊断的候选生物标记物,尚需要更大规模的实验验证来确认。
总之,本研究从一个全新的角度来研究SAP血浆差异蛋白的重要性,通过对SAP患者与健康对照组血浆差异蛋白质组进行2DE分离和质谱鉴定,找到7种与SAP相关的血浆差异蛋白质,显示HBD有可能成为SAP的筛查、鉴别诊断及预后判断的血浆生物标记物,并且对加深SAP发病分子机制的认识提供了新的实验数据。
| [1] | Ohman EM. Clinical practice[J]. N Engl J Med, 2016, 374(12): 1167-76. DOI: 10.1056/NEJMcp1502240. |
| [2] | Bhatt Dl EK, Ohman Em EA. Comparative determinants of 4-year cardiovascular event rates in stable outpatients at risk of or with atherothrombosis[J]. JAMA, 2010, 304(12): 1350-7. DOI: 10.1001/jama.2010.1322. |
| [3] | 高润霖. 遵循指南规范慢性稳定性心绞痛的诊断和治疗[J]. 中华心血管病杂志, 2007, 35(3): 193-4. |
| [4] | Task Force M, Montalescot G, Sechtem U, et al. 2013 ESC guidelines on the management of stable coronary artery disease:the Task Force on the management of stable coronary artery disease of the European Society of Cardiology[J]. Eur Heart J, 2013, 34(38): 2949-3003. DOI: 10.1093/eurheartj/eht296. |
| [5] | 刘蕾, 王伟, 宋剑南. 心肌缺血小型猪模型差异蛋白质组学研究[J]. 南京医科大学学报:自然科学版, 2009, 29(4): 459-63. |
| [6] | De CT, Vanrobaeys F, Lijnen P, et al. Alterations in mouse cardiac proteome after in vivo myocardial infarction:permanent ischaemia versus ischaemia-reperfusion[J]. Exp Physiol, 2005, 90(4): 593-606. DOI: 10.1113/expphysiol.2005.030296. |
| [7] | Anderson NL, Anderson NG. The human plasma proteome:history, character, and diagnostic prospects[J]. Mol Cell Proteomics, 2002, 1(11): 845-67. DOI: 10.1074/mcp.R200007-MCP200. |
| [8] | Barallobre-Barreiro J, Chunq YL, Mayr M. Proteomics and metabolomics for mechanistic insights and biomarker discovery in cardiovascular disease[J]. Rev Esp Cardiol, 2013, 66(8): 657-61. DOI: 10.1016/j.recesp.2013.04.010. |
| [9] | You S, Archacki SR, Angheloiu G, et al. Proteomic approach to coronary atherosclerosis shows ferritin light chain as a significant marker:evidence consistent with Iron hypothesis in atherosclerosis[J]. Physiol Genomics, 2003, 13(1): 25-30. DOI: 10.1152/physiolgenomics.00124.2002. |
| [10] | Kakimoto Y, Ito S, Abiru H, et al. Sorbin and SH3 DomainContaining protein 2 is released from infarcted heart in the very early phase:proteomic analysis of cardiac tissues from patients[J]. J Am Heart Assoc, 2013, 2(6): e000565. DOI: 10.1161/JAHA.113.000565. |
| [11] | Barderas MG, Tunon J, Darde VM, et al. Circulating human monocytes in the acute coronary syndrome Express a characteristic proteomic profile[J]. J Proteome Res, 2007, 6(2): 876-86. DOI: 10.1021/pr0601990. |
| [12] | Parguina AF, Grigorian-Shamajian L, Agra RM, et al. Proteins involved in platelet signaling are differentially regulated in acute coronary syndrome:a proteomic study[J]. PLoS One, 2010, 5(10): e13404. DOI: 10.1371/journal.pone.0013404. |
| [13] | Erogbogbo F, May J, Swihart M, et al. Bioengineering Silicon quantum dot theranostics using a network analysis of metabolomic and proteomic data in cardiac ischemia[J]. Theranostics, 2013, 3(9): 719-28. DOI: 10.7150/thno.5010. |
| [14] | Xiang MX, Sun JS, Lin Y, et al. Usefulness of serum tryptase level as an Independent biomarker for coronary plaque instability in a Chinese population[J]. Atherosclerosis, 2011, 215(2): 494-9. DOI: 10.1016/j.atherosclerosis.2011.01.006. |
| [15] | Soysal D, Karakus V, Yavas HH, et al. C-reactive protein in unstable angina pectoris and its relation to coronary angiographic severity and diffusion scores of coronary lesions[J]. Anadolu Kardiyol Derg, 2010, 10: 421-428. DOI: 10.5152/akd.. |
| [16] | Ahmed MS, Jadhav AB, Hassan A, et al. Acute phase reactants as novel predictors of cardiovascular disease[J]. ISRN In Flamm, 2012, 2012: 953461. |
| [17] | Dahlback B, Nielsen LB. Apolipoprotein M-a novel player in highdensity lipoprotein metabolism and atherosclerosis[J]. Curr Opin Lipidol, 2006, 17(3): 291-5. DOI: 10.1097/01.mol.0000226122.10005.88. |
| [18] | Tsai MY, Ordovas JM. APOC3 mutation, serum triglyceride concentrations, and coronary heart disease[J]. Clin Chem, 2009, 55(7): 1274-6. DOI: 10.1373/clinchem.2009.124669. |
| [19] | White CR, Garber DW, Anantharamaiah GM. Anti-inflammatory and cholesterol-reducing properties of apolipoprotein mimetics:a review[J]. J Lipid Res, 2014, 55(10): 2007-21. DOI: 10.1194/jlr.R051367. |
| [20] | Ito K BA, Flannick EA. Increased burden of cardiovascular disease in carriers of APOL1 genetic variants[J]. Circ Res, 2014, 114(5): 845-50. DOI: 10.1161/CIRCRESAHA.114.302347. |
| [21] | Butcher JT, Johnson T, Beers J, et al. Hemoglobin alpha in the blood vessel wall[J]. Free Radic Biol Med, 2014, 73: 136-42. DOI: 10.1016/j.freeradbiomed.2014.04.019. |
| [22] | Figueiredo MS. The importance of hemoglobin A2 determination[J]. Rev Bras Hematol Hemoter, 2015, 37(5): 287-9. DOI: 10.1016/j.bjhh.2015.06.002. |
 2017, Vol. 37
2017, Vol. 37

