术后慢性疼痛作为外科手术的不良结果之一,不仅有极高的发生率同时还严重影响了患者的情绪与日常生活[1]。自1988年[2]被首次报道以来,术后慢性疼痛逐渐被人们所了解。其中神经损伤率较高的手术如开胸手术,慢性手术后疼痛的发生率更可高达10%~50%,其中2%~10%为重度疼痛[3]。
但是目前有关手术后慢性疼痛潜在机制的研究甚少[3-8]。最初,这种疼痛被认为是神经性的[9],通过使用Pain-Detect问卷对204名开胸术后患者进行电话随访发现,仅50%的手术后慢性疼痛与慢性神经病理性疼痛类似[10]。在前期研究中,我们通过给大鼠施行胸廓切开术模拟慢性手术后疼痛,并提取脊髓背角组织行慢性术后疼痛的差异蛋白质组学分析[11]。在慢性疼痛组与非慢性疼痛组间,我们发现了多达58种差异蛋白[12],其中谷氨酰胺酶Ⅰ和RhoA都有明显上调。那么在谷氨酰胺酶Ⅰ和RhoA的表达之间,是否有潜在的联系?目前,在慢性疼痛中探讨RhoA和谷氨酰胺酶I的关系尚未见报道。因此,我们假设RhoA可能通过上调谷氨酰胺酶Ⅰ影响大鼠开胸术后慢性疼痛的发生发展。为了验证这个假设,我们将探讨谷氨酰胺酶Ⅰ和RhoA表达对手术后慢性疼痛的因果关系,并使用RhoA抑制剂—法舒地尔来验证我们的猜测。
1 材料和方法 1.1 实验动物55只SD大鼠,雄性,体质量250~350 g由南方医科大学实验动物中心提供。所有饲养及实验皆依照《南方医科大学实验动物管理办法(试行)》以及《南方医科大学动物实伦理审查指南(试行)》原则进行。
1.2 动物分组第1部分:25只SD大鼠动物分为模型组与对照组,模型组(n=20)行右侧开胸手术,对照组(术前0 d,n=5)用来做术前1天各项相关指标的分析[13]。术后,模型组通过行为学结果再分为术后慢性疼痛组及术后非慢性疼痛组并在术后的第10天与第21天处死进行下一步研究[14]。在整个实验中,若术后某个时点大鼠的机械痛域≥术前机械痛域的20%水平并持续至术后第21天则认为该动物存在术后慢性疼痛[15]。
第2部分:30只雄性SD大鼠随机分为两组:法舒地尔组和非处理组(n=15)。开胸后,法舒地尔组大鼠在切口皮肤缝合后立即经腹腔注射盐酸法舒地尔(天津红日药业有限公司,2 mL:30 mg,10 mg/kg,1/d,7 d),非处理组给予等量的生理盐水。在大鼠术后当天至术后第1、7、10、21天测量每组大鼠的机械缩足反射阈值(机械痛域)和冷刺激诱发痛。术后第21天处死大鼠,取胸段第3至第5段脊髓进行下一步实验。
1.3 主要试剂及耗材聚偏二氟乙烯膜(GE Healthcare, USA)、鲁米那(GE Healthcare, USA)、盐酸法舒地尔(天津红日药业有限公司)、抗谷氨酰胺酶Ⅰ单克隆抗体(1:200,武汉博士德生物科技有限公司)、RhoA兔多克隆抗体(1:100武汉博士德生物科技有限公司)、Tizol、逆转录试剂盒及Real-time PCR检测试剂(美国,Invitrogen),PCR引物由苏州泽科生物科技有限公司合成,RIPA裂解液(广州拓科达生物科技有限公司)。
1.4 动物模型参考Buvanendran[16]法建立开胸术后慢性疼痛动物模型。麻醉后,对大鼠行经口气管插管并连接小动物呼吸机以行机械通气。于右侧T4和T5肋间隙行3 cm长切口,并在第5肋上方的肋间肌和胸膜上做一个长1.5 cm的切口。采用显微牵开器将第4和第5肋骨牵开8 mm。60 min后取出牵开器,缝合表层肌肉和皮肤。术毕大鼠恢复自主呼吸后拔出气管插管。
1.5 行为学测试开胸后,监测大鼠的日常活动、进食、饮水情况及切口的恢复情况。疼痛行为学包括测量大鼠术后当天至术后21 d(1、7、10、21 d)的机械缩足反射阈值(MWT)和冷丙酮诱发痛,通常在上午9时至12时进行[12]。提取脊髓背根神经节蛋白取胸3~5段脊髓,分离右侧背根组织冻存于-80 ℃,24 h。取出脊髓背角组织加入细胞裂解液(50 mmoL Tris(pH 7.4),150 mmoL氯化钠,1%曲拉通,1%脱氧胆酸钠,0.1% SDS,1 mmoL原钒酸钠,1 mmoL氟化钠,1 mmoL EDTA and 1 mmoL蛋白酶抑制剂)后行超声震荡裂解。样本中的谷氨酰胺酶Ⅰ和RhoA表达量用RT-PCR及蛋白免疫印迹法检测。
1.6 蛋白免疫印迹法检测谷氨酰胺酶Ⅰ的表达将等量的样品(15 μg)用12.5%的凝胶蛋白进行分离,转移到聚偏二氟乙烯膜(GE Healthcare, USA)上。用抗谷氨酰胺酶Ⅰ单克隆抗体(1:200,武汉博士德生物科技有限公司)和抗单克隆抗体(1:500)4 ℃孵育15 min,再用羊抗鼠二抗(1:2000)室温孵育45 min。之后,运用化学底物发光试剂鲁米那(GE Healthcare, USA)及拍摄X射线胶片检测标记蛋白条带,通过ImageJ software version 1.46(http://rsb.info.nih.gov/ij/)进行条带光密度扫描和分析。
1.7 蛋白免疫印迹法检测RhoA的表达将脊髓样本(0.5 mg)溶解提取总蛋白,测量蛋白浓度,蛋白变性,聚丙烯酰胺凝胶蛋白分离,转膜。加入RhoA兔多克隆抗体(1:100武汉博士德生物科技有限公司)4 ℃孵育15 min,再用辣根过氧化物酶羊抗兔二抗(1:2000)37 ℃摇床孵育45 min。条带运用Gel pro 4.0 software(Media Cybernetics, Bethesda, MD, USA)进行分析光吸收度测量和定量。
1.8 RT-PCR检测RhoA的mRNA的表达实时定量聚合酶链式反应(RT-PCR)结果源自CFX96 Touch PCR检测系统(Bio-Rad Laboratories, CA, USA)。提取脊髓背根神经节总RNA建立20 μL PCR混合反应体系,β-actin作为内参。RhoA的上下游引物(苏州泽科生物科技有限公司)分别是5-ATGAT GAGCACACAAGGCGGGA-3'和5-AAAGCGCCAA TCCTGTTTGCCA-3',PCR扩增产物94 bp。PCR反应步骤:95 ℃变性3 min;95 ℃变性12 s;62 ℃退火30 s;72 ℃延长30 s,反应共40个循环。运用2-△△CT分析方法分析相对表达量水平。
1.9 研究Rho蛋白激酶抑制剂法舒地尔对谷氨酰胺酶Ⅰ表达的影响法舒地尔作为Rho蛋白激酶抑制剂,主要作用是抑制Rho蛋白激酶对Rho/ROCK受体的激活。在此研究中,我们运用Rho蛋白激酶抑制剂法舒地尔来研究Rho蛋白激酶与谷氨酰胺酶Ⅰ的相互关系。
1.10 统计学方法运用SPSS19.0软件进行数据处理分析,各数值采用平均数±标准差表示。单因素的组间比较采用单因素方差分析,两两比较采用t检验,重复测量资料采用重复测量的方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 行为学测量结果及再分组模型组随机分为两组(n=10):10 d组和21 d组,大鼠分别在第10天及第21天被处死。根据大鼠的机械痛域,再进一步分为术后慢性疼痛组和术后非慢性疼痛组,同时通过蛋白免疫组化及RT-PCR。检测谷氨酰胺酶Ⅰ和RhoA的表达水平。结果显示,术后第10天及第21天疼痛阈值(MWT)分别下降了46.28±18.65(n=5)和44.45±10.32(n=4)。此外,与术后非慢性疼痛组相比,在术后的7~21 d术后慢性疼痛组显示出来对丙酮诱发反应的显著提高(P<0.01,表 1,2)。
| 表 1 10 d组的大鼠体质量,机械痛及冷丙酮试验结果 Table 1 Changes in body weight, mechanical withdrawal threshold (MWT) and cold acetone stimulus (CAS) pain threshold in rats with or without chronic post-surgical pain (SPSP) within 10 days following thoracotomy (Mean±SD) |
| 表 2 d组的大鼠体质量,机械痛及冷丙酮试验结果 Table 2 Changes in body weight, MWT threshold and CAS pain threshold in the rats within day 21 following thoracotomy (Mean±SD) |
通过以上数据可以发现以上两组在术后第1天机械缩足反射阈值显著降低,2 d后,每组的机械痛阈逐渐增加并在第7天再次降低。开胸术后发生慢性疼痛大鼠的机械痛阈从术后第10天持续降到到第21天。因此我们选择检测第10天和第21天的RhoA的表达量(图 1)。
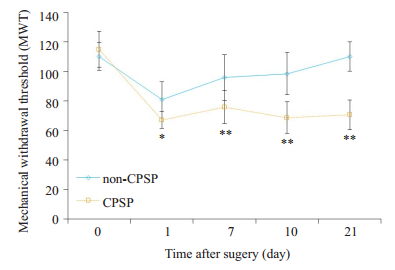
|
图 1 术后21 d内各组机械痛阈值的比较 Figure 1 Dynamic changes of MWT in day 21 group. *P < 0.05, **P < 0.01 vs non-CPSP group |
与术后非慢性疼痛组相比,术后慢性疼痛组的谷氨酰胺酶Ⅰ的表达量在术后的第10天和第21天有显著的上调(P<0.01)。然而,处理组在术后当天与术后非慢性疼痛组的谷氨酰胺酶Ⅰ在术后的第10天和第21天表达量没有统计学差异。此外,术后慢性疼痛组的谷氨酰胺酶Ⅰ的表达量在术后的第21天显著高于第10天(P<0.01)。这表示谷氨酰胺酶Ⅰ的表达量是逐渐上升的(图 2)。
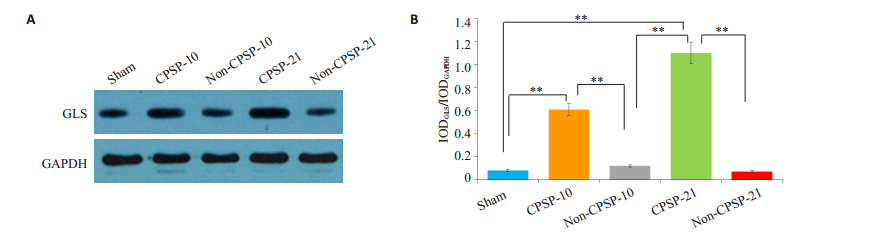
|
图 2 各组大鼠谷氨酰胺酶Ⅰ蛋白表达水平 Figure 2 Expression of GLS1 by Western blotting. The expression of GLS1 increased more obviously in CPSP groups than in day 0 and non-CPSP group (n=5, **P < 0.01). |
通过蛋白免疫印迹法检测两组各个时间点中RhoA的表达。与术后非慢性疼痛组相比,术后慢性疼痛组的RhoA的表达量在术后的第10天和第21天有显著增加(P<0.01)。此外,术后慢性疼痛组的RhoA的表达量在术后的第21天显著高于第10天(P<0.01)。这表示RhoA的表达量是逐渐上升的(图 3)。
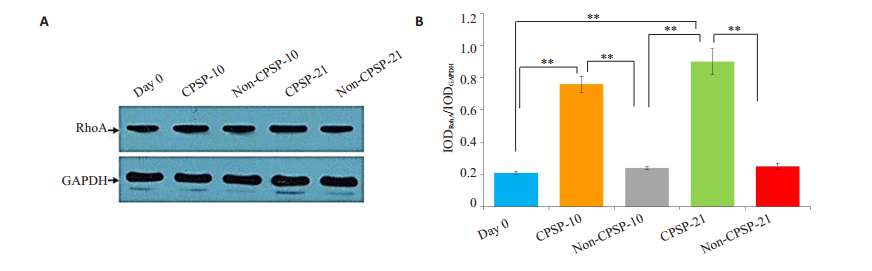
|
图 3 各组大鼠RhoA蛋白表达水平 Figure 3 Expression of RhoA detected by Western blotting. The expression of RhoA increased more obviously in CPSP groups than in day 0 and non-CPSP groups (n=5, **P < 0.01). |
经过RT-PCR检测后发现,在术后第10和第21天,术后慢性疼痛组的RhoA mRNA的表达量要明显高于术后非慢性疼痛组(P<0.05,图 4)。
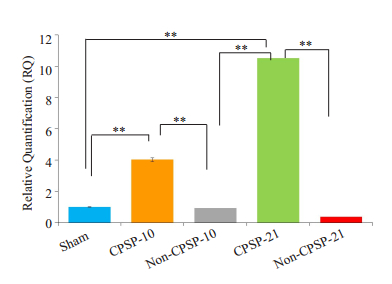
|
图 4 各组大鼠的RhoA mRNA的表达水平 Figure 4 Expression of RhoA mRNA detected by RT-PCR. The expression of RhoA mRNA increased more obviously in CPSP groups than in day 0 and non-CPSP groups (n=5, **P < 0.01). |
术后21 d内,非处理组的机械痛阈值比法舒地尔组显著降低(P<0.05)。同时在术后的7~21 d,与法舒地尔组相比,非处理组对冷丙酮诱发反应性明显增高(P<0.01)。蛋白免疫印迹法检测出在术后21 d,谷氨酰胺酶Ⅰ与RhoA在非处理组的表达量要远远高于法舒地尔组(P<0.01)。RT-PCR检测发现,术后的第21天,法舒地尔组中RhoA mRNA的表达量要明显高于非处理组(P<0.01,表 3)。
| 表 3 术后21 d法舒地尔对谷氨酰胺酶Ⅰ及RhoA表达的结果 Table 3 Comparison of behavioral changes and expressions of GLS1 and RhoA mRNA between fasudil-and saline-treated groups on day 21 after surgery |
在前期研究中,我们对出现和未出现手术后慢性疼痛大鼠之间脊髓背角组织蛋白表达水平进行了比较和鉴定,发现RhoA与谷氨酰胺酶Ⅰ的上调水平明显并呈现正相关趋势。为了进一步验证,我们进行了本次的实验,发现了以下结果:大鼠在实施开胸术后,慢性疼痛的发生率是符合之前的调查结果的;RhoA与谷氨酰胺酶Ⅰ在术后慢性疼痛组的蛋白表达均高于术后非慢性疼痛组;在使用RhoA蛋白激酶抑制剂法舒地尔后,大鼠的机械痛阈值、RhoA及谷氨酰胺酶Ⅰ的蛋白表达都比非处理组有所降低。这提示RhoA与谷氨酰胺酶Ⅰ的上调在术后慢性疼痛的发生中发挥了很大作用。潜在的机制也许与脊髓背角中RhoA对谷氨酰胺酶Ⅰ的上调有关。综上所述我们首次发现了谷氨酰胺酶Ⅰ与RhoA在慢性疼痛模型中的相互关系,但未来我们仍需进一步的研究RhoA是以何种机制调节谷氨酰胺酶Ⅰ的表达的。
RhoA作为一种小分子G蛋白,其效应底物Rho激酶(ROCK)是一种丝氨酸/苏氨酸激酶,参与了[18]细胞有丝分裂、细胞骨架、细胞趋化和黏附等多种生理过程的形成。炎性疼痛模型中,RhoA/Rho激酶途径的抑制可以预防小鼠脊髓中脂多糖诱导的痛觉过敏和TNF-α和IL-1β的释放[13]。而在炎性反应中,内皮素-1、5-羟色胺、一氧化氮合酶等多种炎性介质和细胞因子可激活RhoA,促进炎性损伤和心血管疾病的发生[18-19]。Takeshita等[20]向大鼠关节内注射单碘酸醋盐制备大鼠骨性关节炎模型,退变关节软骨ROCK表达明显增加,而注射ROCK抑制剂AS1892802发现它可延缓关节软骨细胞退变,还可通过抑制滑膜分泌缓激肽降低炎症反应[21]。
在慢性疼痛模型中,Otsuka等[22]发现鞘内注射甲羟戊酸可增加脊髓内RhoA从胞质到胞膜的转移,而Y-27632可完全拮抗甲羟戊酸诱发的热痛敏,同时研究发现应用HMG-CoA还原酶抑制剂辛伐他丁可抑制注射由福尔马林引起的脊髓小胶质细胞RhoA的活化反应,从而抑制福尔马林二相疼痛反应[23]。
在糖尿病模型中,各类糖基化终产物及炎性因子可导致ROCK及其下游分子的激活[24-26]。在其痛觉过敏试验中[22],可发现糖尿病小鼠脊髓细胞中激活的RhoA表达是增加的,而抑制剂Y-27632可缓解机械痛敏反应[27]。同时一氧化氮合酶及一氧化氮的含量也有所下降。
作为谷氨酰胺转变为谷氨酸的关键酶,谷氨酰胺酶在中枢及外周末梢的谷氨酸浓度蓄积起到了重要作用[28-29],谷氨酰胺酶的上调直接影响了谷氨酸表达的增加。研究发现,谷氨酸介导的痛觉传递是诱发中枢慢性疼痛形成的基础[30]。在伤害性信息传入时,神经突触除极化,作为兴奋性神经递质的谷氨酸被释放在突触间隙,各种离子内流并产生正反馈作用,使得神经细胞兴奋性增强。在CPSP中,催化谷氨酰氨转化为谷氨酸的谷氨酰胺酶表达升高[12],故推测术后慢性疼痛的发生是谷氨酸介导产生中枢敏感化的结果,即伤害性感觉传入引起的谷氨酸释放增加启动脊髓背角神经元发生病理生理改变,故而再次传入某种强度刺激时能够使动物感受到大于实际刺激强度的疼痛,从而出现痛觉过敏。
近年来,RhoA与谷氨酰胺酶Ⅰ的相互作用关系在多方面进行过研究。肿瘤细胞的生长通过消耗大量谷氨酰胺来获得足够的能量[31],但肿瘤细胞是如何调节谷氨酰胺表达的却并不清楚。直至研究者们发现RhoA/ Rock信号通路是通过调节上调谷氨酰胺酶Ⅰ的表达来调节谷氨酰胺的代谢[32],两者的关系才受到了重视。RhoA作为转录信号传导和激活分子(STAT)之一,它与GTP酶的关系尚未得到证实,在此研究者通过细胞毒性坏死因子(CNFs)激活Rho/GTP酶途径发现,它们是通过谷氨酰胺的脱酰胺作用活化了Rho家族的小GTP酶,而这对GTP的水解至关重要[33]。同时,在肠上皮损伤模型中,谷氨酰胺与丙氨酸-谷氨酰胺可以增加RhoA的表达,起到一定保护作用[34]。之后,在陈舒等[35]研究中发现向经法舒地尔处理后的神经胶质瘤中加入谷氨酸能进一步降低细胞的存活率,这可能是法舒地尔可以诱导人脑胶质瘤细胞谷氨酸受体的表达增高,通过联合谷氨酸发挥谷氨酸兴奋性毒性达到更好的抗胶质瘤的作用。在慢性疼痛的研究中,我们发现了RhoA与谷氨酰胺酶Ⅰ相互关系的一种新的可能性,这也许会成为之后研究的方向。
| [1] | Akkaya T, Ozkan D. Chronic post-surgical pain[J]. Agri, 2009, 21(1): 1-9. |
| [2] | Crombie IK, Davies HT, Macrae WA. Cut and thrust:antecedent surgery and trauma among patients attending a chronic pain clinic[J]. Pain, 1998, 76(1/2): 167-71. |
| [3] | Dajczman E, Gordon A, Kreisman H, et al. Long-term postthoracotomy pain[J]. Chest, 1991, 99(2): 270-4. DOI: 10.1378/chest.99.2.270. |
| [4] | Jung BF, Ahrendt GM, Oaklander AL, et al. Neuropathic pain following breast cancer surgery:proposed classification and research update[J]. Pain, 2003, 104(1/2): 1-13. |
| [5] | Poobalan AS, Bruce J, Cairns W, et al. A review of chronic pain after inguinal herniorrhaphy[J]. Clin J Pain, 2003, 19(1): 48-54. DOI: 10.1097/00002508-200301000-00006. |
| [6] | Kalso E, Mennander S, Tasmuth T, et al. Chronic post-sternotomy pain[J]. Acta Anaesthesiol Scand, 2001, 45(8): 935-9. DOI: 10.1034/j.1399-6576.2001.450803.x. |
| [7] | Bruce J, Drury N, Poobalan AS, et al. The prevalence of chronic chest and leg pain following cardiac surgery:a historical cohort study[J]. Pain, 2003, 104(1/2): 265-73. |
| [8] | Nikolajsen L, Sorensen HC, Jensen TS, et al. Chronic pain following caesarean section[J]. Acta Anaesthesiol Scand, 2004, 48(1): 111-6. DOI: 10.1111/aas.2004.48.issue-1. |
| [9] | Kehlet H, Jensen TS, Woolf CJ. Persistent postsurgical pain:risk factors and prevention[J]. Lancet, 2006, 367(9522): 1618-25. DOI: 10.1016/S0140-6736(06)68700-X. |
| [10] | Steegers MA, Snik DM, Verhagen AF, et al. Only half of the chronic pain after thoracic surgery shows a neuropathic component[J]. J Pain, 2008, 9(10): 955-61. DOI: 10.1016/j.jpain.2008.05.009. |
| [11] | Wang HT, Liu W, Cai YH, et al. Glutaminase 1 is a potential biomarker for chronic post-surgical pain in the rat dorsal spinal cord using differential proteomics[J]. Amino Acids, 2016, 48(2): 337-48. DOI: 10.1007/s00726-015-2085-z. |
| [12] | 王海棠. 术后慢性疼痛大鼠脊髓背角组织的差异蛋白质组学研究[D]. 北京协和医学院中国医学科学院清华大学医学部, 2012. http://d.wanfangdata.com.cn/Thesis/Y2123488 |
| [13] | Wang CJ, Song SY, Zhang Y, et al. Inhibition of the Rho/Rho kinase pathway prevents lipopolysaccharide-induced hyperalgesia and the release of TNF-alpha and IL-1 beta in the mouse spinal cord[J]. Sci Rep, 2015, 5(7): 14553. |
| [14] | 王海棠, 刘薇, 黄宇光. 大鼠开胸手术后慢性疼痛模型的构建[J]. 临床麻醉学杂志, 2013, 29(7): 700-2. |
| [15] | Shin JW, Pancaro C, Wang CF, et al. The effects of resiniferatoxin in an experimental rat thoracotomy model[J]. Anesth Analg, 2010, 110(1): 228-32. DOI: 10.1213/ANE.0b013e3181c5c89a. |
| [16] | Buvanendran A, Kroin JS, Kerns JM, et al. Characterization of a new animal model for evaluation of persistent postthoracotomy pain[J]. Anesth Analg, 2004, 99(5): 1453-60. |
| [17] | Jungmann PM, Mehlhorn AT, Schmal HA, et al. Nanomechanics of human Adipose-Derived stem cells:small GTPases impact chondrogenic differentiation[J]. Tissue Eng Part A, 2012, 18(9/10): 1035-44. |
| [18] | Nagatoya K, Moriyama T, Kawada N, et al. Y-27632 prevents tubulointerstitial fibrosis in mouse kidneys with unilateral ureteral obstruction[J]. Kidney Int, 2002, 61(5): 1684-95. DOI: 10.1046/j.1523-1755.2002.00328.x. |
| [19] | Takemoto M, Sun J, Hiroki J, et al. Rho-kinase mediates hypoxiainduced downregulation of endothelial nitric oxide synthase[J]. Circulation, 2002, 106(1): 57-62. DOI: 10.1161/01.CIR.0000020682.73694.AB. |
| [20] | Takeshita N, Yoshimi E, Hatori C, et al. Alleviating effects of AS1892802, a Rho kinase inhibitor, on osteoarthritic disorders in rodents[J]. J Pharmacol Sci, 2011, 115(4): 481-9. DOI: 10.1254/jphs.10319FP. |
| [21] | 文刚, 李超, 徐亮, 等. RhoA/ROCK信号通路在人骨关节炎软骨中的表达[J]. 中华实用诊断与治疗杂志, 2016, 30(3): 235-8. |
| [22] | Otsuka S, Adamson C, Sankar V, et al. Delayed intrathecal delivery of RhoA siRNA to the contused spinal cord inhibits allodynia, preserves white matter, and increases serotonergic fiber growth[J]. J Neurotrauma, 2011, 28(6): 1063-76. DOI: 10.1089/neu.2010.1568. |
| [23] | Chen XY, Li K, Light AR, et al. Simvastatin attenuates FormalinInduced nociceptive behaviors by inhibiting microglial RhoA and p38 MAPK activation[J]. J Pain, 2013, 14(11): 1310-9. DOI: 10.1016/j.jpain.2013.05.011. |
| [24] | Wang JP, Liu HX, Chen B, et al. RhoA/ROCK-dependent moesin phosphorylation regulates AGE-induced endothelial cellular response[J]. Cardiovasc Diabetol, 2012, 11(4): 7. |
| [25] | Arita R, Nakao S, Kita T, et al. A key role for ROCK in TNF-alphaMediated diabetic microvascular damage[J]. Invest Ophthalmol Vis Sci, 2013, 54(3): 2373-83. DOI: 10.1167/iovs.12-10757. |
| [26] | Wang D, Luo P, Wang Y, et al. Glucagon-like peptide-1 protects against cardiac microvascular injury in diabetes via a cAMP/PKA/Rho-dependent mechanism[J]. Diabetes, 2013, 62(5): 1697-708. DOI: 10.2337/db12-1025. |
| [27] | 丘玥, 魏敏, 王之遥, 等. RhoA/Rho激酶信号通路在慢性疼痛中的作用[J]. 协和医学杂志, 2016, 7(6): 454-7. |
| [28] | Hoffman EM, Zhang ZJ, Schechter R, et al. Glutaminase increases in rat dorsal root ganglion neurons after unilateral adjuvant-induced hind paw inflammation[J]. Biomolecules, 2016, 6(1): 10. DOI: 10.3390/biom6010010. |
| [29] | Ye L, Huang YL, Zhao LX, et al. IL-1 and TNF-induce neurotoxicity through glutamate production:a potential role for neuronal glutaminase[J]. J Neurochem, 2013, 125(6): 897-908. DOI: 10.1111/jnc.2013.125.issue-6. |
| [30] | Lamotte RH, Shain CN, Simone DA, et al. Neurogenic hyperalgesiapsychophysical studies of underlying mechanisms[J]. J Neurophysiol, 1991, 66(1): 190-211. |
| [31] | Deberardinis RJ, Sayed N, Ditsworth DA. Brick by brick:metabolism and tumor cell growth[J]. Curr Opin Genet Dev, 2008, 18(1): 54-61. DOI: 10.1016/j.gde.2008.02.003. |
| [32] | Erickson JW, Cerione RA. Glutaminase:a hot spot for regulation of cancer cell metabolism?[J]. Oncotarget, 2010, 1(8): 734-40. DOI: 10.18632/oncotarget.v1i8. |
| [33] | Reipschlaeger S, Kubatzky K, Taromi SA, et al. Toxin-induced RhoA activity mediates CCL1-triggered signal transducers and activators of transcription protein signaling[J]. J Biol Chem, 2012, 287(14): 11183-94. DOI: 10.1074/jbc.M111.313395. |
| [34] | Santos AA, Braga-Neto MB, Oliveira MR, et al. Glutamine and alanyl-glutamine increase RhoA expression and reduce clostridium difficile toxin-a-induced intestinal epithelial cell damage[J]. Biomed Res Int, 2013, 25(3): 152052. |
| [35] | 陈舒, 罗铭, 蔡望青, 等. 法舒地尔联合谷氨酸降低胶质瘤细胞存活率[J]. 中国神经精神疾病杂志, 2014, 40(6): 368-71. |
 2017, Vol. 37
2017, Vol. 37

