2. 南方医科大学南方医院妇产科生殖医学中心, 广东 广州 510515
2. Center for Reproductive Medicine, Department of Obstetrics and Gynecology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
单精子卵胞浆内显微注射术(ICSI)主要用来治疗男性不育症。妊娠率仍徘徊在40%~50%,需要深入研究,进一步提高妊娠率。ICSI时采用显微注射的方法将精子直接注入卵胞浆内,对卵子质量要求更高。卵子质量的改善可以提高ICSI助孕的种植率和妊娠率。因此如何选择优质的卵子用于体外受精,是辅助生殖实验室工作中面临的一个重要问题。
包裹在卵母细胞周围的卵丘颗粒细胞层,与卵母细胞通过缝隙连接等复杂机制,调节卵母细胞发育[1-5]。它们通过缝隙连接向卵母细胞运输营养物质,为卵母细胞生长发育提供能量;通过激素、生长因子等介质,对卵母细胞发挥作用,它能贮存生长因子和特定蛋白,在卵母细胞成熟及受精后胚胎发育过程中顺序表达起作用,也能选择性地释放这些因子,在调节卵子与胚胎发育中起作用。
高尔基磷酸化蛋白-3(GOLPH3)可发挥抑制细胞凋亡的作用,起到调控细胞的生长、分化、增殖起作用[6-9]。在卵丘颗粒细胞中表达情况如何?其表达率与ICSI妊娠结局是否相关?查阅文献尚未见报道。为此,本研究收集了ICSI过程中去除的卵丘颗粒细胞,比较分析ICSI妊娠组与非妊娠组病例卵丘颗粒细胞GOLPH3表达率差异,并分析它们与ICSI实验室结局各项指标之间的关系。
1 资料和方法 1.1 研究对象试验经过医院伦理委员会批准,与患者充分知情同意后,选取2012年4月~2014年6月,因丈夫少精子症,弱精子症、畸形精子症、或少弱畸精子症就诊福建省妇幼保健院人类辅助生殖技术研究室,需行ICSI助孕的女性患者119例。
1.1.1 入选标准均为首次行单精子卵胞浆内显微注射助孕的育龄期(年龄小于35岁)妇女;ICSI指征;严重少精子症:1次射出的精液中精子密度≤2×106/mL;弱精子症:精子总数>2×106/mL,而<20×106/mL时,其活力<40%,或者前向运动精子<25%;畸形精子症:畸形精子比率>98%,或者精子畸形指数(SDI)>1.7时;或以上3种异常情况的任意组合;控制性超排卵采用GnRHa长方案的病例;月经规律,周期25~35 d;基础性激素水正常,3个月内未接受过激素类药物治疗;BMI在16.00~ 29.38 kg/m2之间;子宫正常(没有子宫肌瘤,子宫内膜息肉)。
1.1.2 排除标准女方:年龄>35岁和/或基础FSH>10 mIU/mL;曾接受过卵巢手术或放化疗者;卵巢早衰、卵巢功能减退;近期服用甾体类激素药物治疗;患有内分泌疾病及子宫内膜有病变的;PCOS或高雄激素血症,排卵障碍,高泌乳素血症、甲状腺功能异常者,子宫内膜异位症,不明原因性不孕,免疫性不孕, 盆腔结核史;3月内有过促排卵治疗者,新鲜移植周期取消者;输卵管积水者;禁忌使用促排卵药物者;患有心肝肾肺疾病、严重糖尿病、癫痫、HIV感染者;患有不适合妊娠的疾病;吸毒、滥用药物与酗酒者;阴道不明原因出血者;卵巢、垂体、下丘脑、乳腺患有肿瘤者;生殖器官畸形者;染色体异常;药物过敏者。男方:重度少精子症;阻塞性无精子症;逆行射精症;不射精症;染色体异常。
所有入选病例,均详细登记研究对象的人口学特征资料以及丈夫精液参数数据,建立基本信息数据库。每例患者收集所有的卵丘颗粒细胞。采用横断面研究的方法,定期对病例的ICSI助孕结局进行随访,根据随访结果将入选病例分成妊娠组与非妊娠组进行比较分析研究。
1.2 控制性超排卵、取卵和ICSI授精采用本生殖研究室常规促性腺激素释放激素激动剂(GnRH-a)-促性腺激素(Gn)-人绒毛膜促性腺激素(hCG)控制性超排卵长方案。阴道B超指引下穿刺取卵。采用单腔/双腔取卵针,抽取所有卵泡,获得的卵子采用ICSI受精。
1.3 受精与胚胎培养注射精子后的卵子置于IVF-30培养液中,立即移入COOK三气培养箱中培养,完成受精过程。将受精卵用新鲜胚胎生长培养液G1漂洗后,逐个移入胚胎生长培养液G1小滴中,第1天观察受精,第2天或第3天取出观察卵裂情况并给每个胚胎评分记录。选择评分最高的2个胚胎移入胚胎移植胶中进行移植,其他多余的可移植胚胎移入囊胚培养液G2中,继续培养至囊胚形成。胚胎培养至5到6 d若有囊胚形成,筛选出优质囊胚,行玻璃化冷冻保存。
1.4 胚胎移植与黄体支持在取卵后第3天上午,在超声指引下行胚胎移植(ET),所有入选患者均移植1~2个胚胎。取卵后当日开始肌肉注射黄体酮60~100 mg/d,或口服黄体酮胶囊或地屈孕酮,或阴道用黄体酮栓剂进行黄体支持。
1.5 妊娠确立与病例随访在胚胎移植后的第14天,尿检hCG以判断是否妊娠,或者于胚胎移植后的第14~16天查血清hCG水平及上升情况以判断妊娠。妊娠检测阳性者继续黄体支持到约30 d,行B超检查子宫内见到胎囊并有原始心管搏动,证实为临床妊娠成功。对于测定妊娠的病人进行随访,临床妊娠随访至6~7周,继续妊娠随访至10~12周。
1.6 卵丘颗粒细胞标本收集ICSI时,使用拉细的巴氏滴管继续收集全部卵子周围的卵丘颗粒细胞(如图 1),分装于两个高压灭菌的0.5 mL离心管中(冰浴),分别加入PBS 200 μL混匀后,200 g离心5 min,去上清。洗涤两遍后,其中一管沉淀投入液氮速冻,于-80 ℃冰箱中保存;另一管颗粒细胞沉淀加入PBS 20 μL混悬后,吸取10 μL用于细胞涂片,剩余标本加入100 μL细胞裂解液,充分裂解后,于-80 ℃冰箱中保存。

|
图 1 卵冠丘复合体与卵丘颗粒细胞 Figure 1 A and B: Oocyte corona cumulus complex (A, ×40; B, ×100); C and D: Cumulus granulosa cells (C, ×100; D, ×400). |
取10 μL颗粒细胞PBS混悬,加入新配的4%多聚甲醛300 μL,反复吹打使颗粒细胞充分混匀,室温下预固定20 mins。离心去上清,加入10 μL PBS混悬颗粒细胞混,在解剖镜下,用拉细管尖烧圆的巴氏滴管吸细胞悬液,滴在载玻片上并均匀涂开,室温下风干,4 ℃保存备用。按照试剂盒说明书操作,颗粒细胞涂片3% H2O2溶液室温孵育10 min以阻断内源性过氧化氢酶活性,PBS冲洗涂片,加入兔抗人GOLPH3抗体(1:100稀释)(Abcam公司克隆号:19112.1.AP),4 ℃孵育过夜。次日PBS冲洗,滴加聚合物增强剂,室温下孵育20 min,PBS冲洗,滴加酶标抗鼠/兔聚合物(二抗),室温孵育30 min,PBS冲洗后,DAB显色,细胞核经苏木素复染,0.1%盐酸酒精分色,PBS返蓝,晾干,中性树脂分片。PBS液取代一抗作阴性对照。显微镜下观察染色情况,颗粒细胞染成浅黄色为弱阳性“+”,棕色为阳性“++”,棕褐色为强阳性“+++”,计数不同染色级别的颗粒细胞数,每个标本随机选择5个视野,每个视野计数100个细胞,计算阳性细胞所占的比例。参考Soslow等文献[10]对细胞免疫化学结果进行评分,评分标准:A为阳性细胞数分级:0%~1%细胞阳性评为0级、2%~10%细胞阳性评为1级、11%~50%细胞阳性评为2级、51%~80%细胞阳性评为3级、81%~100%细胞阳性评为4级;B为阳性细胞显色强度分级:阴性为0级、弱阳性为1级、阳性为2级、强阳性为3级;AB两项相乘得到每份标本GOLPH3表达评分,即ICS=A×B。评分低于2分为弱阳性表达,高于2分为中强阳性表达。
1.8 Real-time PCR法检测GOLPH3基因表达Trizol法提取颗粒细胞总RNA(Trizol裂解液购自杭州博日科技),将总RNA 1 μg逆转录为cDNA(试剂购自杭州博日科技有限公司),取5 μL RT产物应用ABI7500型荧光定量PCR仪进行Real-time PCR(SYBR Green荧光染料购自Roche公司)。引物由上海生工合成,引物序列及长度(表 1)。Real-time PCR总反应体系20 μL,使用UltraSYBR Mixture完成扩增,扩增程序为:95 ℃作用10 mins,95 ℃作用15 s,60 ℃作用60 s× 45个循环。PCR产物经2%琼脂糖凝胶电泳,无引物二聚体和非特异扩增产物出现。通过实时监测PCR产物的动态积累量,得到各管标本的扩增曲线及目的序列的Ct值,同时检测该管标本管家基因GAPDH的Ct值,计算各管标本待测序列的△Ct值(△Ct=目的基因Ct值-该管样品GAPDH的Ct值),该管标本目的基因的相对表达量为2-ΔCt值。
| 表 1 实验引物序列 Table 1 Sequence of primers |
颗粒细胞裂解后提取总蛋白、测定蛋白浓度备用。制备好SDS-PAGE聚丙烯酰胺凝胶,取相应体积总蛋白样品与5×上样缓冲液,混匀,95 ℃变性10 mins,将样品加到凝胶孔中,电压调至80 V使样品通过浓缩胶与分离胶。凝胶电泳结束后,通过电转移将凝胶上分离的蛋白条带转印至PVDF膜上,然后将膜放入非标记一抗及辣根过氧化物酶标记的二抗溶液中孵育、标记检测。待PVDF膜稍凉干,加入化学发光试剂孵育1 min,迅速用保鲜膜包好后置于暗盒内与Kodak X胶片贴在一起曝光,时间为1 min左右。X胶片经显影、定影后扫描记录。用image J软件分析灰度值。
1.10 统计学分析使用SPSS13.0统计软件进行数据分析。患者年龄、不育年限及体质量指数等计量资料以Mean±SD表示,ICSI结局的获卵率、受精率、卵裂率及妊娠率等计数资料用频数、百分数表示;计量资料比较采用独立样本t检验;计数资料组间比较采用χ2检验;单因素相关分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果 2.1 ICSI助孕妊娠与非妊娠组患者一般情况比较ICSI助孕的119例女性患者中,65例妊娠成功者设为妊娠组,54例助孕失败者病例设为非妊娠组,对两组患者的年龄、不孕年限、体重指数、不孕原因、基础内分泌值、基础窦卵泡数、平均Gn量、平均Gn天数、平均内膜厚度以及丈夫精液参数等一般情况资料进行比较,结果组间差异均无统计学意义(P均>0.05,表 2)。
| 表 2 ICSI妊娠与非妊娠组患者一般情况比较分析 Table 2 Demographic and clinical characteristics between pregnant and non-pregnant subjects (x±s) |
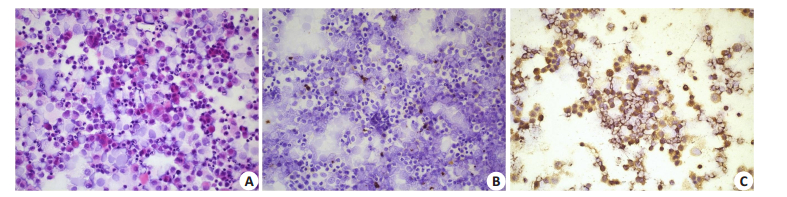
对119份卵丘颗粒细胞涂片进行免疫细胞化学分析GOLPH3的表达,结果如图 2所示,信号主要表达在细胞质中。GOLPH3表达率分布为3%~57%,平均(29.13±14.97)%。免疫细胞化学评分为1~9分,平均4.57±2.38分。
|
图 2 A:卵丘颗粒细胞HE染色(×200);B:PBS作为阴性对照(DAB染色,苏木素复染,×200);C,GOLPH3蛋白在卵丘颗粒细胞中的阳性表达(DAB染色,苏木素复染,×200) Figure 2 A, Cumulus granulosa cells (HE staining, original magnification: ×200); B, PBS negativecontrol (DAB staining and hematoxylin counterstaining, × 200); C, Positive expression of GOLPH3 in cumulus granulosa cells (DAB staining and hematoxylin counterstaining, ×200). |
妊娠组与未妊娠组卵丘颗粒细胞GOLPH3表达率、表达强度组间差异均有统计学意义(P均<0.05,表 3)。
| 表 3 ICSI助孕妊娠与未妊娠组卵丘颗粒细胞GOLPH3表达检测结果 Table 3 Comparison of GOLPH3 expression on cumulus granulosa cells between pregnant and non-pregnant subjects after ICSI (Mean±SD) |
卵丘颗粒细胞GOLPH3表达率分别与ICSI实验室结局指标:穿卵泡数,Ⅲ级OCCs数,ICSI卵子数,受精数,卵裂数,平均优质胚胎数,平均囊胚数,优质囊胚数,平均冷冻胚胎数相关分析结果见表 4。GOLPH3表达与上述ICSI实验室结局各指标呈显著正相关关系(P均<0.01)。
| 表 4 GOLPH3表达与ICSI实验室结局指标相关分析 Table 4 Association of GOLPH3 expression on cumulus granulosa cell with ICSI laboratory outcomes (n=119) |
每组同质标本混合后分别进行3次(n=3)Real time PCR分析,结果显示:妊娠组与非妊娠组卵丘颗粒细胞中GOLPH3在转录水平组间差异有统计学意义(1.04±0.01 vs 0.98±0.003,t=14.560,P=0.000)。
2.6 Western blot检测GOLPH3蛋白在ICSI助孕卵丘颗粒细胞中的表达结果每组同质标本混合后分别进行3次(n=3)SDS PAGE后Western blot分析见图 2,妊娠组与非妊娠组卵丘颗粒细胞中GOLPH3在蛋白质表达水平,组间差异也有统计学意义(1.34±0.01 vs 1.06±0.11 t=14.560,P=0.000)。
3 讨论1992年Palermo率先报道应用单精子卵胞浆内注射(ICSI)技术获得健康婴儿出生[11]。经过20多年来ICSI技术的发展,其临床妊娠率徘徊在40%~50%,仍然值得我们进一步研究。
决定卵母细胞ICSI受精后囊胚形成率的关键因素最主要还是卵母细胞本身具有的发育能力即卵母细胞的质量。卵丘颗粒细胞层与卵母细胞通过缝隙连接等复杂连接机制,调节卵母细胞成熟与发育[1-5]。在卵泡发育期颗粒细胞储存生长因子等特定功能的蛋白分子,在卵母细胞成熟及受精后,胚胎发育过程中,发挥调节卵子与胚胎发育的作用。ICSI时去除的卵丘颗粒细胞,常被丢弃。这些被丢弃的细胞有可能提供了卵母细胞发育及成熟的重要信息,通过检测颗粒细胞基因表达,可以反映卵泡微环境的变化情况,进一步追溯卵母细胞发育的相关信息。有助于间接地评估卵子的质量和胚胎发育潜能。因此,分析颗粒细胞,寻找预测卵子质量及胚胎发育潜力的标记分子,为胚胎选择方法提供新的思路。本研究共收集了119份ICSI后卵丘颗粒细胞标本探索卵丘颗粒细胞GOLPH3分子表达对ICSI结局的影响,结果表明通过对卵丘颗粒细胞的研究,确实可以发现许多与妊娠结局相关的重要信息。
高尔基磷酸化蛋白-3(GOLPH3)可发挥抑制细胞凋亡的作用,起到调控细胞的生长、分化、增殖起作用。GOLPH3可能参与蛋白活性与定位的调控,与高尔基体蛋白质分选功能有关[12-15]。实验研究发现GOLPH3蛋白能激活雷帕霉素敏感型和不敏感型复合体,引起细胞内p70核糖体蛋白S6激酶(p70S6K)、丝/苏氨酸激酶(Akt)活性增高,活化的Akt作用于Caspase-9使其磷酸化而失活,抑制了促凋亡过程[16-18]。Caspase-9作为凋亡启动因子成员之一,它的失活将阻止凋亡执行因子Caspase-3的活化,最终抑制了细胞凋亡,使蛋白合成加速,细胞内蛋白生成的因子增加,蛋白合成加速、对正向促进细胞分裂起重要作用[19-23]。
卵泡生长、选择和闭锁的过程同样存在促凋亡和抗凋亡的过程。高尔基磷酸化蛋白-3(GOLPH3)可发挥抑制细胞凋亡的作用,起到调控细胞的生长、分化、增殖起作用。可能影响卵泡生长、选择和闭锁的过程。本文首次对GOLPH3在卵丘颗粒细胞表达进行了免疫细胞化学分析,结果所示:GOLPH3信号主要表达在卵丘颗粒细胞的细胞质中。119份标本中均有不同程度的GOLPH3表达,范围为3%~57%,表达率为29.13±14.97%。免疫细胞化学评分为1~9分,4.57±2.38分。比较分析了妊娠组与未妊娠组卵丘颗粒细胞GOLPH3表达率的差别,结果发现GOLPH3表达率,组间差异均有显著性意义(P均<0.05)。而且GOLPH3在两组卵丘颗粒细胞中表达程度组间差异也有显著性意义(P<0.001)。将卵丘颗粒细胞GOLPH3表达率分别与ICSI实验室结局指标:穿卵泡数,Ⅲ级OCCs数,ICSI卵子数,受精数,卵裂数,平均优质胚胎数,平均囊胚数,优质囊胚数,平均冷冻胚胎数行相关分析,结果可以看出随着卵丘颗粒细胞GOLPH3表达水平的升高,ICSI助孕实验室指标:穿卵泡数,Ⅲ级OCCs数,ICSI卵子数,受精数,卵裂数,平均优质胚胎数,平均囊胚数,优质囊胚数,平均冷冻胚胎数等显著提高(P均<0.01)。提示:GOLPH3分子表达高者,可用于ICSI的高质量卵子数增多,且卵母细胞的成熟度提高和发育能力增强。Real-time PCR,Western blot结果也进一步证实卵丘颗粒细胞中GOLPH3在基因与蛋白质水平表达可影响ICSI助孕结局。
综上,GOLPH3在卵丘颗粒细胞的表达,可能影响卵母细胞的成熟和卵子的发育能力,进而与ICSI助孕结局有关。
| [1] | Labas V, Teixeira-Gomes AP, Bouguereau L, et al. Intact cell MALDI-TOF mass spectrometry on single bovine oocyte and follicular cells combined with top-down proteomics:A novel approach to characterise markers of oocyte maturation[J]. J Proteomics, 2017, pii:S1874-3919(17): 30118-5. |
| [2] | Warzych E, Pawlak P, Pszczola M, et al. Prepubertal heifers versus cows-The differences in the follicular environment[J]. Theriogenology, 2017, 87: 36-47. DOI: 10.1016/j.theriogenology.2016.08.007. |
| [3] | Mottershead DG, Sugimura S, Al-Musawi SL, et al. Cumulin, an oocyte-secreted heterodimer of the transforming growth factor-beta family, is a potent activator of granulosa cells and improves oocyte quality[J]. J Biol Chem, 2015, 290: 24007-20. DOI: 10.1074/jbc.M115.671487. |
| [4] | Burnik Papler T, Vrtacnik Bokal E, Lovrecic L, et al. No specific gene expression signature in human granulosa and cumulus cells for prediction of oocyte fertilisation and embryo implantation[J]. PLoS One, 2015, 10: e0115865. DOI: 10.1371/journal.pone.0115865. |
| [5] | Goud PT, Goud AP, Joshi N, et al. Dynamics of nitric oxide, altered follicular microenvironment, and oocyte quality in women with endometriosis[J]. Fertil Steril, 2014, 102: 151-9. DOI: 10.1016/j.fertnstert.2014.03.053. |
| [6] | Sun J, Yang X, Zhang R, et al. GOLPH3 induces epithelialmesenchymal transition via Wnt/beta-catenin signaling pathway in epithelial ovarian cancer[J]. Cancer Med, 2017, 6: 834-44. DOI: 10.1002/cam4.2017.6.issue-4. |
| [7] | Tan X, Banerjee P, Guo HF, et al. Epithelial-to-mesenchymal transition drives a pro-metastatic Golgi compaction process through scaffolding protein PAQR11[J]. J Clin Invest, 2017, 127: 117-31. |
| [8] | Xing M, Peterman MC, Davis RL, et al. GOLPH3 drives cell migration by promoting Golgi reorientation and directional trafficking to the leading edge[J]. Mol Biol Cell, 2016, 27: 3828-40. DOI: 10.1091/mbc.E16-01-0005. |
| [9] | Zhou B, Wang G, Gao S, et al. Expression of GOLPH3 protein in colon cancer tissues and its association with the prognosis of patients[J]. Oncol Lett, 2016, 12: 3936-40. |
| [10] | Soslow RA, Dannenberg AJ, Rush D, et al. COX-2 is expressed in human pulmonary, colonic, and mammary tumors[J]. Cancer, 2000, 89(12): 2637-45. DOI: 10.1002/(ISSN)1097-0142. |
| [11] | Palermo G JH, Devroey P, Van Steirteghem AC. Pregnancies after intracytoplasmic injection of single spermatozoom into an oocyte[J]. Lancet, 1992, 340: 17-8. DOI: 10.1016/0140-6736(92)92425-F. |
| [12] | Bell AW, Ward MA, Blackstock WP, et al. Proteomics characterization of abundant Golgi membrane proteins[J]. J Biol Chem, 2001, 276(7): 5152-65. DOI: 10.1074/jbc.M006143200. |
| [13] | Kwon G, Marshall CA, Pappan KL, et al. Signaling elements involved in the metabolic regulation of mTOR by nutrients, incretins, and growth factors in islets[J]. Diabetes, 2004, 53: S225-32. DOI: 10.2337/diabetes.53.suppl_3.S225. |
| [14] | Scott KL, Kabbarah O, Liang MC, et al. GOLPH3 modulates mTOR signalling and rapamycin sensitivity in cancer[J]. Nature, 2009, 459(7250): 1085-90. DOI: 10.1038/nature08109. |
| [15] | Abraham RT. GOLPH3 links the Golgi network to mTOR signaling and human cancer[Z], 2009. http://europepmc.org/abstract/MED/19624311 |
| [16] | Lv XL, Tian H, Lu M, et al. The expression of Golgi phosphoprotein 3(GOLPH3) in nonsmall cell lung cancer and its clinical significance[J]. Chin J Cancer Biother, 2014, 21: 554-8. |
| [17] | Isaji T, Im S, Gu W, et al. An oncogenic protein Golgi phosphoprotein 3 upregulates cell migration via sialylation[J]. J Biol Chem, 2014, 289: 20694-705. DOI: 10.1074/jbc.M113.542688. |
| [18] | Bruun K, Beach JR, Heissler SM, et al. Re-evaluating the roles of myosin 18Aalpha and F-actin in determining Golgi morphology[J]. Cytoskeleton (Hoboken), 2017, 74: 205-18. DOI: 10.1002/cm.v74.5. |
| [19] | Frappaolo A, Sechi S, Belloni G, et al. Visualization of cleavage furrow proteins in fixed dividing spermatocytes[J]. Methods Cell Biol, 2017, 137: 85-103. DOI: 10.1016/bs.mcb.2016.03.035. |
| [20] | Liu Y, Sun Y, Zhao A. :MicroRNA-134 suppresses cell proliferation in gastric cancer cells via targeting of GOLPH3[J]. Oncol Rep, 2017, 37: 2441-8. DOI: 10.3892/or.2017.5488. |
| [21] | Makowski SL, Tran TT, Field SJ. Emerging themes of regulation at the Golgi[J]. Curr Opin Cell Biol, 2017, 45: 17-23. DOI: 10.1016/j.ceb.2017.01.004. |
| [22] | Sechi S, Frappaolo A, Fraschini R, et al. Rab1 interacts with GOLPH3 and controls Golgi structure and contractile ring constriction during cytokinesis in Drosophila melanogaster[J]. Open Biol, 2017, 7(1): pii:160257. DOI: 10.1098/rsob.160257. |
| [23] | Zhou X, Xie S, Wu S, et al. Golgi phosphoprotein 3 promotes glioma progression via inhibiting Rab5-mediated endocytosis and degradation of epidermal growth factor receptor[J]. Neuro Oncol, 2017, doi:10.1093/neuonc/nox104[Epubaheadofprint] http://europepmc.org/abstract/MED/28575494 |
 2017, Vol. 37
2017, Vol. 37

