2. 云南省第一人民医院麻醉科, 云南 昆明 650032
2. Department of Anesthesiology, The First People's Hospital of Yunnan Province, Kunming 650032, China
随着微创外科技术的迅猛发展,单肺通气(OLV)在临床的运用越来越广泛,但众多研究发现它会使肺内炎症介质大量生成,继而诱发肺损伤[1-4]。在种类繁多的炎症介质中,花生四烯酸(AA)代谢网络被认为是机体内源性致炎因子的重要来源[5-6]。我们前期的研究发现,作为胸外科常用机械通气模式,OLV可上调AA类产物生成及其后续致炎作用中最为重要的关键限速酶C-PLA2的表达,使肺内AA大量生成,继而对实验动物造成明显的肺组织损伤[7]。但OLV激活C-PLA2的机制不清。
由于众多的研究均发现,NF-κB可通过调控C PLA2表达而发挥其生物学活性作用[8-11],而OLV可激活NF-κB而诱发肺损伤[1]。所以我们提出科学假说:OLV上调C-PLA2表达的机制与其激活NF-κB有关。本研究拟在OLV致兔肺损伤动物模型上,分别观察PDTC(NF-κB抑制剂)和AACOCF3(C-PLA2抑制剂)预处理对单肺通气实验动物肺组织C-PLA2和NF-κB表达变化影响,阐明OLV激活C-PLA2的具体作用机制,为防治OLV致肺损伤提供相应的药物作用靶点。
1 材料和方法 1.1 材料 1.1.1 实验动物48只健康日本大耳白兔,体质量2.2~ 2.5 kg,雌雄不拘,购自昆明医科大学实验动物中心,饲养在SPF环境中,单只/笼饲养,循环光照,温度25±2 ℃,相对湿度50%~60%,给予足量的清洁级饲料与饮水。
1.1.2 主要试剂C-PLA2抑制剂AACOCF3(santa cruz, sc-201412A);NFκB抑制剂PDTC(碧云天, S1809);花生四烯酸ELISA检测试剂盒(Cusabio, CSB EQ027590RB);C-PLA2抗体(santa cruz, sc-376636)、NF-κB抗体(santa cruz, sc-8008);
1.2 方法 1.2.1 实验设计实验动物随机均分为:对照组(C组);溶剂预处理组(S组);C-PLA2抑制剂(AACOCF3)/溶剂预处理组(AS组):NF-κB抑制剂(PDTC)/溶剂预处理组(PS组);单肺通气组(O组);溶剂预处理+单肺通气组(SO组):C-PLA2抑制剂/溶剂预处理+单肺通气组(ASO组);NF-κB抑制剂(PDTC)/溶剂预处理+单肺通气组(PSO组)
1.2.2 C-PLA2抑制剂和NF-κB抑制剂的给予方法将C-PLA2抑制剂AACOCF3和NF-κB抑制剂PDTC分别以2.5 mg/mL和25 mg/mL的浓度溶解于10%乙醇中,参照他人的研究[1, 12]和我们之前的预实验,ASO组和PSO组分别于单肺通气前30 min经耳缘静脉注入2 mL/kg的AACOCF3(5 mg/kg)或PDTC(50 mg/kg)。S组则给予10%乙醇2 mL/kg。
1.2.3 单肺通气的实施和术中监测对实验兔实施麻醉诱导、单肺通气(右肺通气2 h后双肺通气1 h)和术中监测的方法同我们之前实验研究[7, 13]。恒速静脉注入瑞芬太尼(1 μg/kg/min)、丙泊酚(0.6 mg/kg/min),每30 min静脉追加维库溴铵(0.1 mg/kg)进行麻醉维持。
1.2.4 肺组织取材单肺通气实验动物于实验结束后取右肺进行相应指标检测,S组、AS和PS组给予溶剂或相应抑制剂3.5 h后,经耳缘静脉注入3%戊巴比妥钠(30 mg/kg)麻醉后取材。
1.2.5 Western-blot和Q-PCR分别检测肺组织C-PLA2和NF-κB蛋白及其mRNA表达水平取右肺中间两叶检测实验动物C-PLA2和NF-κB蛋白及其mRNA表达水平。
1.2.5.1 Western-blot检测肺组织C-PLA2和NF-κB蛋白表达水平用RIPA裂解液提取总蛋白后,BSA法测定蛋白浓度,均一化调整样本上样量为70 μg,60 V电压跑出浓缩胶后90 V继续电泳约40 min,转膜槽中100 V电压转印2 h左右。TBS洗膜3次,每次10 min。5%的脱脂奶粉室温封闭1 h,加入对应浓度的一抗溶液,4 ℃孵育过夜,TBST漂洗PVDF膜3次,每次10 min,室温孵育HRP标记二抗1 h,TBST漂洗PVDF膜3次,每次10 min,将HRP化学发光液滴加到PVDF膜上,采用化学发光仪采集图片,所得图片用Image J软件分析灰度值。
1.2.5.2 Q-PCR检测肺组织C-PLA2和NF-κB mRNA表达水平Trizol法提取总RNA,测定总RNA浓度后,各组RNA上样量均一化为1 μg,用cDNA合成试剂盒进行反转录合成cDNA第一条连,用SYBR Green Master Mix试剂盒进行QPCR实验。PCR反应引物见表 1。反应体系为10 μL:上下游引物各0.5 μL,cDNA模板1 μL,SYBR Green Mix 5 μL,Nuclear-Free Water 3 μL。反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。用GAPDH为内参进行校正,以正常组(C组)为对照组,得到目的基因表达的(Ct)值,以2^-ΔΔ(Ct)计算各样品表达量的相对值。
| 表 1 基因名称及其引物序列 Table 1 Primers used to amplify C-PLA2 and NF-κB |
运用ELISA试剂盒检测右肺中间两叶花生四烯酸含量。具体方法按试剂盒说明书进行。
1.2.7 肺损伤的评价方法 1.2.7.1 肺组织学评分靠右肺上叶外1/2内侧处切取肺组织,行HE染色。切片由一不知情的病理学专业技术人员按之前研究[7, 13]的方法在光学显微镜下对肺组织进行形态学评分。
1.2.7.2 肺W/D比值测定靠右肺上叶内1/2外侧缘处切取重约2~3 g肺组织,记录湿重(W)之后将标本置于干燥箱内(80 ℃,72 h),充分干燥至恒重后再次称重(D),计算W/D比值。
1.2.7.3 肺组织髓过氧化物酶(MPO)含量测定运用ELISA试剂盒检测右肺上叶MPO含量。具体方法按试剂盒说明书进行。
1.2.7.4 支气管-肺泡灌洗液(BALF)中嗜中性粒细胞(PMN)计数各组动物处死后,与右肺下叶支气管注入生理盐水,反复冲洗3次。回收液4 ℃离心后沉渣用于嗜中性粒细胞计数。
1.3 统计学处理所有数据为计量资料,以均数±标准差表示,采用SPSS 18.0软件进行统计学分析。多组间的比较采用单因素方差分析,两两比较采用LSD法,以P<0.05为差异有统计学意义。
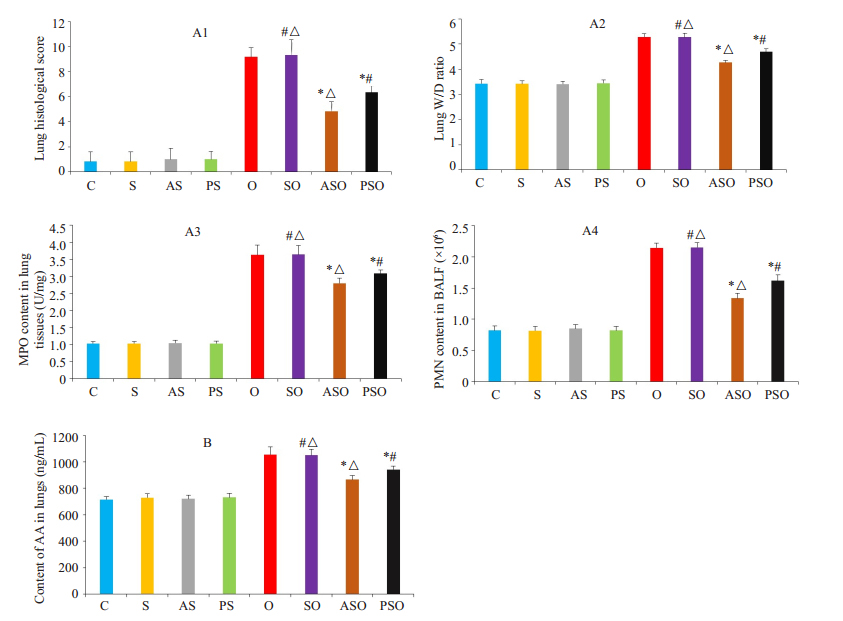
2 结果 2.1 各组动物肺损伤程度评价指标及肺内花生四烯酸含量与C组相比,S组、AS组和PS组肺损伤评价指标(肺组织学评分-A1、肺W/D比值-A2、MPO含量-A3和BALF中PMN计数-A4)及肺内花生四烯酸含量无显著性差异,其余4组均明显增高(P<0.05);单肺通气实验动物各肺损伤评价指标和肺内花生四烯酸含量均明显增加(P<0.05);与O组相比,SO组各肺损伤评价指标和肺内花生四烯酸含量无显著性差异,ASO和PSO组上述指标均明显下降(P<0.05),但PSO组下降程度明显低于ASO组(P<0.05,图 1)。
|
图 1 各组动物肺损伤程度评价指标 Figure 1 Indicators (histological score-A1, lung W/D ratioA2, MPO content in lung tissues-A3, PMN count in BALF-A4) used to evaluate the severity of rabbit lung injury and content of AA in rabbit lungs (B) in different groups. *vs SO group P < 0.05. #vs ASO group P < 0.05. △vs PSO group P < 0.05. |
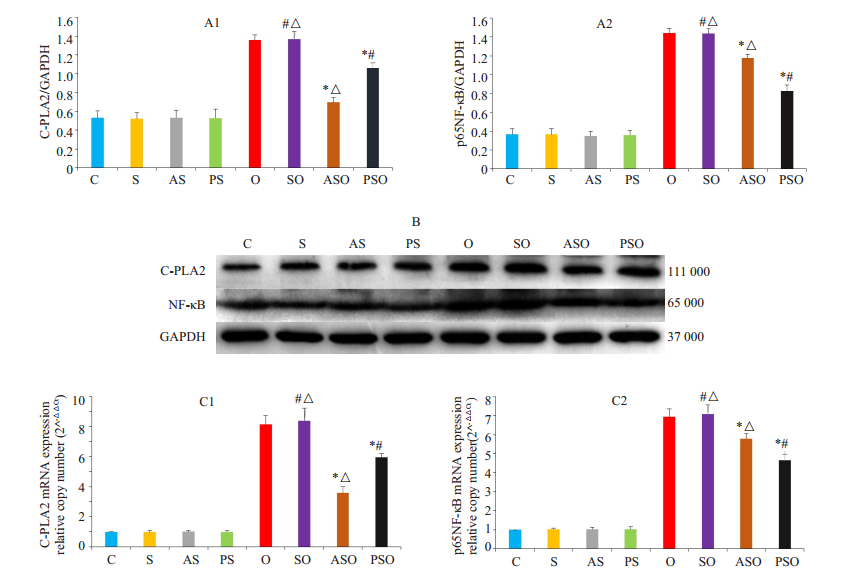
单纯给予溶剂对实验动物肺组织C-PLA2和NF-κB表达水平(蛋白及其mRNA)无显著影响;静脉给予实验动物AACOCF3或PDTC可明显抑制C-PLA2或NF-κB表达水平(P<0.05);除与溶剂+单肺通气组相比无显著差异外,单肺通气实验动物肺组织C-PLA2和NF-κB表达水平均明显高于其余各组(P<0.05)。给予AACOCF3或PDTC,均可显著下调单肺通气实验动物肺组织C-PLA2和NF-κB表达水平(P<0.05,图 2)。
|
图 2 各组动物肺组织C-PLA2和NF-κB蛋白及其mRNA表达变化 Figure 2 Expressions of C-PLA2 and NF-κB protein(A1, A2, B), C-PLA2 mRNA and NF-κB mRNA (C1, C2) in rabbit lung tissues in different groups. *vs SO group P < 0.05. #vs ASO group P < 0.05. △vs PSO group P < 0.05. |
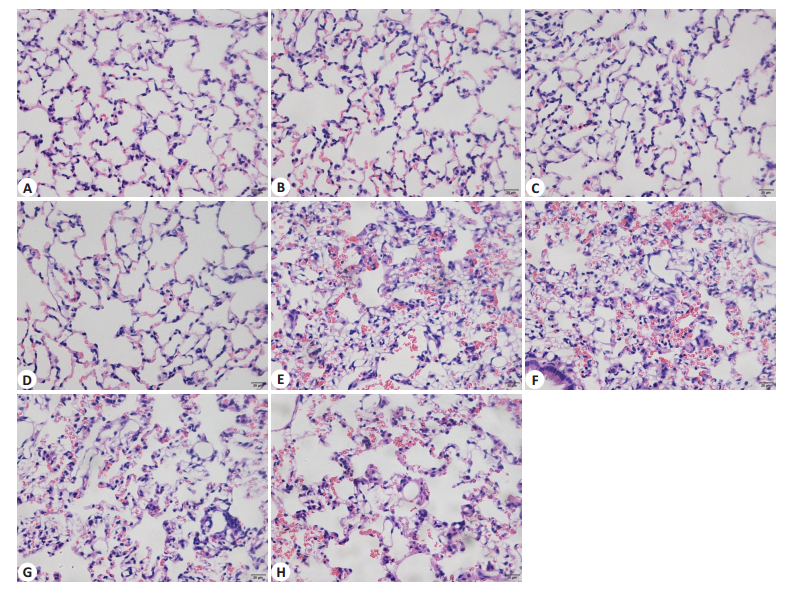
C组、S组、AS组和PS组实验动物肺组织肺泡腔内除少量炎症细胞和红细胞外,无明显病理学改变。O组与SO组实验动物肺泡腔内较多红细胞和炎症细胞浸润,肺泡壁明显充血、增厚和渗出。ASO组和PSO组实验动物肺组织病理学改变较O组和SO组明显减轻,但PSO组减轻程度不如ASO组(图 3)。
|
图 3 各组动物肺组织HE染色 Figure 3 Lung histology under microscopy in different groups (HE staining, original magnification: ×400). A: C group; B: S group; C: AS group; D: PS group; E: O group; F: SO group; G: ASO group; H: PSO group. |
研究发现,单纯给予溶剂或抑制剂均未对实验动物造成明显副作用。运用NF-κB抑制剂PDTC下调肺组织NF-κB表达后,单肺通气实验动物肺损伤程度明显减轻,这与他人研究相同[1]。由于PDTC下调NF-κB表达的同时,伴有实验动物肺组织C-PLA2表达水平的显著下降。这一研究结果证实了我们之前所提出的科学假说:OLV上调实验动物肺组织C-PLA2表达的机制与其激活NF-κB有关。由于活化的NF-κB可进入细胞核内与特定的启动子结合,从而调控多种基因的表达[14]。所以我们推测NF-κB调控C-PLA2的机制与其促进细胞核内C-PLA2基因转录有关。
但是,运用C-PLA2特异性抑制剂AACOCF3抑制C-PLA2表达的同时,伴有NF-κB表达水平的降低。该研究结果提示,C-PLA2对NF-κB也具有明显调控作用。在对人脐静脉内皮细胞、小鼠小胶质细胞以及结肠炎的实验研究中同样发现,NF-κB的活性受C-PLA2所调控[15-17]。其中机制,我们推测是C-PLA2激活AA代谢途径使肺内AA及其致炎性代谢产物大量生成所造成的结果。我们之前的研究已证实,OLV可使肺内AA及其代谢产物前列环素(PGI2)、血栓素A2(TXA2)和白三烯(LTB4)大量生成,PGI2/TXA2比值下降,继而诱发肺损伤[7, 13]。TXA2类似物U46619可通上调NF-κB表达引起血小板聚集和肺动脉平滑肌细胞收缩[18-19]。PGI2是一种强效的扩血管和抗血小板聚集物质,而TXA2具有很强的促血管收缩和促血小板聚集作用,正常生理情况下二者在机体内处于某一平衡状态[20-21]。虽然OLV实验动物肺内伴有PGI2的大量生成,而PGI2与其受体结合后可下调NF-κB及其所介导的信号通路活性[22-23],但OLV实验动物肺内PGI2生成的量相对于TXA2来说明显不足,PGI2/TXA2比值显著降低[13]。这些研究结果提示,与TXA2相比,OLV时PGI2对NF-κB的调控中可能处于劣势。LTB4与其受体(BLT1和BLT2)结合后可活化NF-κB,继而引起动脉粥样硬化和肺动脉内皮细胞的炎症反应[24-25]。在登革热病毒致人类神经元细胞凋亡的研究中发现,AA可激活NADPH氧化酶,使超氧化阴离子生成增多,继而激活NF-κB[26]。
研究还发现,ASO组实验动物肺损伤程度明显低于PSO组。究其原因,是由于本研究对OLV实验动物运用AACOCF3或PDTC预处理时,没有设置不同剂量组别,不能观察到量效关系。所以不能排除本研究存在AACOCF3对C-PLA2所产生的抑制效应与PDTC对NF-κB所产生的抑制效应不均衡的情况。即本研究所用AACOCF3对C-PLA2的抑制程度可能明显强于PDTC对NF-κB的抑制程度。
综上所述,本研究首次证实了OLV上调C-PLA2表达的机制与NF-κB的激活有关,而OLV上调NF-κB表达的机制又与C-PLA2的激活使肺内AA及其代谢产物的大量生成有关。即在OLV致肺损伤中,C-PLA2与NF-κB可相互调控,相互影响,对于其上、下游作用关系,仍需进一步研究。
| [1] | You Z, Feng D, Xu H, et al. Nuclear factor-kappa B mediates onelung ventilation-induced acute lung injury in rabbits[J]. J Invest Surg, 2012, 25(2): 78-85. DOI: 10.3109/08941939.2011.603817. |
| [2] | Sugasawa Y, Yamaguchi K, Kumakura SA, et al. Effects of sevoflurane and propofol on pulmonary inflammatory responses during lung resection[J]. J Anesth, 2012, 26(1): 62-9. DOI: 10.1007/s00540-011-1244-y. |
| [3] | Della Rocca G, Coccia C. Acute lung injury in thoracic surgery[J]. Curr Opin Anaesthesiol, 2013, 26(1): 40-6. DOI: 10.1097/ACO.0b013e32835c4ea2. |
| [4] | Kometani T, Okamoto T, Yoshida S, et al. Acute respiratory distress syndrome after pulmonary resection[J]. Gen Thorac Cardiovasc Surg, 2013, 61(9): 504-12. DOI: 10.1007/s11748-013-0276-7. |
| [5] | He C, Wu Y, Lai Y, et al. Dynamic eicosanoid responses upon different inhibitor and combination treatments on the arachidonic acid metabolic network[J]. Mol Biosyst, 2012, 8(5): 1585-94. DOI: 10.1039/c2mb05503a. |
| [6] | Sanak M. Eicosanoid mediators in the airway inflammation of asthmatic patients:what is new[J]. Allergy Asthma Immunol Res, 2016, 8(6): 481-90. DOI: 10.4168/aair.2016.8.6.481. |
| [7] | Liu R, Yang Y, Li Y, et al. Effects of sevoflurane on pulmonary cytosolic phospholipase A2 and clara cell secretory protein expressions in rabbits with one lung ventilation-induced lung injury[J]. J South Med Univ, 2013, 33(4): 469-73. |
| [8] | Chi PL, Liu CJ, Lee IT, et al. HO-1 induction by CO-RM2 attenuates TNF-α-induced cytosolic phospholipase A2 expression via inhibition of PKCα-dependent NADPH oxidase/ROS and NF-κB[J]. Mediators Inflamm, 2014: 279171. |
| [9] | Lin CC, Lin WN, Cho RL, et al. TNF-α-Induced cPLA2 Expression via NADPH Oxidase/Reactive Oxygen Species-Dependent NF-κB Cascade on Human Pulmonary Alveolar Epithelial Cells[J]. Front Pharmacol, 2016, 7: 447. |
| [10] | Lee CW, Lin CC, Lee IT, et al. Activation and induction of cytosolic phospholipase a(2) by TNF-alpha mediated through Nox2, MAPKs, NF-kappa B, and p300 in human tracheal smooth muscle cells[J]. J Cell Physiol, 2011, 226(8): 2103-14. DOI: 10.1002/jcp.22537. |
| [11] | Hsu PS, Wu CS, Chang JF, et al. Leptin promotes cPLA2 gene expression through activation of the MAPK/NF-κB/p300 cascade[J]. Int J Mol Sci, 2015, 16(11): 27640-58. |
| [12] | Nagase T, Uozumi N, Aoki-Nagase T, et al. A potent inhibitor of cytosolic phospholipase A2, arachidonyl trifluoromethyl ketone, attenuates LPS-induced lung injury in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2003, 284(5): L720-6. DOI: 10.1152/ajplung.00396.2002. |
| [13] | Liu R, Luo J, Li J, et al. Protective mechanisms of sevoflurane against one-lung ventilation-induced acute lung injury:role of cyclooxygenase-2 and 5-lipoxygenase pathways[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2013, 33(5): 625-30. |
| [14] | Catrysse L, Van Loo G. Inflammation and the metabolic syndrome:the Tissue-Specific functions of NF-kappa B[J]. Trends Cell Biol, 2017, 27(6): 417-29. DOI: 10.1016/j.tcb.2017.01.006. |
| [15] | Wan R, Liu Y, Li L, et al. Urocortin increased endothelial ICAM1 by cPLA2-dependent NF-κB and PKA pathways in HUVECs[J]. J Mol Endocrinol, 2013, 52(1): 43-53. DOI: 10.1530/JME-13-0182. |
| [16] | Malada-Edelstein YF, Hadad N, Levy R. Regulatory role of cytosolic phospholipase A(2) alpha in the induction of CD40 in microglia[J]. J Neuroinflammation, 2017, 14(1): 33. DOI: 10.1186/s12974-017-0811-z. |
| [17] | Rosengarten M, Hadad N, Solomonov Y, et al. Cytosolic phospholipase A2α has a crucial role in the pathogenesis of DSS-induced colitis in mice[J]. Eur J Immunol, 2016, 46(2): 400-8. DOI: 10.1002/eji.201545848. |
| [18] | Chowdhury A, Roy S, Chakraborti T, et al. Activation of proMMP-2 by U46619 occurs via involvement of p(38) MAPK-NF kappa BMT1MMP signaling pathway in pulmonary artery smooth muscle cells[J]. Mol Cell Biochem, 2014, 385(1/2): 53-68. |
| [19] | Fang WR, Wei J, Han D, et al. MC-002 exhibits positive effects against platelets aggregation and endothelial dysfunction through thromboxane A(2) inhibition[J]. Thromb Res, 2014, 133(4): 610-5. DOI: 10.1016/j.thromres.2014.01.029. |
| [20] | Batoule HM, Khalil RA. Molecular mechanisms regulating the vascular prostacyclin pathways and their adaptation during pregnancy and in the newborn[J]. Pharmacol Rev, 2012, 64(3): 540-82. DOI: 10.1124/pr.111.004770. |
| [21] | Mahajan CN, Afolayan AJ, Eis A, et al. Altered prostanoid metabolism contributes to impaired angiogenesis in persistent pulmonary hypertension in a fetal lamb model[J]. Pediatr Res, 2015, 77(3): 455-62. DOI: 10.1038/pr.2014.209. |
| [22] | Wang P, Guan PP, Yu X, et al. Prostaglandin I2 attenuates prostaglandin E2-Stimulated expression of interferon γ in a β-amyloid protein-and NF-κB-dependent mechanism[J]. Sci Rep, 2016, 12(6): 20879. |
| [23] | Birukova AA, Meng FY, Tian YF, et al. Prostacyclin post-treatment improves LPS-induced acute lung injury and endothelial barrier recovery via Rap1[J]. Biochim Biophys Acta, 2015, 1852(5): 778-91. DOI: 10.1016/j.bbadis.2014.12.016. |
| [24] | Sanchez-Galan E, Gomez-Hernandez A, Vidal CA, et al. Leukotriene B4 enhances the activity of nuclear factor-kappaB pathway through BLT1 and BLT2 receptors in atherosclerosis[J]. Cardiovasc Res, 2009, 81(1): 216-25. DOI: 10.1093/cvr/cvn277. |
| [25] | Jiang JX, Zhang SJ, Xiong YK, et al. EETs attenuate Ox-LDLInduced LTB4 production and activity by inhibiting p38 MAPK phosphorylation and 5-LO/BLT1 receptor expression in rat pulmonary arterial endothelial cells[J]. PLoS One, 2015, 10(6): e0128278. DOI: 10.1371/journal.pone.0128278. |
| [26] | Jan JT, Chen BH, Ma sh, et al. Potential dengue Virus-Triggered apoptotic pathway in human neuroblastoma cells:arachidonic acid, superoxide anion, and NF-κB are sequentially involved[J]. J Virol, 2000, 74(18): 8680-91. DOI: 10.1128/JVI.74.18.8680-8691.2000. |
 2017, Vol. 37
2017, Vol. 37

