2. 广州军区广州总医院甲乳糖尿病外科, 广东 广州 510010
2. Surgical Center of Thyroid Diabetes, Guangzhou General Hospital of Guangzhou Military Command, Guangzhou 510010, China
据2014年国际糖尿病联盟(IDF)统计的数据显示,全年总计存在3.87亿的2型糖尿病患者,其中90%以上为高收入国家,预计这一数字将在2035年增加一倍[1],而我国已成为全球发病率最高的国家[2]。减重手术是改善肥胖与2型糖尿病患者的重要的手段,而胃旁路术是应用最有效、最广泛的方式,其治愈率超过78%,改善率在86%以上[3-5]。然而胃旁路术为何能如此有效的机制并不明朗,目前多从神经体液调节[6],免疫调节[7]等方面进行研究。近年来,国外多项研究表明,减重手术后患者的肠道菌群发生了显著变化[8-9],但是国内做此项研究的并不多,考虑到人种以及饮食习惯的不同,我们选择从肠道菌群方面进行探索。
本研究以患有2型糖尿症的肥胖患者为研究对象,应用第2代高通量IlluminaMiSeq测序平台对胃旁路术前后患者的粪便样品中细菌16S rRNA扩增产物进行Paired-end测序,分析肠道菌群多样性及丰度的变化,同时统计手术前后患者的BMI、腰臀、比糖代谢、脂代谢的变化情况。探讨肠道菌群在2型糖尿病的肥胖者中的变化特征,有助于以后进一步研究相关疾病的发病机制,为治疗相关疾病提供方向。
1 资料和方法 1.1 资料收集4位患者手术前、后肥胖2型糖尿病患者的粪便样本于无菌采便盒中,并迅速置于-70 ℃冰箱保存;同时采集患者手术前后不同时期的空腹血清(胃旁路术前,术后1、3、6、12、24、36月)分装、保存于-80 ℃,备用。病例纳入标准:(1)确诊为2型糖尿病患者(BMI≥ 40 kg/m2),年龄在30~60岁,保守治疗2年未见成效,并且经健康保险批准手术的患者,且排除如恶性肿瘤、甲状腺疾病、妊娠、应激等引起的血糖升高;(2)1月内未服用过抗生素、微生态制剂,同时4周内无腹泻或肠道疾病的患者。
1.2 主要试剂盒仪器粪便基因组提取试剂盒(DP328)、琼脂糖、溴化乙锭(EB)(天根生化),Premix TaqTM(RR902A)、DNA Marker(TaKaRa),E.Z.N.A.TMGel Extraction Kit(D2500-02)(OMEGA),PCR引物(生工生物),温度梯度热循环PCR仪和台式冷冻离心机(Eppendorf),水平式电泳仪(AMERSH AM PHARMACIA),UVITec凝胶成像系统(UVITec公司)。
1.3 方法 1.3.1 胃旁路术前后代谢研究 1.3.1.1 BMI和腰臀比统计根据设定的检测周期对4位患者分别进行身高(cm)、体质量(kg)、腰围(cm)、臀围(cm),并统计术前、后身体质量指数(BMI)和腰臀比[BMI=体质量/身高2(kg/m2),腰臀比=腰围(cm)/臀围(cm)]。
1.3.1.2 糖代谢检测1)空腹检测:在空腹的条件下,取患者血样分别进行胰岛素、C肽和血糖的含量检测;(2)患者在5 min内摄入一定量的葡萄糖溶液(75 g葡萄糖兑250 mL蒸馏水),并开始计时,在2 h后分别检测血糖、胰岛素、C肽的血清含量;(3)计算摄入葡萄糖后2 h检测值与空腹检测值的比例,统计分析胃旁路术前,术后1、3、6、12、24、36月结果,其胰岛素、C肽、血糖空腹含量和对应2 h后相应含量的比值分别记为胰岛素比、C肽比和血糖比。
1.3.1.3 脂代谢的常规检测根据不同时间段收集的患者血清,对其进行总胆固醇(TC)、总甘油三酯(TG)、游离脂肪酸(FFA)、丙氨酸转移酶(ALT)、谷草转移酶(AST)定期检测。分别统计在手术前(Q1组)、手术后3个月(Q2组)、手术后6个月(Q3组)3个组对应值,对以上检测结果的差异性分析,判定脂代谢变化情况。
1.3.2 胃旁路术前后肠道菌群的变化研究 1.3.2.1 粪便总的DNA提取使用天根生化公司的细菌基因组DNA提取试剂盒进行,操作步骤按试剂盒说明书进行。
1.3.2.2 总DNA浓度测定从提取的各样本总DNA中,取2 µL稀释5倍至10 µL(ddH2O),用紫外分光光度计测定样本在260 nm和280 nm波长下的吸光度,A260/A280的值用于展示样本DNA的浓度,最后记录各样本浓度。
1.3.2.3 总DNA质量分析(1)引物设计:为了验证提取的DNA是该项目所需要的核酸物质,根据细菌16S rRNA的序列分析、设计其通用扩增引物检测提取物的可靠性。F27:5'-AGA GTT TGA TCM TGG CTC AG-3('上游引物),R1492:5'-TAC GGY TAC CTT GTT ACG ACT T-3('下游引物)。(2)PCR扩增验证的反应体系20 µL:Premix Taq TM 10.0 µL,F(10 µmol)1.0 μL,R(10 µmol/L)1.0 μL,DNA 1.0 μL(10~50 ng),ddH2O 7.0 μL。PCR反应条件:(1)预变性:94 ℃,5 min;(2)变性:94 ℃,30 s;退火:55 ℃,45 s;延伸:72 ℃,1.5 min;循环数:30个循环;(3)最终延伸:72 ℃,10 min;(4)保存:4 ℃,30 min。
1.3.2.4 电泳检测制备1%的琼脂糖,上样3 µL PCR产物,电泳45 min,与紫外仪中凝胶成像分析。
1.3.2.5 16S rRNA测序将验证合格的总DNA送至华大基因通过IlluminaMiseq测序平台,进行肠道菌的16S rRNA的V4区测序,并进行数据统计、序列拼接、物种分类和丰度分析、样本多样性等分析。
1.3.3 统计学方法通过SPSS 17.0软件对获得的数据进行统计学分析,对4位患者进行手术前后代谢数据和肠道菌群计数差别采用配对样本t检验,P<0.05为差异有统计学意义。
2 结果 2.1 患者胃旁路术后的代谢变化 2.1.1 BMI和腰臀比统计对4位患者手术后BMI和腰臀比统计结果发现,进行胃旁路术3年后BMI和腰臀比较术前降低(P<0.05,图 1),并在术后8~10月趋于稳定;虽然术后患者的腰臀比均有所下降,但个别患者会出现反弹现象。
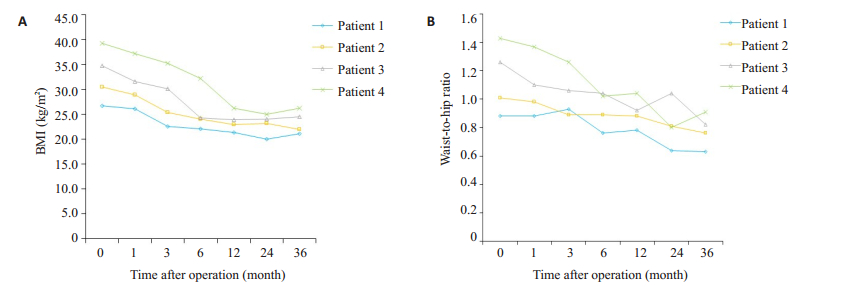
|
图 1 术前、后BMI腰臀比统计 Figure 1 Statistics of BMI (A) and waist-to-hip ratio (B) in the patients at different time points after the surgery |
被研究的4位患者手术前的血糖比、胰岛素比和C肽比的值,其定期检测统计结果见图 2(A/B/C)。可以看出在手术后1~3月内表现为急剧下降,而后进入相对稳定的范围,与手术前对比其血糖比、胰岛素比和C肽比下降(P<0.05)。
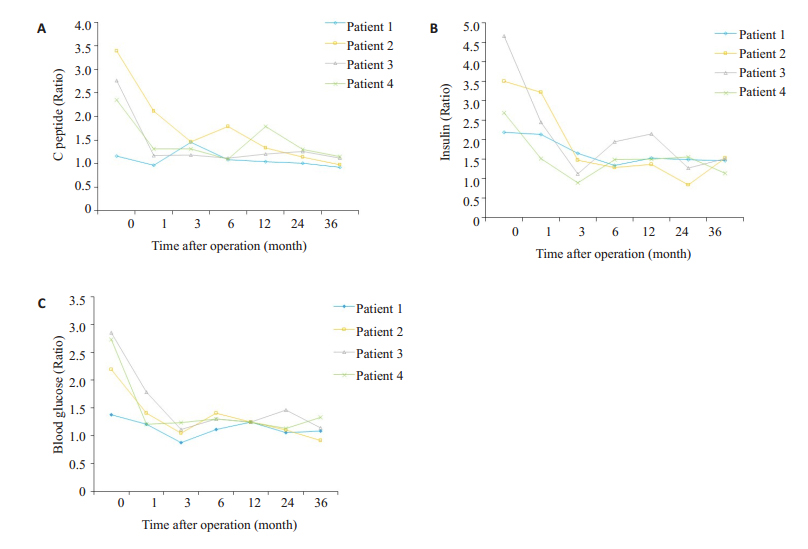
|
图 2 术前、后血糖比、胰岛素比和C肽比统计 Figure 2 Statistics of blood glucose ratio (A), insulin ratio (B) and C peptide ratio (C) in the patients at different time points after the surgery. |
统计4位患者在胃旁路术前、TC,TG,FFA,ALT,AST的检测结果,并将其按时间进行分组对照、差异性分析(表 1)。
| 表 1 术前、后患者血脂相关指标比较 Table 1 Analysis of blood lipid related indexes in the patients (mmol/L) |
对提取的各样本中肠道微生物宏基因组DNA样品,进行1%的琼脂糖凝胶电泳检测,如图 3A所示,其各泳道均见明显的DNA条带。同时进一步测得8个DNA样品浓度均≥200 ng/µL,并且A260/280值在1.8~2.0质检。随后以提取的宏基因组DNA作为模板,通过细菌16S rRNA基因的通用引物27F/1492R进行PCR检测,其扩增片段大小为1466 bp,结果如图 3B所示,条带大小与预测结果一致。结果表明提取得到的肠道微生物的宏基因组DNA初步达到高通量测序的质量要求。
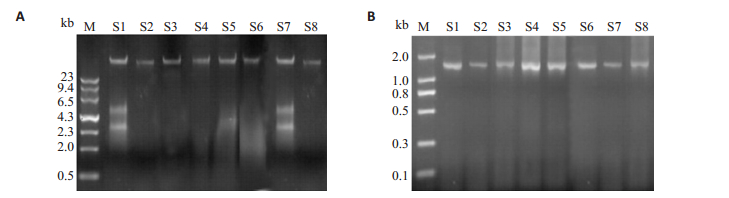
|
图 3 总DNA电泳检测图与肠道微生物宏基因组DNA进行PCR扩增电泳图 Figure 3 Electrophoresis detectionofmicrobial metagenomic DNA (A) and PCR amplification of the microbial metagenomic DNA (B). |
在97%相似度的情况下对每个样本进行聚类分析,对OTU中的丰度信息进行统计分析。8个样品共产生了531个OTU,对每个样品OTU进行分别统计。通过t检验分析4位患者在进行路术前、后各样本OTU数,发现不存在明显的差异性(P= 0.395,表 2)。
| 表 2 样品OTU统计 Table 2 Statisticsof the OTU of the samples |
多样性指数在97%相似水平下,4个样本的胃旁路术前、后单样本多样性结果反映菌群丰度的Sobs、Chao和Ace指数在不同条件下样本间趋势一致,无明显统计学差异。从多样性比较上看,Shannon和Simpson在不同条件下样本间均有统计学意义的差异(表 3)。
| 表 3 Alpha多样性统计结果 Table 3 Statistics of the Alpha diversity of the samples |
根据表 2的结果,将4位患者分为胃旁路术前、后两组进行配对t检验分析,发现两组间Shannon和Simpson的差异明显(P<0.05,图 4)。
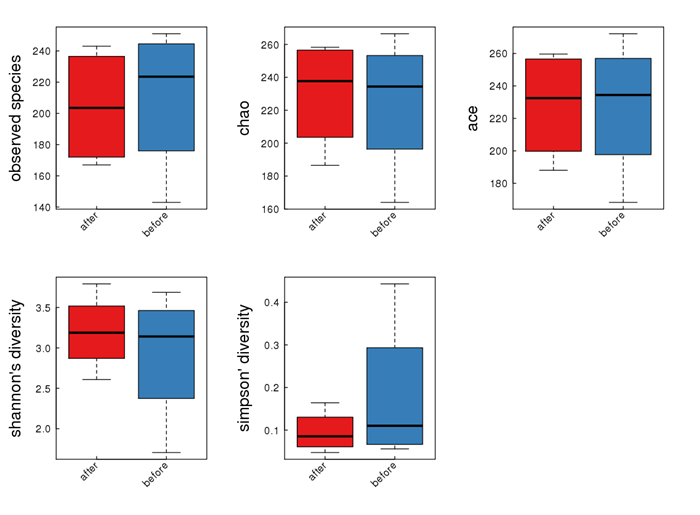
|
图 4 Alpha多样性统计结果 Figure 4 Statistics of the Alpha diversity of the samples. |
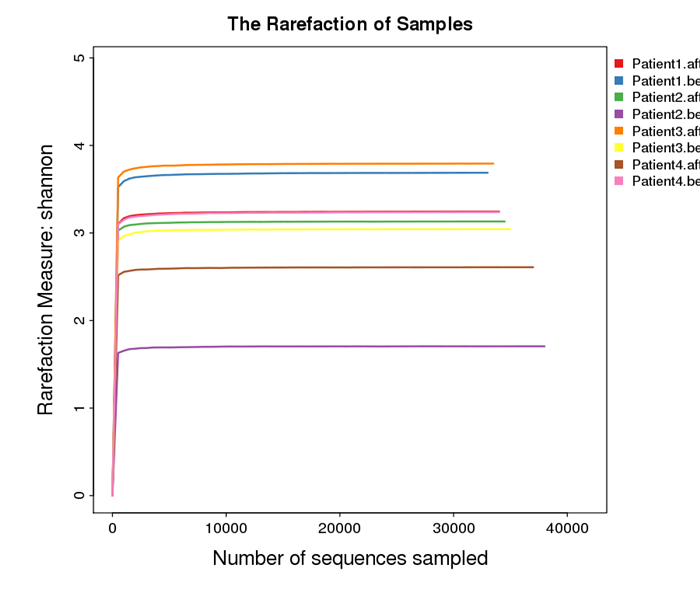
基于Shannon值得稀释曲线所示,随着测序量的增大,不断有新的物种出现,当抽样序列达到一定的深度时,Shannon指数达到饱和,稀释曲线进入平台期,说明本次试验的测序量已经达到试验需要的理想水平(图 5)。
|
图 5 肠道微生物的Shannon-Wiener曲线 Figure 5 Shannon-Wiener curve of the cecal microbiota. |
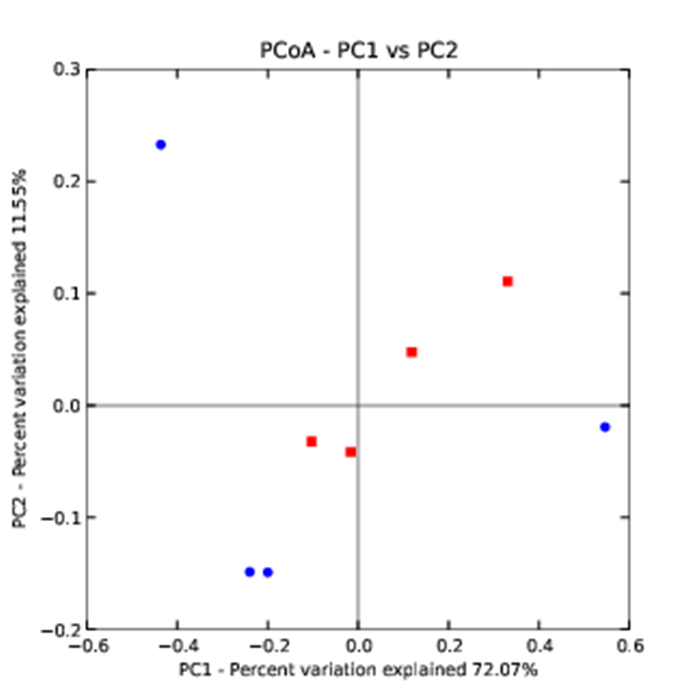
考虑OTU在样本中的丰度的同时,引入系统进化关系。采用Weighted UniFrac分析来比较各样本肠道菌群之间的差异(图 6),胃旁路术前、后样本菌群有分开的区域,但手术后样本存在个体离群现象。其第1和第2个PC分别为72.07%和11.55%的变异度。
|
图 6 基于OTU丰度的PCA分析 Figure 6 PCA based on OTU abundance. |
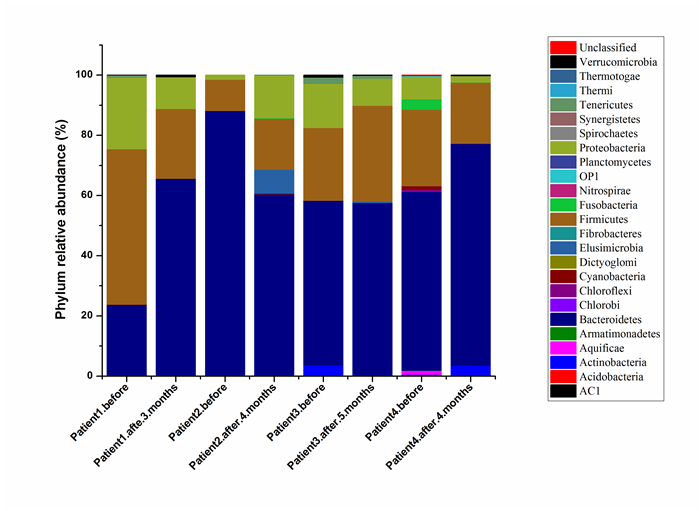
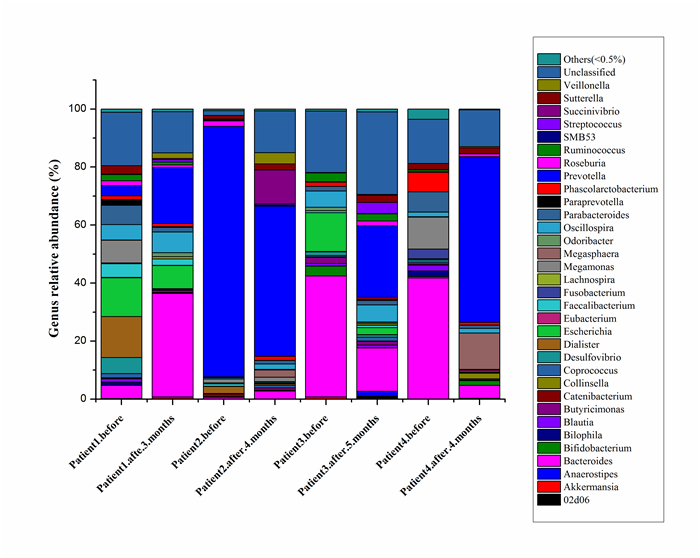
对各样本进行物种注释分析,主要目的是对样本的菌群结构进行详细的分类和整理,图 7、8分别展示门和属水平上各组物种组成结构上的差异。
|
图 7 门水平上的分布 Figure 7 Distribution of the intestinal flora evaluated at the phylum taxonomical level. |
|
图 8 属水平上的分布 Figure 8 Distribution of the intestinal flora evaluated at the genustaxonomical level. |
门水平(phylum level)分析手术前后肠道菌变化,建立门水平的分类柱状图(图 7)。共分属25个门,其手术前后的肠道菌均以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)为主,占总体菌群的95%以上,对其胃旁路术前、后两组结果的菌群进行非参数检验分析,如表 4所示。表明胃旁路术后肠道内拟杆菌门(Bacteroidetes)增加,厚壁菌门(Firmicutes)减少,其比例有增加;同时发现变形菌门(Proteobacteria)和放线菌门(Actinobacteria)有略微减少的现象。
| 表 4 菌群在门水平上的分布比例 Table 4 Distribution of gut microbiota at the phylum taxonomical level before and after surgery |
属水平(Genus)分析手术前、后肠道菌变化,建立柱状图分析,如图 8所示,共获得190各属,其中75个属未被注释,占总体的39.5%。相对丰度大于1%的定为优势菌属,共19中,占总菌属的85%以上,对其胃旁路术前、后两组结果的菌群进行非参数检验分析(表 5)。主要菌群包括拟杆菌属(Bacteroides)和普氏菌属(Prevotella),术后才出现的菌属为Megasphaera、Veillonella和Succinivibrio,可见术后菌群结构发生变化,多样性增加。
| 表 5 菌群在属水平上的分布比例 Table 5 Distribution of gut microbiota at the genus taxonomical level before and after the surgery |
目前肥胖合并糖尿病患者日渐增加,RYGB手术是治疗病态肥胖症的经典术式,也是减重手术中的“金标准”[21]。然而据报道,肥胖糖尿病患者与正常人相比,其糖代谢、脂代谢和身体质量指数等存在明显差异现象[22]。同时肠道菌群也是影响机体生理内化的环境因素,在调节机体脂肪生成和能量代谢过程中,发挥的重大作用,能量代谢的失衡最终会导致肥胖和2型糖尿病的发生[10]。
本研究统计分析4位肥胖糖尿病患者进行胃旁路术前、后不同时间段的身体指数、糖代谢、脂代谢,以及肠道菌群的变化统计分析。结果发现胃旁路术后,其患者身体指数、糖代谢、脂代谢在3~6月内不断下降,在12月以后,长期处理相对稳定水平,但发现在6~12月个别患者会出现反弹现象,主要可能是饮食习惯造成。根据J Graessler的研究结果[22],在进行位旁路术后的3月后其身体指数和代谢功能发生显著性变化的结果相符;目前RYGB的减重降糖作用机制尚不清楚,可能与肠-胰岛轴调节胃肠道激素的内分泌功能有关[23];也有研究认为是RYGB的降糖机制是由于手术后体内脂质代谢紊乱改善,从而改善了β细胞的功能,从而可促进体内葡萄糖的有效利用[24];而饶翀等[25]发现肠道菌群能调节脂类、脂多糖(LPS)含量和短链脂肪酸(SCFAs)的生成,并能影响食物摄入,炎症反应和胰岛素信号转导等作用。
手术后,各患者肠道菌群在门水平的分析发现其比例存在明显变化,在属水平分析发现其多样性增加。肥胖者肠道菌群拟杆菌门比例降低,放线菌门数量升高,较瘦的人的菌群多样性也明显比肥胖者的高。同时在肥胖患者的肠道菌群中拟杆菌门的数量少,厚壁菌门较多,通过饮食调节之后体重下降,拟杆菌门和厚壁菌门的比例逐步接近于正常人[11]。而糖尿病患者的肠道微生物菌群中,厚壁菌门和梭菌纲门的含量呈现明显低于正常人[12-13]。本实验结果显示拟杆菌门、厚壁菌门、变形菌门和放线菌门均存在不同程度的减少,与该文献存在差异现象。而Zhang等[26]及Li等[27]均发现术后拟杆菌门和厚壁菌门均减少,与本实验结果相符。对于结果存在差异现象,需进一步增加样本分析、确定。
成人肠道内菌群从门的水平上可分为以下4大类:拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)。在本研究中,厚壁菌门和拟杆菌门是占80%以上的主要的肠道菌。在接受RYGB治疗手术后,它们的比例发生变化,拟杆菌门比例增加,厚壁菌门比例减少,同时变形菌比例减少。前人研究表明,肠道菌群参与了宿主的胆酸、胆固醇代谢,激素代谢和脂代谢等,并为机体代谢通量提供各种酶[14-15]。其中拟杆菌具有碳水化合物发酵、参与多糖代谢、胆汁酸和类固醇代谢的功能[16];厚壁菌绝大多数属于梭菌,其主要产物丁酸是肠道细菌发酵食物中不能被宿主吸收的多糖的最终代谢产物,而丁酸的增多,提高了宿主从饮食中吸收能量的能力,从而与肥胖的发生相关[17];变形菌是正常肠道中含量最少的菌类,其与感染性和非感染性炎症性肠道病[18]。另一方面,本研究中RYGB术后患者体重及糖脂代谢有明显改善,且效果稳定[20]。以上结果提示,肠道菌群结构的变化是胃旁路术有效降低体质量、改善糖脂代谢的可能机制。
本实验研究利用高通量的二代测序技术研究分析肠道菌群变化的结构,经过测序分析肠道全部细菌的16S rRNA基因序列,可全面获得包括常规被报道的高丰度细菌,也可发现低丰度细菌或未知细菌的准确信息,是目前最常用于研究细菌进化和分类的靶分子[19]。Shannon-Wiener曲线分析表明,此次测序的覆盖了胃旁路术前、后患者的肠道微生物,能够有效的反映其组成情况。
综上所述,本研究为探索性研究,虽样本例数较少,但为RYGB手术治疗肥胖2型糖尿病患者的可能机制提供了依据。随着研究的深入,若可明确肠道菌群对糖尿病患者的明确作用,采用肠道菌群移植的方式治疗未尝不是一种方法。
| [1] | International Diabetes Federation. IDF Diabetes Atlas Sixth edition poster update 2014[EB/OL].[2014-11-10]. http://www.idf.org/diabetesatlas/update-2014. |
| [2] | Yang WY, Lu JM, Weng JP, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090-101. DOI: 10.1056/NEJMoa0908292. |
| [3] | 潘雯, 宫建, 郑刚, 等. 中国内地减肥手术治疗肥胖型2型糖尿病的Meta分析[J]. 中国循证医学杂志, 2013, 13(4): 441-5. DOI: 10.7507/1672-2531.20130076. |
| [4] | Cummings DE, Weigle DS, Frayo RS, et al. Plasma ghrelin levels after diet-induced weight loss or gastric bypass surgery[J]. N Engl J Med, 2002, 346(21): 1623-30. DOI: 10.1056/NEJMoa012908. |
| [5] | Buchwald H, Avidor Y, Braunwald E. Bariatric surgery:a systematic review and meta-analysis[J]. JAMA, 2004, 292(14): 1724-37. DOI: 10.1001/jama.292.14.1724. |
| [6] | Papamargaritis D, Miras AD, Le Roux CW. Influence of diabetes surgery on gut hormones and incretins[J]. Nutr Hosp, 2013, 28(Suppl 2): 95-103. |
| [7] | Brethauer SA, Heneghan HM, Eldar S, et al. Early effects of gastric bypass on endothelial function, inflammation, and cardiovascular risk in obese patients[J]. Surg Endosc, 2011, 25(8): 2650-9. DOI: 10.1007/s00464-011-1620-6. |
| [8] | Furet JP, Kong LC, Tap J, et al. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss links with metabolic and low-grade inflammation marker[J]. Diabetes, 2010, 59(12): 3049-57. DOI: 10.2337/db10-0253. |
| [9] | Graessler J, Qin Y, Zhong H, et al. Metagenomic sequencing of the human gut microbiome before and after bariatric surgery in obese patients with type 2 diabetes:correlation with inflammatory and metabolic parameters[J]. Pharmacogenomics J, 2013, 13(6): 514-22. DOI: 10.1038/tpj.2012.43. |
| [10] | Angelakis E, Armougom F, Million M, et al. The relationship between gut microbiota and weight gain in humans[J]. Future Microbiol, 2012, 7(1): 91-109. DOI: 10.2217/fmb.11.142. |
| [11] | Ley R, Turnbaugh P, Klein S, et al. Human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-3. DOI: 10.1038/4441022a. |
| [12] | Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490(7418): 55-60. DOI: 10.1038/nature11450. |
| [13] | Karlsson FH, Tremaroli V, Nookaew I, et al. Gut metagenome in European women with normal, impaired and diabetic glucose control[J]. Nature, 2013, 498(7452): 99-103. DOI: 10.1038/nature12198. |
| [14] | Gill SR, Pop M, Deboy RT, et al. Metagenomic analysis of the human distal gut microbiome[J]. Science, 2006, 312(5778): 1355-9. DOI: 10.1126/science.1124234. |
| [15] | Nicholson JK, Holmes E, Wilson ID. Gut microorganisms, mammalian metabolism and personalized health care[J]. Nat Rev Microbiol, 2005, 3(5): 431-8. DOI: 10.1038/nrmicro1152. |
| [16] | Salyers AA. Bacteroides of the human lower intestinal tract[J]. Annu Rev Microbiol, 1984, 38(1): 293-313. DOI: 10.1146/annurev.mi.38.100184.001453. |
| [17] | Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-31. DOI: 10.1038/nature05414. |
| [18] | Lupp C, Robertson ML, Wickham ME, et al. Host-mediated inflammation disrupts the intestinal microbiota and promotes the overgrowth of Enterobacteriaceae[J]. Cell Host Microbe, 2007, 2(2): 119-29. DOI: 10.1016/j.chom.2007.06.010. |
| [19] | Nickel JC, Downey J, Johnston B, et al. Predictors of patient response to antibiotic therapy for the chronic prostatitis/chronic pelvic pain syndrome:a prospective multicenter clinical trial[J]. J Urol, 2001, 165(5): 1539-44. DOI: 10.1016/S0022-5347(05)66344-6. |
| [20] | Kootte RS, Vrieze A, Holleman F, et al. The therapeutic potential of manipulating gut microbiota in obesity and type 2 diabetes mellitus[J]. Diabetes Obes Metab, 2012, 14(2): 112-20. DOI: 10.1111/dom.2012.14.issue-2. |
| [21] | Mingrone G, Panunzi S, De Gaetano A, et al. Bariatric surgery versus conventional medical therapy for type 2 diabetes[J]. N Engl J Med, 2012, 366(17): 1577-85. DOI: 10.1056/NEJMoa1200111. |
| [22] | Graessler J, Qin Y, Zhong H, et al. Metagenomic sequencing of the human gut microbiome before and after bariatric surgery in obese patients with type 2 diabetes:correlation with inflammatory and metabolic parameters[J]. Pharmacogenomics J, 2013, 13(6): 514-22. DOI: 10.1038/tpj.2012.43. |
| [23] | Chang-Chen KJ, Mullur R, Bernal-Mizrachi E. Beta-cell failure as a complication of diabetes[J]. Rev Endocr Metab Disord, 2008, 9(4): 329-43. DOI: 10.1007/s11154-008-9101-5. |
| [24] | Speck M, Cho YM, Asadi A, et al. Duodenal-jejunal bypass protects GK rats from {β}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1[J]. Am J Physiol Endocrinol Metab, 2011, 300(5): E923-32. DOI: 10.1152/ajpendo.00422.2010. |
| [25] | 饶翀, 肖新华. 肠道菌群和脂代谢异常[J]. 中华临床医师杂志:电子版, 2016, 10(8): 1053-5. |
| [26] | Zhang H, Dibaise JK, Zuccolo A, et al. Human gut microbiota in obesity and after gastric bypass[J]. Proc Natl Acad Sci USA, 2009, 106(7): 2365-70. DOI: 10.1073/pnas.0812600106. |
| [27] | Li JV, Ashrafian H, Bueter M, et al. Metabolic surgery profoundly influences gut microbial-host metabolic cross-talk[J]. Gut, 2011, 60(9): 1214-23. DOI: 10.1136/gut.2010.234708. |
 2017, Vol. 37
2017, Vol. 37

