2. 西安交通大学医学部第一附属医院普通外科, 陕西 西安 710061;
3. 淄博市中心医院胃肠外科, 山东 淄博 255000
2. Department of General Surgery, First Affiliated Hospital, Xi'an Jiaotong University, Xi'an 710061, China;
3. Department of Gastrointestinal Surgery, Zibo Central Hospital, Shandong 255000, China
结直肠癌在世界范围内是第3大高发肿瘤,第4大致死肿瘤[1]。在世界范围内发病率均呈逐年上升的趋势。在我国,结肠癌的发病率和病死率也呈逐年上升的趋势[2]。尽管在诊断和治疗中取得一定进展,结直肠癌仍严重影响生命健康[3]。因此,寻找干预治疗的新靶向非常重要。
水分子在肿瘤的代谢及进展中发挥显著的作用[4-5]。水通道蛋白(AQPs)是具有分泌和吸收功能的上皮细胞运输水的一类水膜通道,某些亚型也参与其他分子的运输,如甘油和尿素,在哺乳动物中有13种AQP成员[6-7]。近年来AQPs在肿瘤发展中的作用受到越来越多的关注。已有的研究显示,AQPs在肿瘤细胞渗透压维持,调控肿瘤细胞迁移、细胞-基质粘附,促进肿瘤血管形成中扮演重要作用,AQPs还与癌基因、癌蛋白之间有着广泛的相互作用[8-9]。AQPs基于其特定的组织定位在几种类型肿瘤中表达有所不同,AQP1的表达通常与脑肿瘤相关[10]。在AQP3敲除小鼠的研究中,AQP3基因缺失诱导对致癌物诱导的皮肤肿瘤的抵抗[11]。通过AQP3进行的甘油转运有助于细胞增殖和肿瘤发生中ATP的生成[11]。AQP5在乳腺癌[12]、胃癌[13]、肝癌[14]、肺癌[15]、宫颈癌[16]中的高表达与淋巴转移及预后不良相关。我们既往发现AQP-5在结肠癌组织中表达增高,AQP5在结肠癌组织中的表达与肿瘤预后有关,这表明,AQP5过表达在结直肠肿瘤进展中发挥一定作用[17]。但AQP-5与结肠癌细胞生长及信号通路之间的关系尚不清楚。本研究选用针对AQP-5的siRNA,观察其对结直肠癌细胞增殖及凋亡的影响,探讨AQP-5在结肠癌治疗过程中的可能作用及其调节机制。
1 材料和方法 1.1 材料人结直肠癌细胞株COLO 205和SW480购自美国ATCC公司。DMEM培养液购自美国GIBCO公司,小牛血清购自中美合资兰州民海生物公司,抗AQP-5、Bcl-2、Bax和β-actin抗体均购自Santa Cruz生物公司,Annexin V-FITC和碘化丙啶(PI)。
1.2 细胞培养和处理人结直肠癌癌细胞株COLO 205和SW480使用添加10%灭活的胎牛血清的DMEM高糖培养基培养于37 ℃、5% CO2的培养箱中。细胞融汇程度到达80%前给予处理。细胞贴壁生长,每2~3 d传代1次。取对数生长期细胞进行试验。
1.3 AQP-5-siRNA转染设计合成AQP-5特异性小干扰RNA(AQP-5-siRNA)序列,siRNA #1顺义链:5'-AAAACTCTGCGAACACGGCCCCTGTCTC3',反义链:5'-AAGGCCGT GTTCGCAGAGTTCCTGTCTC-3';siRNA #2顺义链:5'-AAGAGCAGCCAGTGAAGTAGACCTGTCTC-3',反义链:5'-AATCTACTTCACTGGCTGCTCCCTGTCTC-3'。无关对照siRNA(NS-siRNA)序列为:5'-GGUCUCACUCCCCAUAGAGTT-3'。转染前24 h于6孔板中接种细胞,密度为4×105/mL。转染前用无血清无抗生素的DMEM/F12清洗细胞,经脂质体介导法,按照试剂说明书用无血清无抗生素的DMEM/F12培养基稀释AQP-5-siRNA混合物或对照NS-siRNA和相应比例转染试剂LipofectamineTM2000,两种稀释液混合形成复合物后,将其转染细胞。转染24 h后,检测转染效率及其他分子表达的情况。实验分组为:正常培养的COLO 205和SW480细胞(对照组)、转染NS-siRNA的COLO 205和SW480细胞(NS-siRNA组)和转染AQP-5-siRNA的COLO 205和SW480细胞(AQP-5-siRNA组)。
1.4 细胞增殖实验用MTT法检测细胞增殖。于96孔板内接种5×103细胞,加入200 µL培养基培养过夜,转染后培养24 h,后加入MTT试剂(5 mg/mL用PBS配制,pH=7.4)10 µL。孵育4 h后弃去上清液,每孔加入150 μL二甲基亚枫,振荡10 min,使结晶物充分融解。选择490 nm波长,在酶联免疫监测仪上测定各孔吸光度,记录结果,以时间为横坐标,吸光度为纵坐标绘制细胞生长曲线。实验重复3次。
1.5 流式细胞术检测细胞凋亡按照Annexin V-FITC/PI凋亡检测试剂盒说明书程序检测细胞凋亡。6孔培养板内每孔加入105细胞,24 h后弃去培养基,用PBS冲洗1次,转染后孵育24 h消化离心,Annexin V和碘化丙啶避光染色15 min,流式细胞仪检测样本的凋亡率。
1.6 TUNEL法转染细胞24 min后,4%多聚甲醛固定30 min,3% H2O2灭活内源性的过氧化物酶以抑制非特异性的显色反应。玻片内滴加末端脱氧核苷酸转移酶(TdT)37 ℃湿盒内孵育1 h用于原位结合DNA片段。DAB进行染色,苏木精复染。显微镜下观察照相。每组观察10个高倍视野计数取平均值进行比较。
1.7 RT-PCR用TRIzol试剂提取细胞的总RNA。取2 μg RNA用RevertAid试剂盒合成第一条cDNA链。PCR引物设计:Bcl-2(376 bp)上游引物:5'-CCGGGAGATCGTGATGAAGT-3',下游引物:5'-ATCCCAGCCTCCGTTATCCT-3';Bax(284 bp)上游引物:5'-CCAAGAAGCTGAGCGAGTGTC-3',下游引物:5'-TGAGGACTCCAGCCACAAAGA-3';β-actin(179 bp)上游引物:5'-ATCGTGCGTGACATTAAGGAGAAG-3',下游引物:5'-AGGAAGGAAGGCTGGAAGAGTG-3'。PCR反应条件:首先在42 ℃反应1 h用于cDNA的合成,随后94 ℃变性5 min,再进行22个以下循环:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s。最后一个循环之后,进行最终的扩增反应:72 ℃ 10 min。管家基因β-actin用作内参照。应用Quantity One软件多结果进行灰度值分析。
1.8 Western blotting取5×105对数生长期细胞中加入0.5 mL预冷细胞裂解缓冲液冰上孵育30 min。离心收集上清,并测定蛋白含量,10% SDS-PAGE凝胶电泳分离蛋白,目的蛋白半干转到硝化纤维膜上。后用含5%脱脂牛奶TBST进行封闭,后一抗4 ℃孵育过夜,次日用1:2000辣根过氧化物酶(HRP)结合的二抗(Santa Cruz)室温孵育2 h后用增强型化学发光试剂盒(NJ)进行显色,照相并应用Quantity One软件多结果进行灰度值分析。
1.9 统计学分析每个实验重复3次以上。数据用Mean±SD表示,利用SPSS 23.0软件进行数据处理,采用Student's t-检验或方差分析(ANOVA)进行具体处理分析。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 AQP-5-siRNA转染率及对AQP-5表达的影响人工合成AQP-5小干扰RNA(AQP-5-siRNA)转染COLO 205和SW480细胞,同时转染NS-siRNA的细胞作为阴性对照。免疫荧光结果显示转染率为90%。Western blotting结果显示,NS-siRNA组细胞中AQP-5高表达,而AQP-5-siRNA组COLO 205和SW480细胞AQP-5的表达显著下降(P < 0.05),表明本研究所用的AQP-5-siRNA能高效抑制细胞中AQP-5的表达。NSsiRNA组与对照组相比,AQP-5的表达差异没有统计学意义(P > 0.05,图 1)。
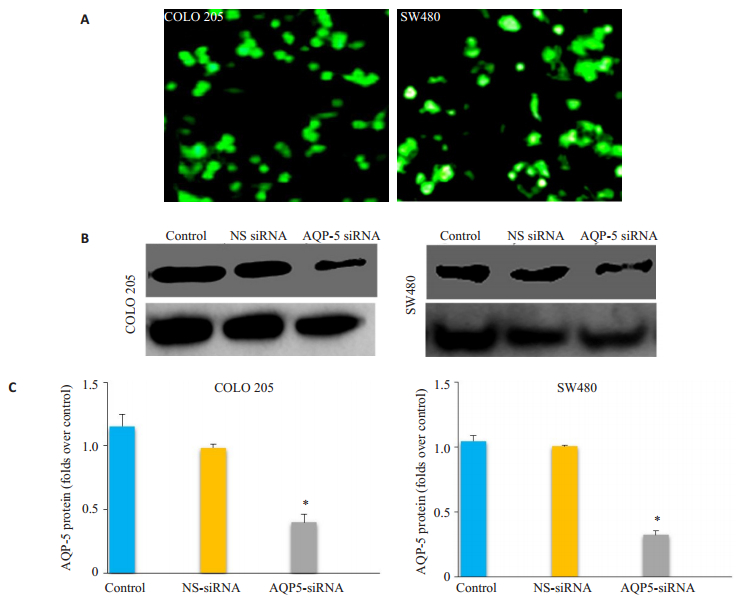
|
图 1 AQP-5-siRNA转染情况 Figure 1 Transfection efficiency of AQP-5-siRNA. A: Immunofluorescence showing the transfection efficiency of AQP-5-siRNA in COLO 205 and SW480 cells. B: Determination of AQP-5 expression in control, AQP-5-siRNA-transfected, and NS-siRNA-transfected cells usingWestern blotting. C: Statistical analysis of AQP expressions relative to that in control cells. *P < 0.05 by t-test (Con vs AQP5 siRNA, NS siRNA vs AQP5 siRNA). |
MTT检测转染AQP-5-siRNA和NS-siRNA的COLO 205和SW480细胞增殖活力改变,与NS-siRNA组相比,AQP-5-siRNA组的COLO 205和SW480细胞增殖抑制率显著增加(P < 0.05),提示抑制AQP-5的表达可抑制COLO 205和SW480细胞增殖。NS-siRNA组与对照组相比,增殖抑制率差异没有统计学意义(P > 0.05,图 2)。
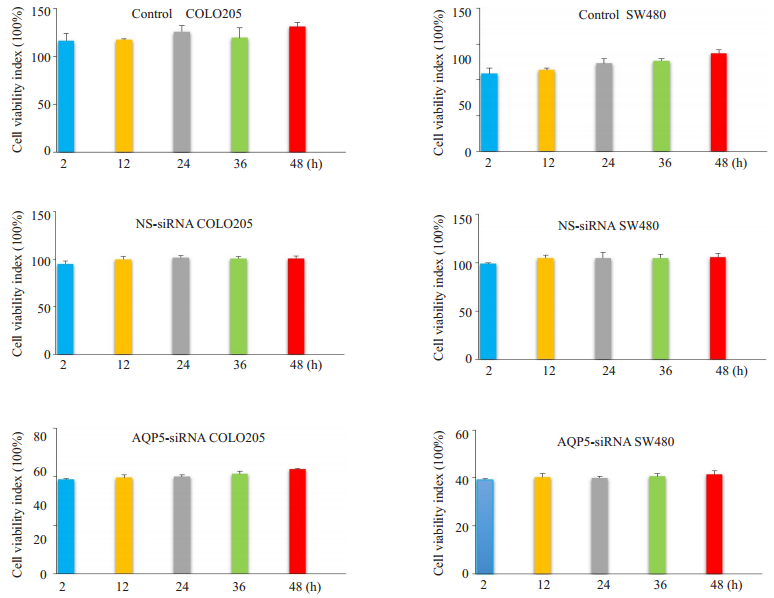
|
图 2 AQP-5-siRNA减弱细胞活力 Figure 2 Reduction of cell viability by AQP-5-siRNA.The cell viability of control, AQP-5-siRNA-transfected, and NS-siRNAtransfected cells was assessed using MTT assay at 2, 12, 24, 36, and 48 h after AQP-5-siRNA and non-specific control siRNA (NS-siRNA) transfection in COLO 205 and SW480 cells. |
为了探讨AQP-5-siRNA抑制细胞增殖是否由凋亡引起,首先用流式细胞仪检测COLO 205和SW480凋亡变化情况。结果显示:与对照组相比,AQP-5-siRNA转染能显著增加凋亡细胞的比例(P < 0.05,图 3)。
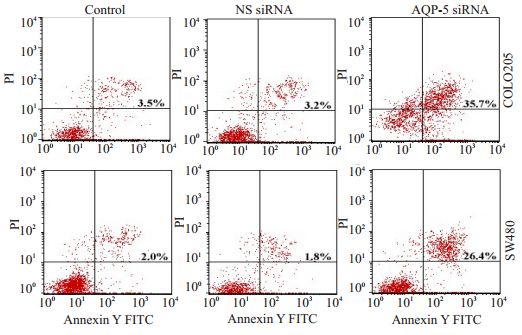
|
图 3 流式细胞法显示AQP-5-siRNA转染促进细胞凋亡 Figure 3 AQP-5-siRNA transfection promotes apoptosis of COLO 205 and SW480 cells as analyzed by flow cytometry. The apoptotic rate of samples measured by flow cytometry 24 h after AQP-5-siRNA and non-specific control siRNA (NS-siRNA) transfection. The transfection with AQP-5-siRNA significantly increased the percentage of apoptotic cells (P < 0.05). |
为了进一步证实这种现象,随后又用TUNEL法进行检测。与流式细胞仪得出结果一致,AQP-5-siRNA转染能显著提升细胞凋亡(图 4、表 1)。
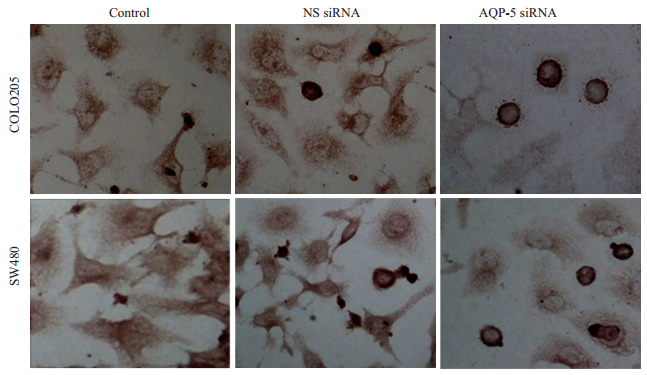
|
图 4 TUNEL assay显示AQP-5-siRNA转染促进细胞凋亡 Figure 4 Apoptosis of COLO 205 and SW480 cellsfollowing AQP-5-siRNA transfection observed with TUNEL assay. The number of apoptotic cells following AQP-5-siRNA transfection was significantly higher than that of the control cells and NS-siRNA-transfected cells. |
Bax和Bcl-2分别是促凋亡蛋白和抗凋亡蛋白,为了探讨AQP-5-siRNA转染是否影响Bax/Bcl-2表达,用RT-PCR和Western blot方法对其mRNA及蛋白水平进行了检测,结果显示AQP-5-siRNA转染处理后COLO 205和SW480细胞中Bax/Bcl-2mRNA及蛋白水平与对照组相比显著上调(图 5、6)。
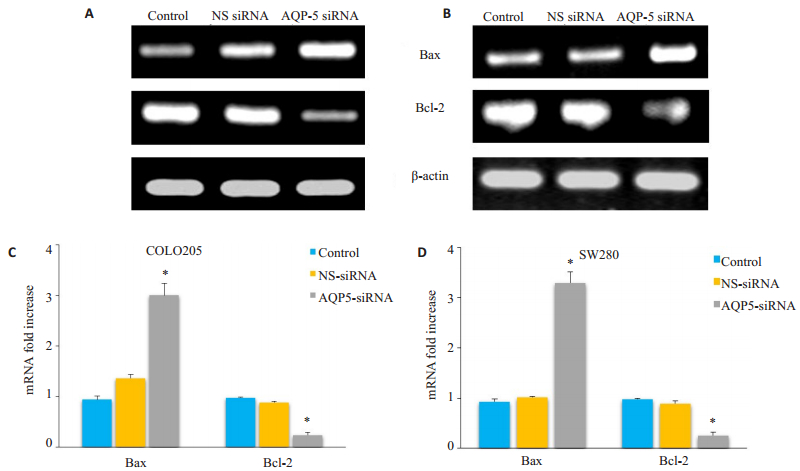
|
图 5 QP-5-siRNA转染影响Bax/Bcl-2 mRNA表达 Figure 5 AQP-5-siRNA transfection significantly increased mRNA expression of Bax and Bcl-2 inCOLO 205 and SW480 cells. A and B: The mRNA expression of Bax and Bcl-2 in control COLO 205 and SW480 cells, AQP-5-siRNA-transfected COLO 205 cells, and NS-siRNA-transfected COLO 205 cells determined using RT-PCR. C and D: Results of statistical analysis. The results relative to control cells are presented as a standard ratio. *P < 0.05 by t-test (Con vs AQP5 siRNA, NS siRNA vs AQP5 siRNA). |
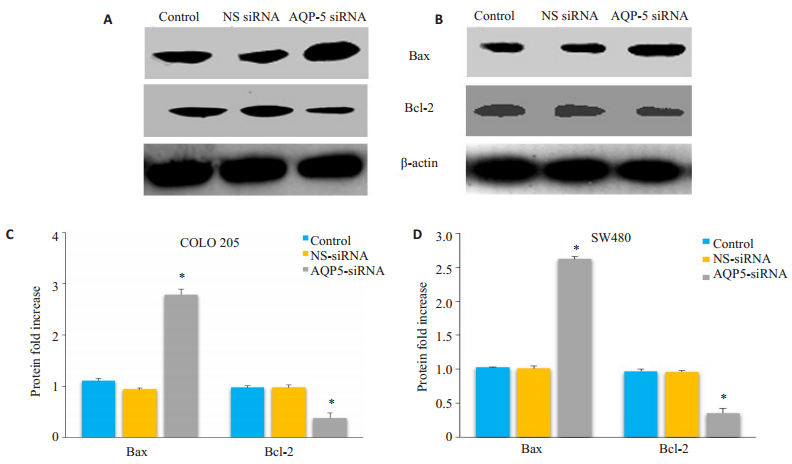
|
图 6 QP-5-siRNA转染Bax/Bcl-2蛋白表达 Figure 6 AQP-5-siRNA transfection significantly increased the protein expression of Bax and Bcl-2 in COLO 205 and SW480 cells. A and B: Expression of Bax/Bcl-2 in control COLO 205 and SW480 cells, AQP-5-siRNA-transfected COLO 205 cells, and NS-siRNA-transfected COLO 205 cells determined by Western blotting. C and D: Results of statistical analysis. The results relative to the control cells are presented as a standard ratio. *P < 0.05 by t-test (Con vs AQP5 siRNA, NS siRNA vs AQP5 siRNA). |
AQPs是广泛存在于原核和真核生物细胞膜、高效选择性转运水分子的特异通道[18]。肿瘤是机体在各种致瘤因素的作用下,细胞在基因水平上失去其生长的正常调控,导致新生物生成的过程。肿瘤所依赖的各种代谢都需要水分子的参与,而水通道蛋白可以快速特异的转运水分子[19]。AQP1-12广泛表达于发生体液吸收及分泌的器官及组织,同时也表达于脑、皮肤、脂肪、肝脏等不发生体液转运的器官及组织[20]。它参与肾脏对水的重吸收,腺体的分泌、小肠脂肪吸收,参与气血屏障、血脑屏障、脑脊液形成[20]。参与应激反应,组织损伤、感染及肿瘤形成过程[19]等。AQPs基于其特定的组织定位在几种类型肿瘤中表达有所不同,AQP1的表达通常与脑肿瘤相关[10]。在AQP3敲除小鼠的研究中,AQP3基因缺失诱导对致癌物诱导的皮肤肿瘤的抵抗[11]。通过AQP3进行的甘油转运有助于细胞增殖和肿瘤发生中ATP的生成[11]。AQP5在乳腺癌[12]、胃癌[13]、肝癌[14]、肺癌[15]、宫颈癌[16]中的高表达与淋巴转移及预后不良相关。本研究结果显示结直肠癌细胞中AQP5表达上调。此外,沉默AQP5可增强细胞凋亡。这些研究结果扩展了我们对AQP5作为诊断指标作用的理解。
水通道蛋白在维持水平衡和调节多种病理生理过程中发挥关键的作用[21],AQP5,21~24 ku蛋白,最初被认是为细胞膜小窝的主要结构蛋白、参与致癌转化和恶性进展的关键分子[22-23]。AQP5促进肿瘤进展具体作用机制还不完全明确。已有的研究显示APQ5高表达可以促进细胞增殖,抑制细胞凋亡,重置细胞周期,促进上皮间质转换及细胞迁移[24]。
上述的AQP5改变肿瘤生物学行为可能是在几条导致细胞转化的信号通路中起调节作用,包括由Src家族酪氨酸激酶、表皮生长因子受体、Wnt信号和Erk1/2介导的信号转导[24-26]。
结直肠癌中AQP5的临床意义尚未有定论,我们的研究结果表明体外抑制AQP5表达可促进结直肠癌细胞凋亡,其机制可能与Bax/Bcl表达有关。本研究中检测到的结直肠组织中AQP5表达谱与以前研究结果相一致[17]。此外,我们分析了AQP5的与结直肠癌临床病理特征的相关性,结果表明,AQP5在肿瘤组织中表达显著高于癌旁及正常粘膜组织,且AQP5表达与较高TNM分期、淋巴结转移及远处转移相关,此外AQP5表达还与患者外周血中循环肿瘤细胞数量相关[17]。本研究初步证实了AQP5在结直肠癌中可能的作用地位,具体AQP5通过何种机制影响结直肠癌进展,有必要在细胞分子生物学及动物实验中进一步探讨研究,这也是课题组下一步的方向。
总之,本阶段研究提示AQP5蛋白在结直肠癌中表达上调,与高TNM分期、淋巴结转移和不良预后紧密相关。因此,AQP5可作为结直肠癌侵袭和转移的新的生物标志物。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262. |
| [2] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32. DOI: 10.3322/caac.21338. |
| [3] | Favoriti P, Carbone G, Greco M, et al. Worldwide burden of colorectal cancer:a review[J]. Updates Surg, 2016, 68(1): 7-11. DOI: 10.1007/s13304-016-0359-y. |
| [4] | Koontongkaew S. The tumor microenvironment contribution to development, growth, invasion and metastasis of head and neck squamous cell carcinomas[J]. J Cancer, 2013, 4(1): 66-83. DOI: 10.7150/jca.5112. |
| [5] | Sekine S, Shimada Y, Nagata T, et al. Prognostic significance of aquaporins in human biliary tract carcinoma[J]. Oncol Rep, 2012, 27(6): 1741-7. |
| [6] | Ishibashi K, Tanaka Y, Morishita Y. The role of mammalian superaquaporins inside the cell[J]. BiochimBiophysActa, 2014, 1840(5): 1507-12. |
| [7] | Benga G. On the definition, nomenclature and classification of water Channel proteins (aquaporins and relatives)[J]. Mol Aspects Med, 2012, 33(5/6): 514-7. |
| [8] | Papadopoulos MC, Saadoun S. Key roles of aquaporins in tumor biology[J]. BiochimBiophysActa, 2015, 1848(10 Pt B): 2576-83. |
| [9] | Verkman AS, Hara-Chikuma M, Papadopoulos MC. Aquaporins——new players in cancer biology[J]. J Mol Med (Berl), 2008, 86(5): 523-9. DOI: 10.1007/s00109-008-0303-9. |
| [10] | Wang D, Owler BK. Expression of AQP1 and AQP4 in paediatric brain tumours[J]. J ClinNeurosci, 2011, 18(1): 122-7. |
| [11] | Hara-Chikuma M, Verkman AS. Prevention of skin tumorigenesis and impairment of epidermal cell proliferation by targeted aquaporin-3 gene disruption[J]. Mol Cell Biol, 2008, 28(1): 326-32. DOI: 10.1128/MCB.01482-07. |
| [12] | Lee SJ, Chae YS, Kim JG, et al. AQP5 expression predicts survival in patients with early breast cancer[J]. Ann SurgOncol, 2014, 21(2): 375-83. |
| [13] | Shen L, Zhu Z, Huang Y, et al. Expression profile of multiple aquaporins in human gastric carcinoma and its clinical significance[J]. Biomed Pharmacother, 2010, 64(5): 313-8. DOI: 10.1016/j.biopha.2009.12.003. |
| [14] | Guo X, Sun T, Yang M, et al. Prognostic value of combined aquaporin 3 and aquaporin 5 overexpression in hepatocellular carcinoma[J]. Biomed Res Int, 2013, 2013: 206525. |
| [15] | Chae YK, Woo J, Kim MJ, et al. Expression of aquaporin 5(AQP5) promotes tumor invasion in human Non small cell lung cancer[J]. PLoS One, 2008, 3(5): e2162. DOI: 10.1371/journal.pone.0002162. |
| [16] | Zhang T, Zhao C, Chen D, et al. Overexpression of AQP5 in cervical cancer:correlation with clinicopathological features and prognosis[J]. Med Oncol, 2012, 29(3): 1998-2004. DOI: 10.1007/s12032-011-0095-6. |
| [17] | Shan T, Cui X, Li W, et al. AQP5:a novel biomarker that predicts poor clinical outcome in colorectal cancer[J]. Oncol Rep, 2014, 32(4): 1564-70. DOI: 10.3892/or.2014.3377. |
| [18] | Abascal F, Irisarri I, Zardoya R. Diversity and evolution of membrane intrinsic proteins[J]. BiochimBiophysActa, 2014, 1840(5): 1468-81. |
| [19] | Ribatti D, Ranieri G, Annese T, et al. Aquaporins in cancer[J]. BiochimBiophysActa, 2014, 1840(5): 1550-3. |
| [20] | Ishibashi K, Hara S, Kondo S. Aquaporin water channels in mammals[J]. ClinExpNephrol, 2009, 13(2): 107-17. |
| [21] | McCoy E, Sontheimer H. Expression and function of water channels (aquaporins) in migrating malignant astrocytes[J]. Glia, 2007, 55(10): 1034-43. DOI: 10.1002/(ISSN)1098-1136. |
| [22] | Jung HJ, Park JY, Jeon HS, et al. Aquaporin-5:a marker protein for proliferation and migration of human breast cancer cells[J]. PLoS One, 2011, 6(12): e28492. DOI: 10.1371/journal.pone.0028492. |
| [23] | Zhang Z, Chen Z, Song Y, et al. Expression of aquaporin 5 increases proliferation and metastasis potential of lung cancer[J]. J Pathol, 2010, 221(2): 210-20. DOI: 10.1002/path.2702. |
| [24] | Direito I, Madeira A, Brito MA, et al. Aquaporin-5:from structure to function and dysfunction in cancer[J]. Cell Mol Life Sci, 2016, 73(8): 1623-40. DOI: 10.1007/s00018-016-2142-0. |
| [25] | Choi JH, Wu HG, Jung KC, et al. Apoptosis and expression of AQP5 and TGF-beta in the irradiated rat submandibular gland[J]. Cancer Res Treat, 2009, 41(3): 145-54. DOI: 10.4143/crt.2009.41.3.145. |
| [26] | Woo J, Lee J, Kim MS, et al. The effect of aquaporin 5 overexpression on the Ras signaling pathway[J]. BiochemBiophys Res Commun, 2008, 367(2): 291-8. DOI: 10.1016/j.bbrc.2007.12.073. |
 2017, Vol. 37
2017, Vol. 37

