2. 南方医科大学南方医院健康管理科, 广东 广州 510515;
3. 南方医科大学细胞生物学教研室, 广东 广州 510515;
4. 南方医科大学第三附属医院, 广东省骨科研究院, 广东 广州 510630
2. Department of Health Management, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Southern Medical University, Department of Cell Biology, Southern Medical University, Guangzhou 510515, China;
4. Academy of Orthopedics of Guangdong Province, Third Affiliated Hospital, Southern Medical University, Guangzhou 510630, China
哺乳动物的精子发生过程既是一个循序渐进过程,又是一个复杂多变的细胞动态分化过程[1]。由初级精母细胞开始,经过减数分裂,并且伴随着一系列的形态变化,最终形成成熟精子的过程称为精子发生。睾丸支持细胞是生精小管中唯一与生精细胞直接接触的体细胞,它不仅起着结构支持作用,更起着营养与调节的作用[2]。睾丸支持细胞最具代表性的特征是形成血睾屏障,它是精母细胞进行减数分裂以及精子正常发生过程的重要保障[3-4],而精子发生障碍是导致男性不育症的重要病因[5-6]。
哺乳动物雷帕霉素靶蛋白(mTOR)是一种高度保守的丝/苏氨酸蛋白质激酶。机体中存有两种mTOR复合物,分别为mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)[7]。由于mTORC2与mTORC1接受不同的上游信号,调节不同的生理功能。mTORC1由mTOR、Raptor、mLST8、Deptor、PRAS40组成,mTORC2由mTOR、Rictor、mLST8、mSin1、PRR5组成;mTORC1活性被雷帕霉素特异性抑制,mTORC2活性不受雷帕霉素抑制;mTORC1主要功能是调控蛋白质的合成与代谢、核糖体的生物合成、基因的转录以及自噬过程等,mTORC2的主要功能是调节细胞的骨架结构。早有研究证明mTOR在精子发生中发挥重要作用[8],而且mTORC1在精子发生中起着重要的调控作用,但mTORC2在血睾屏障形成和精子发生中的作用尚不明了[9-10]。Rictor是mTORC2的重要组员,关于Rictor蛋白的结构及各结构域作用的研究尚少,其上下游调节的作用机制也不完善[11]。最近有研究发现Rictor与血睾屏障相关蛋白如Occludin、ZO-1和actin等表达定位高度一致[12]。但是,该研究并未报道体内Rictor表达异常对睾丸功能和雄鼠生殖能力的影响,也缺乏充足的动物实验进一步阐明Rictor/mTORC2对血睾屏障和精子发生的调控功能和机制[12]。
因此,mTORC2在维持睾丸支持细胞结构与功能和精子发生中的作用与机制需要进一步深入研究。本文成功构建睾丸支持细胞特异性rictor敲除小鼠,从整体、细胞与分子水平研究mTORC2在睾丸血睾屏障形成、睾丸发育和精子发生与成熟中的作用,并探讨mTORC2调控血睾屏障形成和精子发生的分子机制,为精子发生的调控机制提供新内容,为精子发生障碍相关疾病的防治提供依据和潜在靶点。
1 材料和方法 1.1 实验动物及其繁殖Amh-Cre小鼠(品系号:007915)购自于南京大学;rictor-loxP小鼠获赠于范德堡大学的Mark A. Magnuson教授。用于保种繁殖用的野生型C57雌鼠购于南方医科大学实验动物中心。本研究所有动物实验均通过南方医科大学动物实验伦理委员会审查通过,并严格按照伦理操作规范进行。
应用Cre-loxP作用原理,构建睾丸支持细胞特异性敲除rictor小鼠。即Amh-Cre阳性小鼠与rictor-loxP纯合小鼠交配,产生Amh-Cre阳性、rictor-loxP为杂合子的F1代小鼠(Amh-Cre+,rictorloxP/-),再将F1代小鼠与rictor-loxP纯合小鼠回交,产生Amh-Cre阳性、rictor-loxP为纯合子的F2代雄鼠(Amh-Cre+,rictorloxP/loxP),此小鼠便在睾丸支持细胞中特异性敲除rictor基因,即cKO敲除鼠。同时,与敲除鼠同窝出生的Amh-Cre阴性、rictor-loxP为纯合子/杂合子的F2代雄鼠(Amh-Cre-,rictorloxP/loxP/rictorloxP/-)将作为对照鼠(Con)。
1.2 实验动物基因型鉴定取2周龄左右仔鼠,用眼科剪剪下尾巴尖部约3 mm长的组织,置于200 μL鼠尾裂解液中于55 ℃水浴过夜。裂解完成后,96 ℃煮10 min,以灭活蛋白酶K。12 000 r/min离心5 min,取上清,上清即为DNA模板。PCR反应按照Jackson实验室的说明进行。小鼠基因型鉴定所用的引物序列如下:Amh-F: 5'-ATTTGCCTGCATTACCGGTC-3',Amh-R: TCGG-3';Rictor-F: 5'-GAAGTTATTCAGATGGCCCAGC-3';rictor-R: 5'-ACTGAATATGTTCATGGTTGTG-3'。PCR反应结束后,取10 μL PCR产物进行琼脂糖凝胶电泳,凝胶浓度为2%。Amh-Cre的PCR产物为350 bp,rictor-loxP的PCR产物分别为554 bp和466 bp,分别对应纯合和野生两种基因型。
1.3 免疫组化/免疫荧光/苏木素-伊红染色(IHC/IF/HE)以IHC为例,其他组化方法原理类似。剪取新鲜睾丸组织,置MDF固定液中摇床固定20~22 h,PBS冲洗固定的组织10 min,常规脱水、透明、浸蜡、包埋、切片。挑取切面完好的石蜡切片,65 ℃烤箱中烤片50 min,常规脱蜡水化。PBS冲洗,0.01 mol/L枸橼酸缓冲液(pH=6.0)中进行高压热修复,自然冷却至室温。PBS冲洗,3% H2O2溶液灭活内源性过氧化物酶。PBS冲洗,正常山羊血清专用封闭液室温孵育40 min。4 ℃过夜孵育一抗。PBS冲洗,37 ℃孵育二抗1 h。PBS冲洗后显色,于显微镜下观察染色状态,以掌握合适的染色度,及时自来水终止反应。滴加苏木精复染液,蒸馏水冲洗,常规脱水、透明、封片。
1.4 蛋白免疫印迹(Western blot)制备好的样品经BCA测定蛋白浓度,加样,进行6%~12%的SDS-PAGE凝胶电泳1.5~2 h(恒流,16 mA/ gel)。将SDS-聚丙烯酰胺凝胶电泳分离的蛋白用BioRad微型电转移系统,于冰上转移至硝酸纤维素膜上。转膜结束后,封闭缓冲液室温下封闭1 h。TBST洗膜3次,5 min/次。按特定的稀释浓度加入目的蛋白的特异性一抗,4 ℃孵育过夜。TBST洗膜3次,5 min/次。加入特定稀释浓度的HRP标记的羊抗小鼠或山羊抗兔二抗,室温下孵育1 h。TBST振荡洗膜3次,5 min/次。硝酸纤维素膜稍沥干后加入化学发光试剂,室温孵育1 min左右,迅速用保鲜膜包好后置于暗盒内与X胶片贴在一起进行曝光。X胶片经显影、定影后晾干,图片扫描后保存。
1.5 细胞周期检测小鼠麻醉后,取单侧睾丸于PBS培养皿中,去被膜。PBS洗2遍,置于含PBS消化液中(0.5 mg/mL胶原酶Ⅳ,2%小牛血清),37 ℃、5% CO2孵箱中孵育15~ 20 min,每隔3~5 min摇动消化液。组织团块消化为生精小管时,停止消化,PBS清洗2遍。生精小管置PBS消化液中(0.1 mg/mL DNA酶Ⅰ,0.25%胰蛋白酶)消化3~5 min,移液器吹散生精小管为单细胞悬液。加等体积的胎牛血清,终止消化,1000 r/min离心5 min。PBS清洗细胞团块2次。微量PBS重悬细胞,缓慢加入70%冰乙醇固定细胞,4 ℃过夜。固定好的细胞,PBS清洗2遍。500 μL PBS混合液(50 μg/mL PI,100 μg/mL RNAase,0.2%Triton)重悬细胞,4 ℃避光孵育30 min。直接上流式机检测。
1.6 统计学处理与分析所有都实验都经过至少3次重复和证实。当实验结果以数值表示时,数据以均数±标准差表示。应用SPSS16.0进行数据的统计学分析,两组之间的差异比较用独立样本t检验。P < 0.05表示组间差异有统计学意义。
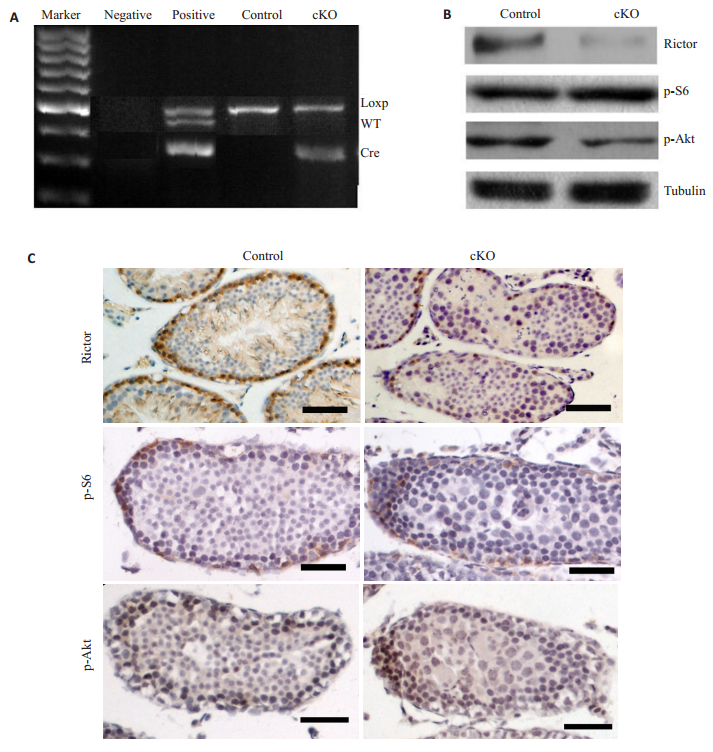
2 结果 2.1 rictor敲除鼠的敲除效果鉴定应用Cre-loxP原理,构建睾丸支持细胞特异性敲除rictor小鼠。仔鼠出生后约3周时,提取尾巴组织DNA,通过PCR反应扩增后进行琼脂糖凝胶电泳,根据PCR产物的条带数量和大小确定小鼠基因型(图 1A)。Western blot和IHC检测对照鼠和敲除鼠的Rictor、p-S6(Ser235/236)和p-Akt(Ser473)表达。结果显示,与对照鼠相比,敲除鼠Rictor表达量明显降低,p-S6(Ser235/ 236)没有显著差异,p-Akt(Ser473)表达下降(图 1B~C)。
|
图 1 敲除鼠基因型鉴定及敲除效果确定 Figure 1 Genotyping of the offspring mice and examination of the effect of gene knockout. A: Genotyping results; B, C: Immunoblotting and immunofluorescent staining for Rictor, p-Akt (S473), and p-Akt (S473) in the testes Scale bar=25 μm. |
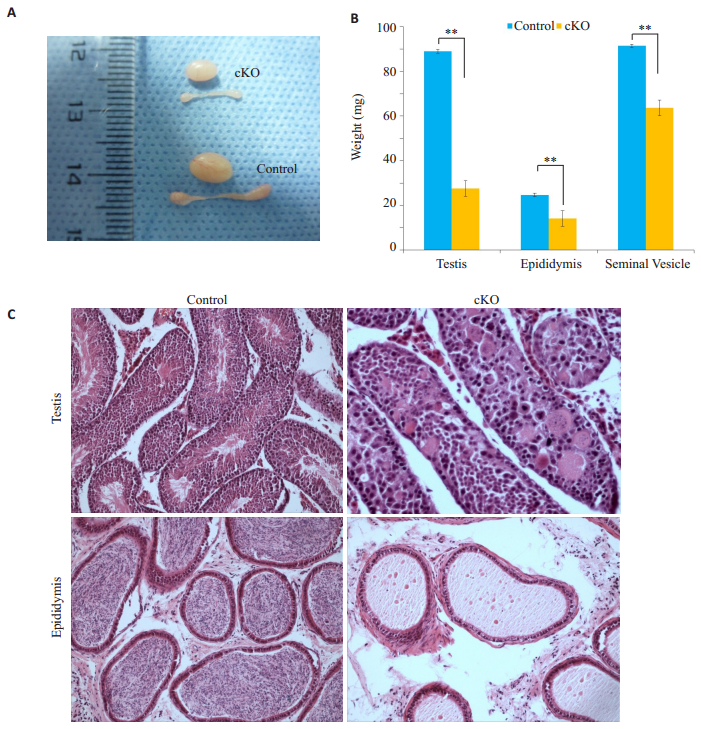
从目测即可辨别,敲除鼠生殖器官显著小于对照鼠,包括睾丸和附睾(图 2A)。从质量上分析,敲除鼠睾丸质量显著低于对照鼠睾丸(27.6±3.4 mg vs 89.0±0.8 mg,P < 0.01),仅相当于对照鼠的1/3;敲除鼠附睾质量也是显著低于对照鼠附睾(14.0±1.6 mg vs 24.7±1.1 mg,P < 0.01,图 2B)。小鼠睾丸和附睾组织切片经HE染色后发现,与对照鼠相比,敲除鼠生精小管形态异常,主要表现在生精小管内腔消失、精子细胞缺失、细胞聚团,以及空泡形成(图 2C);同时,对照鼠附睾中存有大量形态正常的正常精子,而敲除鼠附睾中却完全没有正常精子存在,只有少许圆形细胞碎片残留(图 2C)。
|
图 2 敲除鼠与对照鼠的表型变化 Figure 2 Changes of the control and rictor-knockout (cKO) mice. A: Gross observation of the testes and epididymis of the control and cKO mice; B: Comparison of body weight (BW) and the weights of testis, epididymis, and seminal vesicle (SV) between control and cKO mice (**P < 0.01); C: Histological changes in seminiferous tubules and epididymis in control and cKO mice (HE, ×20). |
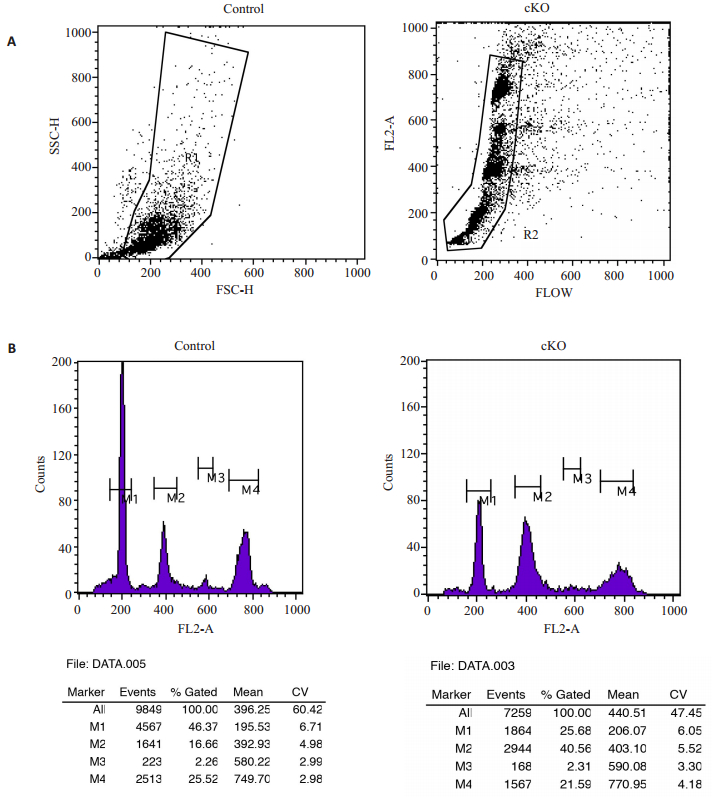
分别取对照鼠和敲除鼠生精小管,如实验方法所述,即消化为单细胞悬液后,用碘丙酰(PI)染色所有细胞DNA,用流式细胞仪检测细胞周期(图 3A),结果显示,与对照鼠相比,敲除鼠生精小管中四倍体细胞无显著变化(P > 0.05),而二倍体细胞显著上升(P < 0.01),单倍体细胞显著下降(P < 0.01,图 3B)。
|
图 3 流式细胞技术检测对照鼠和敲除鼠生精小管中全部细胞DNA周期 Figure 3 Flow cytometry analysis of the subgroups in the germ cells of the control and cKO mice. A: Cell sub-groups of the germ cells after propidium iodide labeling based on flow cytometry; B: Flow cytometry analysis of DNA content in germ cells after propidium iodide labeling: M1: Haploid cells; M2: Diploid cells; M3: Triploid; M4: Tetraploid cells. |
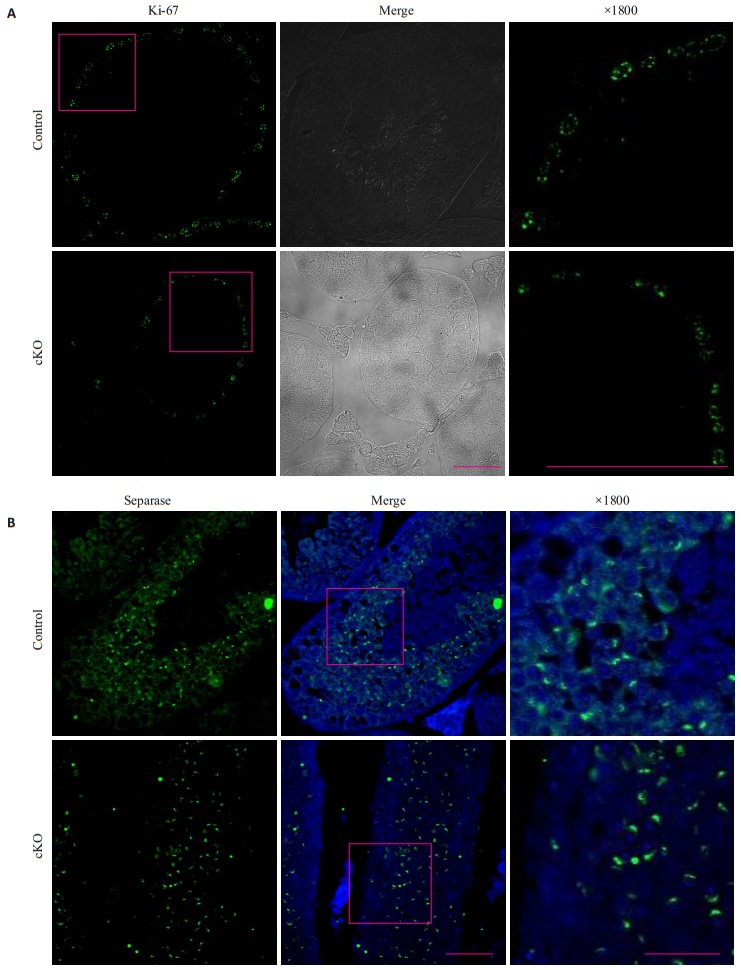
同时,IF法检测增殖蛋白(Ki-67)和分离酶蛋白表达,IF法检测两种蛋白的表达,其表达特异性较高。结果显示,对照鼠和敲除鼠相同,Ki-67在生精小管基底膜处精原细胞增殖区表达(图 4A);分离酶蛋白特异性表达在生精小管中部,即减数分裂较活跃的部位高表达(图 4B),而且两者蛋白的荧光表达量也没有显著差异。
|
图 4 对照鼠与敲除鼠(A)Ki-67和(B)Separase的IF表达图 Figure 4 Immunofluorescence assay of Ki-67 (A) and separase (B) in the testes of control and cKO mice. The cell nuclei were stained blue by DAPI staining, and the target proteins were stained green. Scale bar=25 μm for the first two panels and 10 μm for the last panels. |
IHC法标记若干BTB相关蛋白表达,这些蛋白包括紧密连接相关标志蛋白(ZO-2);beta-连接素(β-catenin)和N-钙粘附蛋白(N-cadherin)。结果显示,在对照鼠生精小管中,3种蛋白均特异性分布在生精上皮基底膜处,均匀而规则。相比之下,敲除鼠生精小管的上述蛋白表达均分布在整个生精小管,杂乱无章,且有向中间管腔部位集中的趋势(图 5A)。此外,Western blot检测对照鼠和敲除鼠中生精小管上述蛋白的表达量,结果显示,3种蛋白的表达量均无显著差异(图 5B)。
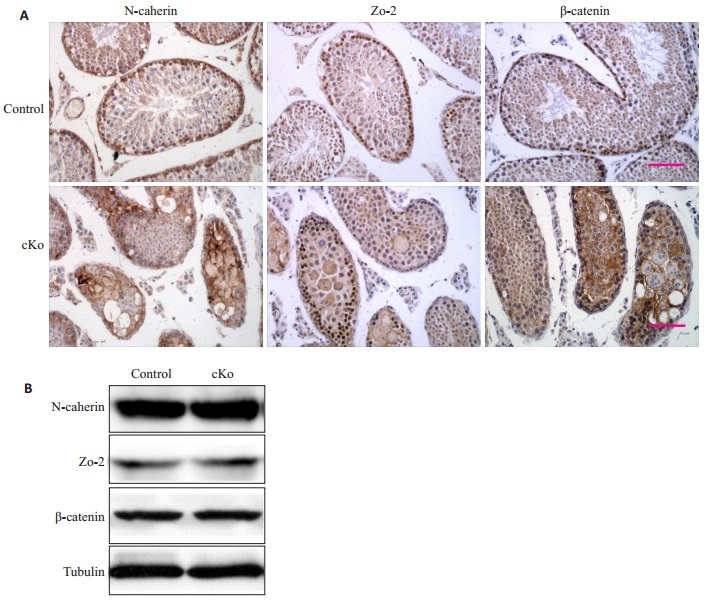
|
图 5 对照鼠与敲除鼠N-cadherin、ZO-2和β-catenin的(A)IHC和(B)Western blot表达图 Figure 5 Immunohistochemical staining (A) and immunoblotting (B) of N-cadherin, ZO-2 and β-catenin in control and cKO mice (HE staining, ×40). Brown showed positive staining. |
mTOR位于生命活动调节的中心位置,在细胞体内以mTORC1和mTORC2两种复合物的形式存在,参与很多疾病的发生及防治。mTOR与精子发生的关系首先在一个器官移植病例中发现,病人移植手术成功后,雷帕霉素作为免疫抑制剂长期使用后,病人却出现男性不育症。由于雷帕霉素是mTORC1的特异抑制剂,可见,mTORC1在精子发生和不育症的调控过程中发挥着非常重要作用[13]。
然而,随着实验进程的发展,出现两种质疑。首先,睾丸支持细胞特异性敲除Tsc1而导致mTORC1过度活化时,敲除鼠同样表现为睾丸血睾屏障完整性的破坏[9];其次,睾丸支持细胞特异性敲除Pten而导致mTORC1和mTORC2双双活化时,敲除鼠却表现为正常的睾丸表型[9]。分析原因,mTORC1过度活化时引起的睾丸血睾屏障的破坏,其可能机制是mTORC1活化后内质网应激导致细胞的过度增殖或凋亡,因为mTORC1的过度活化通常是与细胞增殖关系密切[14]。但从另一个角度分析,mTOC1的过度活化也可以通过S6K1/IRS通路和Rictor的磷酸化(苏氨酸1135)反馈性的抑制mTORC2而发挥作用[15]。由此推断,调控精子发生的过程中不仅仅mTORC1作用重要,不能排除在Tsc1敲除鼠中mTORC2的活性受到抑制的可能性,但是文献中并没有检测mTORC2的活性[15]。
最近几年,已开展大量关于细胞内mTORC2功能的研究。例如,mTORC2通过介导肿瘤细胞迁移和凋亡,延缓乳腺癌发展进程[16];Rictor在肾小球滤过屏障的足细胞粘附功能维持上发挥重要作用[17]。Rictor/ mTORC2还可以通过调控间隙连接系统和肌动蛋白网络系统,进而调控血睾屏障动力学[12],而血睾屏障动力学与精子发生关系紧密[18-19]。因此,本文构建睾丸支持细胞rictor基因敲除小鼠,WB和IHC的实验结果显示敲除效果非常成功,Rictor及下游pakt表达下降。而且,敲除小鼠的表型也非常明显,精子敲除鼠生殖器官显著变小,生精小管形态异常,且完全没有正常精子存在,进一步说明小鼠模型构建成功。此外,IHC和western blot法检测若干BTB相关蛋白表达后发现,虽然从表达量方面分析,BTB相关蛋白无差异;但结构上分析,Rictor/mTORC2缺失后,BTB相关蛋白表达杂乱无章,分布在整个生精小管。说明睾丸血睾屏障遭到损伤,进一步证明Rictor调控血睾屏障动力学。
精子发生是两次减数分裂的动态过程,任何过程的缺陷都有可能致使精子质量和/或精子数量下降,甚至停滞减数分裂,最终引起不育,大约10%的特发性非梗阻无精子症是减数分裂缺陷引起[20]。因此,本文应用流式细胞实验检测细胞周期,表达特异性较高的IF检测Ki-67及分离酶蛋白的表达,Ki-67是增值蛋白,在基底精原细胞区高表达;分离酶蛋白在有丝分裂和减数分裂中姐妹染色单体分离期间起重要作用,且减数分裂期间特异性高表达。说明睾丸支持细胞Rictor/mTORC2缺失后,睾丸血睾屏障遭到损伤,致使敲除鼠的精子发生阻滞在减数第二次分裂的前期或/和间期,最终导致精子发生的异常。
相比前人研究,首先,本文主要研究睾丸支持细胞,而支持细胞是构成血睾屏障的主要结构成分[21-22],因此本文结果进一步证明Rictor/mTORC2在细胞紧密连接中发挥重要作用。其次,前人大多数实验研究是活体外研究,涉及Rictor功效的在体实验甚少,而本文是关于Rictor/mTORC2在精子发生中的在体研究,是前人研究的紧密延续。而且,本文完成Rictor在睾丸支持细胞的特异性敲除,更加精细的证明Rictor在男性生殖系统中发挥者重要作用。总之,Rictor在精子发生及血睾屏障维持中发挥重要作用,但关于Rictor在精子发生中潜在作用的研究,还需开展更多工作,如前瞻性研究及其他相关分子机制研究。总之,本文通过Cre-loxP基因敲除系统,成功构建了小鼠睾丸支持细胞中特异性敲除rictor基因的动物模型,完成关于Rictor/mTOR信号通路在睾丸支持细胞功能维持和精子发生过程中的重要作用的在体研究,为临床中伴随血睾屏障损伤的精子发生障碍和男性不育症的治疗提供了理论依据。
| [1] | Mclaren A. Primordial germ cells in the mouse[J]. Dev Biol, 2003, 262(1): 1-15. DOI: 10.1016/S0012-1606(03)00214-8. |
| [2] | Johnson L, Thompson DJ, Varner DD. Role of testicular sertoli cell number and function on regulation of spermatogenesis[J]. Anim Reprod Sci, 2008, 105(1/2): 23-51. |
| [3] | Gao Y, Xiao X, Lui WY, et al. Cell polarity proteins and spermatogenesis[J]. Semin Cell Dev Biol, 2016, 59(7): 62-70. |
| [4] | Mok KW, Chen H, Lee WM, et al. rpS6 regulates blood-testis barrier dynamics through Arp3-mediated actin microfilament organization in rat sertoli cells. an in vitro study[J]. Endocrinology, 2015, 156(5): 1900-13. DOI: 10.1210/en.2014-1791. |
| [5] | 黄瑞, 朱伟杰. 睾丸睾丸支持细胞连接结构在精子发生过程的作用[J]. 生殖与避孕, 2013, 33(3): 199-204. DOI: 10.7669/j.issn.0253-357X.2013.03.0199. |
| [6] | Smith BE, Braun RE. Germ cell migration across Testicular sertoli cell tight junctions[J]. Science, 2012, 338(6108): 798-802. DOI: 10.1126/science.1219969. |
| [7] | Laplante M, Sabatini DM. mTOR signaling in growth control and disease[J]. Cell, 2012, 149(2): 274-93. DOI: 10.1016/j.cell.2012.03.017. |
| [8] | Zuber J, Anglicheau D, Elie C, et al. Sirolimus May reduce fertility in male renal transplant recipients[J]. Am J Transplant, 2008, 8(7): 1471-9. DOI: 10.1111/j.1600-6143.2008.02267.x. |
| [9] | Tanwar PS, Kaneko-Tarui T, Zhang L, et al. Altered LKB1/AMPK/TSC1/TSC2/mTOR signaling causes disruption of Sertoli cell polarity and spermatogenesis[J]. Hum Mol Genet, 2012, 21(20): 4394-405. DOI: 10.1093/hmg/dds272. |
| [10] | Mok KW, Mruk DD, Silvestrini B, et al. rpS6 regulates blood-testis barrier dynamics by affecting f-actin organization and protein recruitment[J]. Endocrinology, 2012, 153(10): 5036-48. DOI: 10.1210/en.2012-1665. |
| [11] | Sarbassov DD, Ali SM, Kim DH, et al. Erdjument-Bromage H, tempst P, sabatini DM.rictor, a novel binding partner of mTOR, defines a rapamycin-insensitive and raptor-independent pathway that regulates the cytoskeleton[J]. Curr Biol, 2004, 14(14): 1296-302. DOI: 10.1016/j.cub.2004.06.054. |
| [12] | Mok KW, Mruk DD, Lee WM, et al. Rictor/mTORC2 regulates blood-testis barrier dynamics via its effects on gap junction communications and actin filament network[J]. FASEB J, 2013, 27(3): 1137-52. DOI: 10.1096/fj.12-212977. |
| [13] | Skrzypek J, Krause W. Azoospermia in a renal transplant recipient during sirolimus (rapamycin) treatment[J]. Andrologia, 2007, 39(5): 198-9. DOI: 10.1111/and.2007.39.issue-5. |
| [14] | Chen Z, Dong H, Jia C, et al. Activation of mTORC1 in collecting ducts causes hyperkalemia[J]. J Am Soc Nephrol, 2014, 25(3): 534-45. DOI: 10.1681/ASN.2013030225. |
| [15] | Julien LA, Carriere A, Moreau J, et al. mTORC1-activated S6K1 phosphorylates rictor on threonine 1135 and regulates mTORC2 signaling[J]. Mol Cell Biol, 2010, 30(4): 908-21. DOI: 10.1128/MCB.00601-09. |
| [16] | Li H, Lin J, Wang X, et al. Targeting of mTORC2 prevents cell migration and promotes apoptosis in breast Cancer[J]. Breast Cancer Res Treat, 2012, 134(3): 1057-66. DOI: 10.1007/s10549-012-2036-2. |
| [17] | Vollenbröker B, George B, Wolfgart M, et al. mTOR regulates expression of slit diaphragm proteins and cytoskeleton structure in podocytes[J]. Am J Physiol Renal Physiol, 2009, 296(2): F418-26. |
| [18] | Li N, Mruk DD, Wong CK, et al. Actin-bundling protein plastin 3 is a regulator of ectoplasmic specialization dynamics during spermatogenesis in the rat testis[J]. FASEB J, 2015, 29(9): 3788-805. DOI: 10.1096/fj.14-267997. |
| [19] | Li N, Wong CK, Cheng CY. Plastins regulate ectoplasmic specialization via its actin bundling activity on microfilaments in the rat testis[J]. Asian J Androl, 2016, 18(5): 716-22. DOI: 10.4103/1008-682X.166583. |
| [20] | Egozcue J, Sarrate Z, Codina-Pascual M, et al. Meiotic abnormalities in infertile males[J]. Cytogenet Genome Res, 2005, 111(3/4): 337-42. |
| [21] | Gonzalez-Mariscal L, Bautista P, Lechuga S, et al. ZO-2, a tight junction scaffold protein involved in the regulation of cell proliferation and apoptosis[J]. Ann N Y Acad Sci, 2012, 1257(12): 133-41. |
| [22] | Tash BR, Bewley MC, Russo M, et al. The occludin and ZO-1 complex, defined by small angle X-ray scattering and NMR, has implications for modulating tight junction permeability[J]. Proc Natl Acad Sci USA, 2012, 109(27): 10855-60. DOI: 10.1073/pnas.1121390109. |
 2017, Vol. 37
2017, Vol. 37

