2. 南方医科大学珠江医院内分泌科, 广东 广州 510282;
3. 南方医科大学公共卫生学院生物统计学系, 广东 广州 510515
2. Department of Endocrinology, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China;
3. Department of Biostatistics, School of Public Health, Southern Medical University, Guangzhou 510515, China
慢性阻塞性肺疾病(COPD)是一种以持续气流受限为主要特征的肺部疾病,与气道和肺脏对有害颗粒或有毒气体的慢性炎性反应增强有关,可导致患者呼吸困难和运动受限,严重影响患者生活质量。2型糖尿病(T2DM)是COPD的一种常见合并症,在COPD的综合防治中越来越引起重视[1]。合并T2DM的COPD患者在高水平炎症状态下,更容易发生应激反应和代谢紊乱,增加了患者发生其他并发症的风险,并降低了药物疗效,使患者发生急性加重的风险和死亡率增加[2]。
COPD与T2DM均为长病程的慢性炎症性疾病,有资料显示严重的COPD患者更容易合并T2DM [3-4]。目前临床上针对COPD合并T2DM患者炎症状态的预测方法,主要是通过检测患者血浆中超敏C反应蛋白(hsCRP)、白细胞介素-6(IL-6)等急性炎症指标的变化水平,从而对COPD的病情发展及严重程度进行评估,但尚缺乏可早期预测COPD合并T2DM的慢性炎症指标。中性粒细胞/淋巴细胞比率(NLR)作为一种新型、成本低且方便检测的慢性炎症指标,已经在多种肿瘤如鼻咽癌[5],软组织肉瘤[6],小细胞肺癌[7]的早期预测方面取得了较好的研究结果,在独立预测胰岛素抵抗[8]和COPD患者的预后评估上[9]表现出良好的应用价值。然而,目前关于NLR对T2DM的预测价值在COPD患者中仍是未知,且大多数阐述NLR和T2DM相关性的文章都是回顾性研究,无法提供有价值的参考。
本次研究采用前瞻性研究方法通过分析NLR与COPD患者合并T2DM的关系,探讨NLR在COPD患者合并T2DM的发生过程中的早期预测价值。
1 资料和方法 1.1 研究对象采用前瞻性研究方法,收集2010年1月~2012年12月南方医科大学珠江医院确诊为稳定期的COPD受试者,且所有入选患者未合并T2DM,入选对象均符合全球COPD防治倡议的诊断标准[1]。T2DM的诊断标准为WHO T2DM诊断标准[10(]糖尿病典型症状+随机血浆葡萄糖浓度≥11.1 mmol/L或空腹血浆葡萄糖浓度≥ 7.0 mmol/L或者OGTT-2 h PG≥11.1 mmol/L)。高血压[11]定义为未使用降压药物的情况下收缩压≥140 mmHg和(或)舒张压≥90 mmHg。
排除标准:(1)COPD疾病以外的其他慢性或急性呼吸道疾病,如支气管扩张、肺部肿瘤、间质性肺炎、胸腔积液等;(2)双肺多发肺大疱者;(3)合并T2DM、甲状腺功能亢进或减低等代谢性疾病患者;(4)未能配合检测、问卷调查的;(5)合并感染。
所有参与研究的患者签署了知情同意书。本实验符合赫尔辛基申明并且获得了南方医科大学珠江医院伦理委员会的批准。在北美临床试验注册中心注册,注册号为NCT03152994。
1.2 基础资料与实验室指标所有患者在入组时接受统一的问卷调查和体检,包括一般基础资料、血生化、血常规和肺功能等相关指标。一般基础资料包括:性别、年龄、既往1年COPD急性加重住院次数、吸烟史、病程、高血压病史,测量身高、体质量指数(BMI)计算。血生化检测方法为常规抽取患者外周静脉血测定糖化血红蛋白(HbA1c)、空腹血糖(FBG)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、白蛋白(Alb)、hs-CRP、血沉(ESR)。血常规检测指标包括:白细胞计数(WBC)、中性粒细胞计数、淋巴细胞数计数,NLR=中性粒细胞计数/淋巴细胞数计数。肺功能相关指标包括:用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、第1秒用力呼气容积占预计值的百分比(FEV1%pred)、第1秒用力呼气容积与用力肺活量比(FEV1/FVC)、测量COPD患者呼吸困难量表(mMRC评分)、BODE指数(the body-mass, airflow obstructive, dyspnea, and exercise capacity index)、去脂体质量指数(FFMI)(采用南方医科大学珠江医院身体成分分析仪器(韩国Biospace型号:INbody720))、6 min步行距离(6MWD)、吸入糖皮质激素史、近两月静脉激素等指标来评价COPD患者的严重程度和预后等。
1.3 研究设计与分组入组后每半年随访1次,抽取受试者空腹外周静脉血4 mL,分离血清,用葡萄糖氧化酶法测定空腹血糖(FBG)。若空腹血浆葡萄糖浓度≥7.0 mmol/L则患者满足T2DM的诊断,对空腹血浆葡萄糖浓度 < 7.0 mmol/L的受试者行随机血浆葡萄糖浓度和口服葡萄糖耐量2 h试验(OGTT-2 h PG)测定,以避免对T2DM的漏诊。本研究中,以首次发生T2DM事件或达到3年随访期限为随访终点,在随访终点为患者检测并记录上述所有检测项目。根据研究对象在随访过程中是否发生T2DM将受试者分为COPD合并T2DM组和COPD未合并T2DM组(对照组)得到随访终点的分组情况。根据随访终点的分组情况将相对应的受试者入组时的资料重新整理和分组得到随访起点(基线资料)的分组情况。
1.4 统计学分析应用SPSS 21.0统计软件,符合正态分布的计量资料以均数±标准差表示,两组间差异性采用t检验,计数资料用率(%)表示,采用χ2检验;采用Spearman秩相关性分析各危险因素与COPD合并T2DM的相关性;采用单因素Logistic回归分析筛选潜在的独立危险因素,采用多因素Logistic回归分析各危险因素与COPD合并T2DM关系;采用双侧检验P < 0.05为差异有统计学意义。
2 结果 2.1 COPD患者T2DM发病率及入组情况3年随访结束后本研究最终纳入404名稳定期COPD患者,随访期间共有41人发生T2DM,依次是随访6个月发现3人,随访12、18、24、30、36个月分别新增4、6、7、10、11人。COPD患者T2DM 3年累计发病率为10.1%。随访结束后根据随访期间患者是否发生T2DM将患者分为COPD合并T2DM组(41人)和COPD未合并T2DM组(363人)。具体筛选流程见图 1。根据随访终点的分组情况将相对应的受试者入组时的资料重新整理和分组得到随访起点(基线资料)的分组情况。详见表 1。
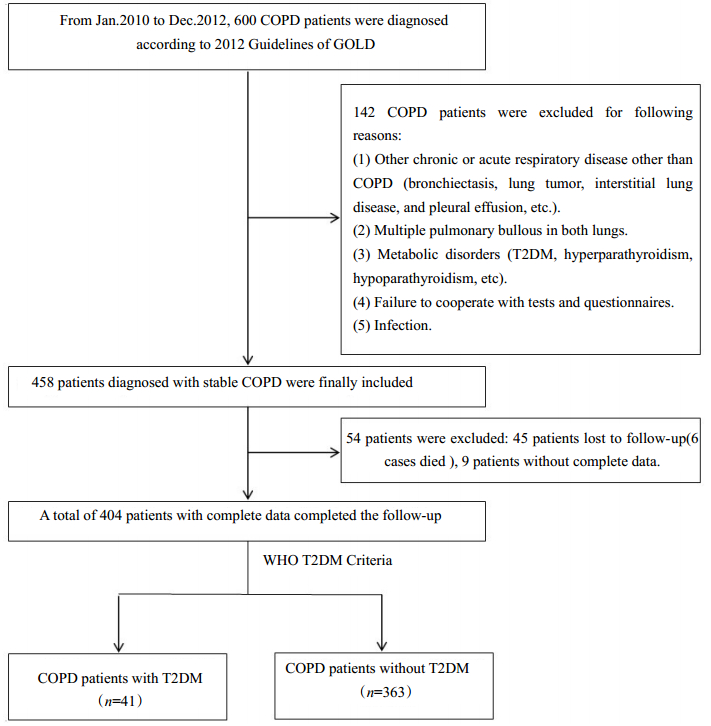
|
图 1 实验入组人员筛选流程图 Figure 1 Flow chat of patients selection and grouping. |
| 表 1 两组COPD患者各项指标分别在随访起止点的比较 Table 1 Comparison of the indexes between the 2 groups at the beginning and at the end of the follow-up (%, x±s) |
随访起点NLR在两组间比较差异有统计学意义(P < 0.001)。随访终点COPD合并T2DM组与对照组在既往1年COPD急性加重住院次数、吸烟史、高血压史、FBG、HbA1c、NLR、BODE指数、FEV1%pred、mMRC评分、6MWD(m)比较差异有统计学意义(P < 0.05)。
2.3 随访起点数据Spearman秩相关分析在稳定期的COPD患者中,是否合并T2DM与既往1年COPD急性加重住院次数、高血压和NLR呈正相关(r=0.340,P < 0.001,表 2)。
| 表 2 Spearman秩相关分析与COPD患者中合并T2DM的相关因素 Table 2 Spearman rank correlation analysis on the factors rated with T2DM in COPD patients |
NLR和TG是COPD患者合并T2DM的独立危险因素;其中TG的危险度为(OR=1.396,95% CI 1.005~1.940,P=0.047),NLR的危险度为(OR=1.631,95%CI 1.393~1.909,P < 0.001,表 3)。
| 表 3 多因素Logistic回归分析与COPD患者中合并T2DM的危险因素 Table 3 Logistic regression analysis on the risk factors for T2DM in COPD patients |
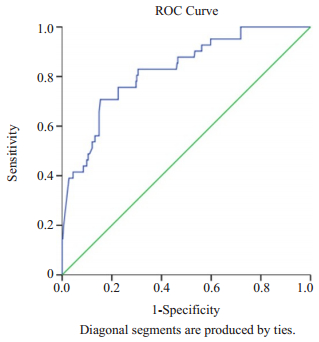
|
图 2 NLR对T2DM诊断的ROC曲线 Figure 2 ROC curve of NLR for diagnosis of T2DM. |
用ROC曲线确定T2DM诊断的最佳NLR阈值。以NLR为研究对象,曲线下面积AUC=0.826(P < 0.001,95% CI 0.759~0.892)。NLR的最佳阈值为5.626,敏感度为70.7%,特异性为84.6%,真阳性率为70.7%,假阳性率为15.4%。由此可见,NLR与COPD合并T2DM呈正相关,当NLR值大于5.626时预测价值最高。
3 讨论COPD和T2DM都是慢性炎症性疾病,合并T2DM的COPD患者易诱发其他不良反应并加重患者病情。T2DM的早期预测和预防在COPD人群中显得尤为重要。NLR是一个近来发现的简单、稳定的炎症指标,NLR升高或降低对癌症[12]、心血管[13]和消化道疾病[14]的预测有重要的临床价值,其临床效果也优于其他炎症因子。本研究发现合并T2DM的COPD患者早期即存在NLR水平的显著升高,NLR是个有效的预测COPD患者发生T2DM的指标。
Khunti等[15-16]等糖尿病相关的调查研究持续时间为3年。Lachin等[17-20]研究随访时间为6个月,且研究显示血糖相关检测最佳随访时间为6个月。本研究采用所有患者门诊随访3年,随访周期为6个月的研究方案。
本研究中T2DM 3年累积发病率为10.1%,而Liu [21]在50 656中国成年人为期平均3.8年的随访中,T2DM的累积发病率为6.06%。Borné [22]在26 667例以人群为基础的前瞻性研究为期14年的随访中糖尿病的累积发病率为11.05%。1篇前瞻性的meta分析为期4.6~24年的随访中T2DM的累积发病率为5.39% [23]。本研究的T2DM发病率相对较高,可能是因为慢阻肺多于中老年发病,本研究纳入的患者平均年龄偏高,高龄是导致T2DM的危险因素之一[24]。COPD所导致的慢性炎症状态容易损伤胰岛,降低胰岛细胞功能和胰岛素利用率,导致胰岛素抵抗和T2DM的发生[4]。
在COPD患者发生T2DM前,两组患者除NLR外的血生化、血常规和肺功能相关指标等都无显著性差异。在研究随访终点,两组患者的FBG、HbA1c、NLR存在显著性差异;既往1年COPD急性加重住院次数、吸烟史、BODE指数、FEV1%pred、mMRC评分和6MWD存在显著性差异。该结论符合高代谢疾病NLR升高的相关研究报道[25-26]。有研究表明对COPD患者长期大剂量的糖皮质激素治疗会增加T2DM的发生率[27]。而本研究中患者使用吸入糖皮质激素和短期应用全身激素对T2DM的发生率无影响,可能与COPD患者使用吸入糖皮质激素的比例和剂量有关,还需进一步研究证实。
两组患者T2DM危险因素相关分析显示在稳定期的COPD患者中,合并T2DM与既往1年COPD急性加重住院次数、高血压和NLR呈正相关,说明高血糖使COPD患者急性加重或发生其他并发症的风险增加[4],T2DM患者容易合并高血压[28]。NLR作为一个反映机体炎症状态的指标,其水平升高与T2DM的发生密切相关。此结论在健康人群中已得到相关证实和报道[8],而本研究发现在稳定期的COPD患者中此结论同样适用。
Logistic回归分析显示,NLR是COPD合并T2DM的独立危险因素,中性粒细胞和淋巴细胞在炎症反应中所起的作用不同,中性粒细胞是炎症反应初期非特异性的炎性细胞,于炎症反应初期迅速增殖释放入血发挥作用;淋巴细胞在炎症反应过程中则起调节和保护作用。NLR是二者的结合,优于单独的粒细胞、淋巴细胞以及WBC计数,后者可容易受到生理,病理以及物理因素的影响[29]。我们的研究还发现TG也是COPD合并T2DM的独立危险因素,可能是过多的TG在胰岛中堆积对胰岛β细胞产生毒性作用,引起继发性的胰岛素分泌障碍;降低组织对胰岛素的敏感性,使葡萄糖的利用减少,产生胰岛素抵抗;促进糖异生,使肝糖输出增多,从而导致T2DM的发生[30]。
NLR作为一个稳定易测的系统炎症指标,可以反映COPD患者炎症反应的水平,并且NLR对COPD急性加重不良预后和肺功能的预测有良好的效果[31]。炎症反应可能先导致患者胰岛素抵抗和胰岛β细胞的凋亡,从而加速T2DM的发生。COPD患者长期处于慢性炎症状态,诱导大量炎症因子的分泌,炎症因子又可反过来激活中性粒细胞,导致粒细胞大量增殖活化[32]。炎症反应会导致微血管病变,导致胰岛受损,从而降低胰岛细胞功能和胰岛素利用障碍,导致胰岛素抵抗和T2DM的发生[8];此外,炎症反应还有可能引起机体免疫系统的异常活化,从而促使胰岛炎症的发生,导致胰岛β细胞数量下降,胰岛素分泌受损[33]。另外淋巴细胞也与机体炎症状态关系密切,T2DM患者淋巴细胞总数降低且T淋巴细胞亚群比例严重失调,CD4/CD8比值明显下降,CD8+T等淋巴细胞的数目的下降抑制机体的抗炎环境, 使得低度系统炎症持久存在[34]。
本研究证实在COPD稳定期患者发生T2DM与NLR水平密切相关,NLR作为一个有效的预测T2DM发生的指标,能够为COPD患者未来的生存状态提供良好的依据,考虑到COPD急性加重期易并发感染致炎症反应剧烈,中性粒细胞和淋巴细胞波动范围过大,NLR的研究价值不高,而COPD稳定期患者的炎症状态较为稳定,血液中中性粒细胞和淋巴细胞总数波动范围不大,所以临床医生可以对NLR较高水平COPD稳定期的患者的病情做出正确的判断,具有重要的临床指导意义。提前给予针对性的T2DM预防和治疗方案,控制炎症水平能够减少T2DM的发生。本实验也存在一定的局限性,样本量小、单中心且样本人群局限于COPD患者,未纳入匹配的健康人群血清NLR和血糖之间关系的对照。从ROC曲线图分析,NLR对COPD合并T2DM诊断的敏感度为70.7%,特异性为84.6%,如果与其他COPD合并T2DM的早期预测指标联合应用,也许可以进一步提高预测的敏感度与特异性,但因本实验的局限性,仍待更大的临床前瞻性研究进一步证实。
综上所述,NLR可能是一个有效的早期预测COPD患者合并T2DM的指标。该指标的临床应用价值还需多中心、大样本的前瞻性研究进一步证实。
| [1] | Vogelmeier CF, Criner GJ, Martinez FJ, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD Executive Summary[J]. Am J Respir Crit Care Med, 2017, 195(5): 557-82. DOI: 10.1164/rccm.201701-0218PP. |
| [2] | Baker EH, Janaway CH, Philips BJ, et al. Hyperglycaemia is associated with poor outcomes in patients admitted to hospital with acute exacerbations of chronic obstructive pulmonary disease[J]. Thorax, 2006, 61(4): 284-9. DOI: 10.1136/thx.2005.051029. |
| [3] | Lee CT, Mao IC, Lin CH, et al. Chronic obstructive pulmonary disease:a risk factor for type 2 diabetes:a nationwide populationbased study[J]. Eur J Clin Invest, 2013, 43(11): 1113-9. |
| [4] | Glaeser S, Krueger S, Merkel M, et al. Chronic obstructive pulmonary disease and diabetes mellitus:a systematic review of the literature[J]. Respiration, 2015, 89(3): 253-64. DOI: 10.1159/000369863. |
| [5] | Li XH, Chang H, Xu BQ, et al. An inflammatory biomarker-based nomogram to predict prognosis of patients with nasopharyngeal carcinoma:an analysis of a prospective study[J]. Cancer Med, 2017, 6(1): 310-9. DOI: 10.1002/cam4.2017.6.issue-1. |
| [6] | Jiang L, Jiang SS, Situ D, et al. Prognostic value of monocyte and neutrophils to lymphocytes ratio in patients with metastatic soft tissue sarcoma[J]. Oncotarget, 2015, 6(11): 9542-50. DOI: 10.18632/oncotarget.v6i11. |
| [7] | Kang MH, Go SI, Song HN, et al. The prognostic impact of the neutrophil-to-lymphocyte ratio in patients with small-cell lung cancer[J]. Br J Cancer, 2014, 111(3): 452-60. DOI: 10.1038/bjc.2014.317. |
| [8] | Lou M, Luo P, Tang R, et al. Relationship between neutrophillymphocyte ratio and insulin resistance in newly diagnosed type 2 diabetes mellitus patients[J]. BMC Endocr Disord, 2015, 15(4): 9. |
| [9] | Grolimund E, Kutz A, Marlowe RJ, et al. Long-term prognosis in COPD exacerbation:role of biomarkers, clinical variables and exacerbation type[J]. COPD, 2015, 12(3): 295-305. |
| [10] | Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J]. Diabet Med, 1998, 15(7): 539-53. DOI: 10.1002/(ISSN)1096-9136. |
| [11] | Chalmers J, Macmahon S, Mancia G, et al. 1999 world health Organization-International society of hypertension guidelines for the management of hypertension. guidelines sub-committee of the World Health Organization[J]. Clin Exp Hypertens, 1999, 21(5/6): 1009-60. |
| [12] | Dabaja A, Menon M, Agarwal P. Prognostic indicators of aggressive disease in patients with locally advanced or metastatic prostate cancer:A focus on neutrophil to lymphocyte and platelet to lymphocyte ratios[J]. J Clin Oncol, 2011, 29(7S): 62. |
| [13] | Ertem AG, Ozcelik F, Kasapkara HA, et al. Neutrophil lymphocyte ratio as a predictor of left ventricular apical thrombus in patients with myocardial infarction[J]. Korean Circ J, 2016, 46(6): 768-73. DOI: 10.4070/kcj.2016.46.6.768. |
| [14] | Reynolds IS, Heaney RM, Khan W, et al. The utility of neutrophil to lymphocyte ratio as a predictor of intervention in acute diverticulitis[J]. Dig Surg, 2017, 34(3): 227-32. DOI: 10.1159/000450836. |
| [15] | Khunti K, Gray LJ, Skinner T, et al. Effectiveness of a diabetes education and self management programme (DESMOND) for People with newly diagnosed type 2 diabetes mellitus:three year follow-up of a cluster randomised controlled trial in primary care[J]. BMJ, 2012, 344(11): e2333. |
| [16] | Azab B, Daoud J, Naeem FB, et al. Neutrophil-to-lymphocyte ratio as a predictor of worsening renal function in diabetic patients (3-year follow-up study)[J]. Ren Fail, 2012, 34(5): 571-6. DOI: 10.3109/0886022X.2012.668741. |
| [17] | Lachin JM, White NH, Hainsworth DP, et al. Effect of intensive diabetes therapy on the progression of diabetic retinopathy in patients with type 1 diabetes:18 years of follow-up in the DCCT/EDIC[J]. Diabetes, 2015, 64(2): 631-42. DOI: 10.2337/db14-0930. |
| [18] | Erdmann E, Song E, Spanheimer R, et al. Observational follow-up of the PROactive study:a 6-year update[J]. Diabetes Obes Metab, 2014, 16(1): 63-74. DOI: 10.1111/dom.2014.16.issue-1. |
| [19] | Krum H, Schlaich MP, Böhm M, et al. Percutaneous renal denervation in patients with treatment-resistant hypertension:final 3-year report of the Symplicity HTN-1 study[J]. Lancet, 2013, 383(9917): 622-9. |
| [20] | Malanda UL, Welschen LM, Riphagen I, et al. Self-monitoring of blood glucose in patients with type 2 diabetes mellitus who are not using insulin[J]. Cochrane Database Syst Rev, 2012, 18(1): CD005060. |
| [21] | Liu XX, Shi JH, Wang AX, et al. Changes in ideal cardiovascular health status and risk of new-onset type 2 diabetes:The Kailuan prospective study[J]. Medicine (Baltimore), 2016, 95(34): e4571. DOI: 10.1097/MD.0000000000004571. |
| [22] | Borne Y, Smith JG, Nilsson PM, et al. Total and differential leukocyte counts in relation to incidence of diabetes mellitus:a prospective Population-Based cohort study[J]. PLoS One, 2016, 11(2): e0148963. DOI: 10.1371/journal.pone.0148963. |
| [23] | Jia XJ, Zhong LA, Song Y, et al. Consumption of citrus and cruciferous vegetables with incident type 2 diabetes mellitus based on a meta-analysis of prospective study[J]. Prim Care Diabetes, 2016, 10(4): 272-80. DOI: 10.1016/j.pcd.2015.12.004. |
| [24] | Das S, Peter P, Bhavani ML, et al. Age-and sex-related prevalence and drug utilization pattern in the management of type 2 diabetes mellitus and its comorbidity with cardiovascular diseases:a comparative study[J]. Indian J Pharm Sci, 2015, 77(4): 478-84. DOI: 10.4103/0250-474X.164776. |
| [25] | Yilmaz H, Ucan B, Sayki M, et al. Usefulness of the neutrophil-tolymphocyte ratio to prediction of type 2 diabetes mellitus in morbid obesity[J]. Diabetes Metab Syndr, 2015, 9(4): 299-304. DOI: 10.1016/j.dsx.2014.04.009. |
| [26] | Furutate R, Ishii T, Motegi T, et al. The neutrophil to lymphocyte ratio is related to disease severity and exacerbation in patients with chronic obstructive pulmonary disease[J]. Intern Med, 2016, 55(3): 223-9. DOI: 10.2169/internalmedicine.55.5772. |
| [27] | Price DB, Russell R, Mares R, et al. Metabolic effects associated with ICS in patients with COPD and comorbid type 2 diabetes:a historical matched cohort study[J]. PLoS One, 2016, 11(9): e0162903. DOI: 10.1371/journal.pone.0162903. |
| [28] | Derakhshan A, Bagherzadeh-Khiabani F, Arshi B, et al. Different combinations of glucose tolerance and blood pressure status and incident diabetes, hypertension, and chronic kidney disease[J]. J Am Heart Assoc, 2016, 5(8): 25. |
| [29] | Gibson PH, Croal BL, Cuthbertson BH, et al. Preoperative neutrophil-lymphocyte ratio and outcome from coronary artery bypass grafting[J]. Am Heart J, 2007, 154(5): 995-1002. DOI: 10.1016/j.ahj.2007.06.043. |
| [30] | Zheng S, Shi S, Ren XX, et al. Triglyceride glucose-waist circumference, a novel and effective predictor of diabetes in firstdegree relatives of type 2 diabetes patients:cross-sectional and prospective cohort study[J]. J Transl Med, 2016, 14(3): 260. |
| [31] | Taylan M, Demir M, Kaya H, et al. Alterations of the neutrophillymphocyte ratio during the period of stable and acute exacerbation of chronic obstructive pulmonary disease patients[J]. Clin Respir J, 2017, 11(3): 311-7. DOI: 10.1111/crj.2017.11.issue-3. |
| [32] | Tabák AG, Kivimäki M, Brunner EJ, et al. Changes in C-reactive protein levels before type 2 diabetes and cardiovascular death:the Whitehall Ⅱ study[J]. Eur J Endocrinol, 2010, 163(1): 89-95. DOI: 10.1530/EJE-10-0277. |
| [33] | Donath MY, Böni-Schnetzler M, Ellingsgaard H, et al. Islet inflammation impairs the pancreatic beta-cell in type 2 diabetes[J]. Physiology (Bethesda), 2009, 24(6): 325-31. DOI: 10.1152/physiol.00032.2009. |
| [34] | Eller K, Kirsch A, Wolf AM, et al. Potential role of regulatory T cells in reversing obesity-linked insulin resistance and diabetic nephropathy[J]. Diabetes, 2011, 60(11): 2954-62. DOI: 10.2337/db11-0358. |
 2017, Vol. 37
2017, Vol. 37

