由于铬(Ⅵ)及其化合物被广泛应用于工业制造,如电镀、制革、纺织染色、防腐和木材处理等[1],对环境造成了严重的污染,导致政府每年投入大量财政治理铬(Ⅵ)污染[2]。微生物法具有独特的优势(成本低、经济、高效、环保)而被广泛研究[3]。微生物除铬(Ⅵ)主要通过还原和抗性两大机制完成[4]。其中对微生物铬(Ⅵ)抗性相关报道尽管已有20年研究,然而对于铬(Ⅵ)抗性相关基因及其表达蛋白的研究并不深入。普遍认为通过硫酸盐通道进入细菌胞内的铬(Ⅵ)是由质粒编码的膜转运蛋白ChrA泵出细胞外[5]。早在19世纪已有研究者在Pseudomonas aeruginosa的质粒pUM505、Cupriavidus metallidurans的质粒pMOL28和其它质粒上发现了ChrA基因,但这些质粒上编码的ChrA基因只能在其野生宿主中发挥作用,而不能在大肠杆菌中异源表达[6-8]。近几年逐渐在一些细菌基因组中也发现了铬(Ⅵ)抗性基因,如:E.coli KR29, Leucobacter salsicius type strain M1 -8T, Microbacterium sp, Cellulosimicrobium sp. KX710177 [9-13]。但是不同于其它金属抗性基因可以使微生物在一个较高的mmol浓度下生存,目前已知的铬(Ⅵ)抗性基因只能在亚mmol范围内提供保护[14-17]。
为了寻求一个高效的铬(Ⅵ)抗性系统,本课题组对一株具有高抗铬(Ⅵ)性能的沙雷氏菌的遗传基因进行了研究。沙雷氏菌(Serratia sp.)S2是从长期Cr(Ⅵ)污染的某河水中分离筛选出能在较高浓度的铬酸盐中生存的菌株[18],全基因组测序发现其基因组中存在铬(Ⅵ)抗性基因ChrA,本文通过基因克隆和重组技术,确定了ChrA基因有助于提高菌株的抗铬性能,并进一步明确了ChrA蛋白转运铬(Ⅵ)的路径、动力和选择性等机制。为下一步构建具有高效除铬(Ⅵ)系统的工程菌提供了物种和基因资源,为利用具有高效抗铬系统的微生物治理铬污染提供了方向,奠定了理论基础。
1 材料和方法 1.1 材料 1.1.1 主要试剂质粒小提试剂盒,Universal DNA产物纯化试剂盒,琼脂糖凝胶回收试剂盒,2 ×Pfu PCR Master Mix酶,2×Taq Master Mix酶(天根生化科技(北京)公司);DNA maker,EcoR Ⅰ、Xho Ⅰ限制性内切酶,T4 DNA连接酶,IPTG(宝生物工程大连有限公司);氨苄青霉素,卡那霉素,LB培养基(生工生物工程(上海)有限公司);抗His标签兔多克隆抗体和羊抗兔IgGHRP(北京博奥森生物技术有限公司);超敏ECL化学发光试剂盒(millipore,美国)其余均为国产或进口分析纯试剂。
1.1.2 菌种与质粒E.coli BL21(DE3)感受态细胞、E.coli DH5α感受态细胞购自北京天根公司,克隆载体pMD19-T购买自宝生物公司,表达载体pET-28a(+)和沙雷氏菌CQMUS2由实验室-80 ℃保存。
1.2 实验方法 1.2.1 细菌基因组和质粒提取提取步骤分别参照细菌水煮模板法[19]和质粒小提试剂盒说明书操作。
1.2.2 ChrA基因的克隆及鉴定从沙雷氏菌S2基因组序列文库中搜索到ChrA基因序列,利用软件Primer Premier 5设计引物:F1:5'-CCGGAATCCATGAGCAAAACGGTCGTTCT-3',R1:5'-CCGCTCGAGTTCTGCGCCGGACAGT-3',下划波浪线部分为保护性碱基,下划直线部分别为EcoR Ⅰ、Xho Ⅰ的酶切位点,引物由上海生工合成。以提取的沙雷氏菌S2 DNA为模板,F1、R1分别为上下游引物,2×Pfu PCR Master Mix高保真酶扩增ChrA基因。PCR反应体系为25 μL,反应条件为:94 ℃,3 min;94 ℃,30 s;67 ℃,30 s;72 ℃,1 min;30个循环;72 ℃,5 min。1.5%的琼脂糖凝胶电泳检测PCR产物,琼脂糖凝胶回收试剂盒回收纯化片段,连接至pET-28a(+)载体,连接产物转化至E.coli BL21(DE3)感受态细胞中,随机挑取单菌落进行菌落PCR鉴定,并测序鉴定。
1.2.3 ChrA蛋白表达挑选测序正确的重组菌落接种于50 μg/mL的卡那霉素的LB培养液中,37 ℃培养至A600为0.4~0.8,加入诱导剂IPTG至终浓度为0.5 mmol/L,30 ℃ 100 r/min培养8 h,同时诱导空载体作为空白对照。按照Triton x114去污剂法提取ChrA蛋白,BCA法测定蛋白浓度,变性聚丙烯酰胺凝胶电泳(SDS-PAGE)分析和Western blotting鉴定。
1.2.4 Western blotting实验上述诱导的去污相ChrA蛋白经SDS-PAGE电泳后转移至PVDF膜上,洗涤后室温下用5%脱脂牛奶封闭1 h,TBST洗膜,然后加入兔抗His-tag稀释液(一抗,1:400),4 ℃过夜孵育。TBST洗膜3次,每次10 min,加入羊抗兔IgG-HRP(二抗,1:9000),室温中平摇1 h。TBST洗膜3次,每次5 min,将PVDF膜置于Bio-red荧光成像仪托板上,均匀滴加ECL发光液后进行曝光拍照。
1.3 ChrA工程菌的抗铬(Ⅵ)特性 1.3.1 铬(Ⅵ)的抗性分别将过夜培养的ChrA工程菌、沙雷氏菌S2和含有空质粒的E.coli BL21对照株按1:100的接种量分别接种于25、75、100、150和200 mg/L Cr2O72-的LB液体培养基中,37 ℃,200 r/min,培养18~24 h后测定培养基的A600。每一处理设置3个平行样。
1.3.2 铬(Ⅵ)的吸收ChrA工程菌、沙雷氏菌S2和对照株过夜培养后1:100接种到新鲜LB液体培养基中培养至对数期,向培养基中加入25、50和100 mg/L的Cr2O72-离子,37 ℃振荡培养8 h,离心收集菌体,用微波消解法对菌体进行前处理,火焰原子吸收光度法测定胞内铬含量。提取菌体中ChrA蛋白(同1.2.3),以胞内铬含量与ChrA蛋白质的比值(µg/mg)表示菌株对铬(Ⅵ)的吸收能力,每一处理设同时做3个平行样。
1.3.3 铬(Ⅵ)的外排ChrA工程菌、沙雷氏菌S2和对照株培养至对数期(同1.3.2),分别在50、75和20 mg/L Cr2O72-的LB液体培养基中,37 ℃振荡培养30 min,使各菌胞内初始铬吸收量大约一致。收集菌体,用PBS缓冲液洗涤1次,重悬于等体积PBS缓冲溶液中,37 ℃振荡培养10~20 min。收集并处理菌体(同1.3.2),用石墨炉原子吸收光度法测定胞内铬含量。以胞内铬剩余百分比表示菌株对铬(Ⅵ)的外排能力,每一处理设置3个平行样。
1.3.4 含氧阴离子和抑制剂对铬(Ⅵ)外排的影响工程菌培养和菌体处理同1.3.3,不同在于PBS洗涤1次后,重悬于各含氧阴离子(硫酸盐、钼酸盐、钒酸盐和钨酸盐)和抑制剂(NADH、缬氨霉素、寡霉素和氰根离子)的PBS缓冲溶液中。每一处理均做3个重复样,同时设置不加任何阴离子或抑制剂的PBS缓冲溶液为对照组。10 min后,测定胞内铬含量(同1.3.3)和蛋白质浓度(同1.3.2)。以胞内铬剩余百分比表示菌株对铬(Ⅵ)的外排能力,以处理组相对于对照组多出的铬含量百分比为抑制率。
1.4 统计学分析应用SPSS17.0统计软件对所有计量资料进行t检验,统计结果以Mean±SD表示,P < 0.05为差异有统计学意义。
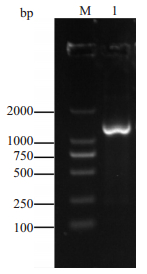
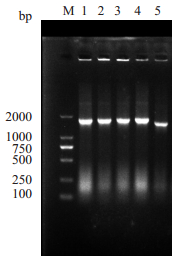
2 结果 2.1 ChrA基因的克隆及鉴定PCR产物的琼脂糖凝胶电泳结果显示ChrA片段约为1400 bp(图 1),测序结果表明ChrA基因有1368 bp,编码455个氨基酸,蛋白相对分子质量约为50 000;将ChrA基因连接至pET-28a载体中,进行菌落PCR并测序鉴定,成功构建了pET-28a(+)-ChrA重组子(图 2)。
|
图 1 ChrA基因琼脂糖凝胶电泳 Figure 1 Agarose gel electrophoresis of ChrA gene. M: Marker; 1: ChrA. |
|
图 2 重组表达质粒pET-28a(+)-ChrA的PCR鉴定 Figure 2 PCR identification of the recombinant plasmid pET-28a(+)-ChrA. M: Marker; Lanes 1-4: pET-28a(+)-ChrA; Lane 5: ChrA. |
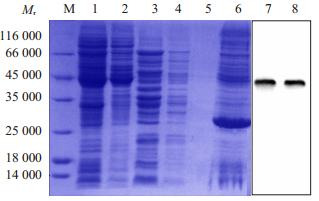
用Triton x114去污剂法提取ChrA蛋白,SDSPAGE结果显示蛋白大多在去污相中,表明ChrA蛋白为疏水性膜蛋白,其大小约为45 000,而预测的ChrA蛋白50 000与pET-28a(+)载体上的His标签相对分子质量5000融合表达蛋白大小约为55 000,这可能是由于膜蛋白在变性聚丙烯酰胺凝胶上不寻常的迁移行为,造成预测的相对分子质量与SDS-PAGE胶上估计相对分子质量不一致;经Western blotting鉴定上述特异性条带为含His标签的目的蛋白(图 3)。
|
图 3 重组大肠杆菌E.coli ChrA表达蛋白的SDSPAGE和Western blotting分析 Figure 3 SDS-PAGE and Westrn blot analysis of ChrA protein exprssion in the recombinant E.coli. M: Marker; 1-2: Decontamination phase, aqueous phase ChrA protein after induction; 3-4: Decontamination phase, aqueous phase ChrA protein before induction; 5-6: Decontamination phase, aqueous phase blank control after induction; 7-8: Western blot of decontamination phase ChrA protein after induction. |
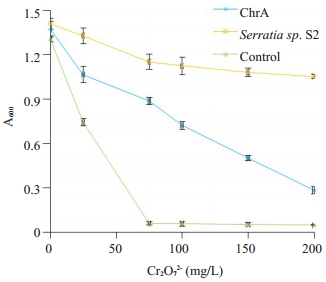
分别测定ChrA工程菌、沙雷氏菌S2和对照株在含不同浓度Cr2O72-的LB液体培养基中的抗铬(Ⅵ)能力。由图 4可知ChrA工程菌具有一定的铬(Ⅵ)的抗性能力,其最高能耐受200 mg/L的Cr2O72-。在100、150和200 mg/L Cr2O72-浓度下培养18~24 h后,A600依次为沙雷氏菌S2 > ChrA工程菌 > 对照株(P < 0.05),即ChrA工程菌的抗铬(Ⅵ)生长能力显著低于野生株,但强于对照株。
|
图 4 不同浓度Cr2O72-下菌株的铬(Ⅵ)抗性 Figure 4 Chromate resistance of Serratia.sp. CQMUS2 ChrA gene in E. coli BL21. |
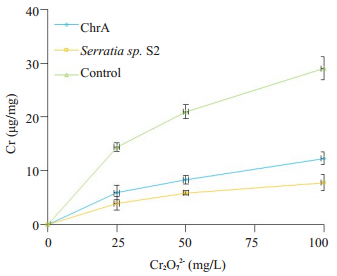
菌株含铬(Ⅵ)培养8 h后收集菌体测定胞内铬吸收量和ChrA蛋白比值(图 5)。结果表明,对铬的吸收能力依次为对照株 > ChrA工程菌 > 沙雷氏菌S2,即ChrA工程菌对铬(Ⅵ)的吸收能力较低,显著低于对照株,但高于野生株,差异均有统计学意义(P < 0.05)。
|
图 5 ChrA工程菌铬(Ⅵ)吸收 Figure 5 Chromate uptake by engineered E. coli BL21 ChrA strains. |
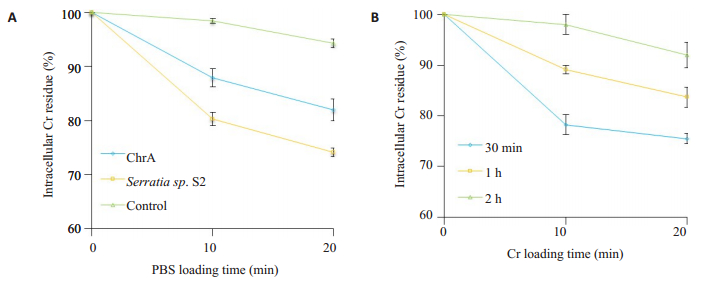
含铬(Ⅵ)培养的菌株,置于无铬(Ⅵ)PBS缓冲液中,以胞内铬剩余百分比表示菌株对铬(Ⅵ)的外排能力。结果如图 6A所示,胞内铬剩余量多少依次为对照株 > ChrA工程菌 > 沙雷氏菌S2,差异具有统计学意义(P < 0.05)。
|
图 6 ChrA工程菌的铬(Ⅵ)外排与铬(Ⅵ)负载时间对ChrA工程菌铬(Ⅵ)外排影响 Figure 6 Chromate efflux by E. coli BL21 ChrA strains (A) and effect of loading time on chromate efflux by cell suspensions of E. coli BL21 ChrA strains (B). |
铬(Ⅵ)的外排在铬(Ⅵ)负载时间相对较短的情况下更加明显,工程菌在50 mg/L Cr2O72-培养基中负载30 min,重悬在PBS缓冲溶液中培养10 min后,铬(Ⅵ)外排量达到了22%。但随着细胞悬浮液在铬(Ⅵ)中孵育时间增长,铬(Ⅵ)外排量逐渐减少(图 6B)。
2.6 含氧阴离子对铬(Ⅵ)外排的影响不同的阴离子对工程菌铬(Ⅵ)外排有不同的影响(表 1)。与对照组相比,硫酸盐和钼酸盐能显著性抑制工程菌中铬(Ⅵ)的外排(P < 0.05),而钨酸盐和钒酸盐对工程菌铬(Ⅵ)外排无明显抑制或促进作用。在含10 mmol的硫酸盐和钼酸盐的PBS缓冲液中孵育10 min,ChrA工程菌铬(Ⅵ)的外排抑制率分别达到了16.67%和17.95%。
| 表 1 含氧阴离子和抑制剂对ChrA工程菌铬外排能力的影响 Table 1 Effect of oxyanions and inhibitors on chromate efflux of ChrA engneered bacteria (Mean±SD) |
各类抑制剂对ChrA工程菌铬(Ⅵ)外排有不同影响(表 1)。NADH的存在对ChrA工程菌铬(Ⅵ)的外排有促进作用,差异具有统计学意义(P < 0.05),能使铬(Ⅵ)外排率提高约28%。K+离子载体缬氨霉素和呼吸链抑制剂CN-能显著抑制工程菌外排铬(Ⅵ),差异具有统计学意义(P < 0.05),外排率分别被抑制了14.61%和14.10%。而ATP代谢抑制剂寡霉素对铬(Ⅵ)的外排无明显促进或抑制作用,差异无统计学意义(P > 0.05)。
3 讨论目前,国内仅何敏艳等[20-21]研究了ChrA蛋白在细菌Bacillus cereus SJl和Lysinibacillusfusiformis ZCl中的功能,除此之外再没有人从分子和蛋白水平上研究微生物的Cr(Ⅵ)抗性,更没有相关工程菌的研究。国外研究最早的铬(Ⅵ)抗性基因是由Pseudomonas aeruginosa的质粒pUM505以及Cupriavidus metallidurans的质粒pMOL28编码的ChrA基因。但是研究发现这两个菌株表达的ChrA基因并不能在大肠杆菌中异源表达[22-23]。
基于此,本研究首次从具有除铬(Ⅵ)能力的沙雷氏菌S2中克隆出ChrA基因,并进行重组表达。研究表明ChrA基因能在大肠杆菌中表达,赋予了菌株一定的抗铬(Ⅵ)能力,但ChrA工程菌的抗铬(Ⅵ)能力低于野生株,说明微生物对铬(Ⅵ)的抗性不仅仅是一个基因,一个蛋白的作用,而是多种基因成组型表达的结果。为了进一步明确ChrA基因的功能,本研究测定了工程菌铬(Ⅵ)的吸收能力,结果其吸收能力远小于对照株,说明ChrA基因的表达能降低菌株对铬(Ⅵ)的吸收。但一般来说工程菌铬(Ⅵ)吸收减少有两方面原因:(1)铬(Ⅵ)进入细菌体内的通道被堵塞;(2)细菌体内存在一个外排系统。为了区别这两种可能性,我们测定了菌株对铬(Ⅵ)的外排,结果工程菌外排能力高于对照株,且差异具有统计学意义,表明ChrA基因的表达加强了菌株对铬(Ⅵ)的外排。结合吸收和外排实验结果,可以认为工程菌铬(Ⅵ)吸收的减少是由于高效铬(Ⅵ)外排系统的存在,该结果也符合已报道文献中发现的ChrA功能[24],证明了ChrA蛋白参与铬(Ⅵ)的外排。
通过测定含铬(Ⅵ)培养时间、含氧阴离子和抑制剂对铬(Ⅵ)外排的影响,本课题组初步探索了ChrA工程菌铬(Ⅵ)外排的机制。随着含铬(Ⅵ)培养时间的增长,ChrA工程菌铬(Ⅵ)外排量逐渐减少,推测可能是铬(Ⅵ)还原成了铬(Ⅲ),在生理pH条件下,铬(Ⅲ)主要以不可溶的氧化物或者氢氧化物形式存在,导致其不能由ChrA蛋白排出细胞外[25],但由于实验条件有限不能进一步验证。另一种原因可能由于时间过长,铬(Ⅵ)与胞浆成分发生了结合。Broer等[26]报道过在较长时间的放射性砷元素缓冲液中孵育后,表达砷抗性操纵子的菌株Staphylococcus aureus在无砷环境下培养一段时间,细胞内仍然有较高水平的砷元素,并且增加细胞通透性也不能除去放射性,由此推测砷元素和胞浆成分发生了结合。
在含氧阴离子中发现硫酸盐和钼酸盐能抑制铬(Ⅵ)的外排。大多研究认为铬(Ⅵ)是通过细胞硫酸根离子通道进入细胞,是硫酸盐的毒性模拟物,具有竞争性抑制硫酸盐运输的能力;钼酸盐亦是另一种硫酸盐转运竞争抑制剂[27]。因此,推测ChrA蛋白可能与钼酸盐和硫酸盐结合从而抑制了铬(Ⅵ)的外排,但尚不清楚ChrA蛋白是否将钼酸盐和硫酸盐排出胞外使细胞具有相应的抗性能力;而其他含氧阴离子如钨酸盐和钒酸盐对铬(Ⅵ)外排无显著性抑制作用。以上结果表明铬(Ⅵ)是通过硫酸盐通道出入细胞,ChrA作为铬(Ⅵ)外排蛋白具有较高的特异性。
抑制剂中的NADH能显著促进ChrA工程菌对铬(Ⅵ)的外排,即ChrA蛋白介导的铬(Ⅵ)转运需要跨膜H+浓度梯度。而K+离子载体缬氨霉素和CN-能显著抑制工程菌外排铬(Ⅵ),表明细胞两侧的膜电位影响ChrA蛋白外排铬(Ⅵ)。综合以上结果说明ChrA蛋白外排铬(Ⅵ)是利用质子推动力通过细胞膜化学渗透作用把铬(Ⅵ)离子泵出细胞外。
本研究对沙雷氏菌S2中一个ChrA基因进行了克隆和表达,成功构建了ChrA工程菌,且工程菌对铬(Ⅵ)具备较强的抗性能力。为今后开展基因工程菌和铬(Ⅵ)抗性基因在铬(Ⅵ)污染土壤或水体中的实际运用奠定了基础,具有重要的开发价值。
| [1] | 贾燕, 白群华, 肖虹. 重庆市某电镀厂聚集区域铬污染状况调查[J]. 现代预防医学, 2014, 41(6): 978-80, 983. |
| [2] | 杨斌, 张刚, 李欲如, 等. 浙江省制革和电镀行业铬污染现状调研及治理对策[J]. 中国给水排水, 2016, 32(8): 22-8. |
| [3] | Karthik C, Barathi S, Pugazhendhi A, et al. Evaluation of Cr(Ⅵ) reduction mechanism and removal by Cellulosimicrobium funkei strain AR8, a novel haloalkaliphilic bacterium[J]. J Hazard Materials, 2017, 333: 42-53. DOI: 10.1016/j.jhazmat.2017.03.037. |
| [4] | Thatoi H, Das S, Mishra J, et al. Bacterial chromate reductase, a potential enzyme for bioremediation of hexavalent chromium:a review[J]. J Environ Manage, 2014, 146: 383-99. DOI: 10.1016/j.jenvman.2014.07.014. |
| [5] | Sarkar A, Sar P, Islam E. Hexavalent Chromium reduction by microbacterium oleivorans a1:a possible mechanism of ChromateDetoxification and-Bioremediation[J]. Recent Pat Biotechnol, 2016, 9(2): 116-29. DOI: 10.2174/187220830902160308192126. |
| [6] | Cervantes C, Ohtake H, Chu L, et al. Cloning, nucleotide sequence, and expression of the chromate resistance determinant ofPseudomonas aeruginosa plasmid pUM505[J]. J Bacteriol, 1990, 172(1): 287-91. DOI: 10.1128/jb.172.1.287-291.1990. |
| [7] | Nies A, Nies DH, Silver S. Nucleotide sequence and expression of a plasmid-encoded chromate resistance determinant from Alcaligenes eutrophus[J]. J Biol Chem, 1990, 265(10): 5648-53. |
| [8] | Aguilar-Barajas E, Paluscio E, Cervantes CA. Expression of chromate resistance genes from Shewanella sp strain ANA-3 in Escherichia coli[J]. FEMS Microbiol Lett, 2008, 285(1): 97-100. DOI: 10.1111/fml.2008.285.issue-1. |
| [9] | Chihomvu P, Stegmann P, Pillay M. Characterization and structure prediction of partial length protein sequences of pcoA, pcoR and chrB genes from heavy metal resistant bacteria from the Klip River, South Africa[J]. Int J Mol Sci, 2015, 16(4): 7352-74. DOI: 10.3390/ijms16047352. |
| [10] | Yun JH, Cho YJ, Chun J, et al. Genome sequence of the chromateresistant bacterium Leucobacter salsicius type strain M1-8(T)[J]. Stand Genomic Sci, 2014, 9(3): 495-504. |
| [11] | Gonzalez AJ, Caiman C, Gorino N, et al. Biotransformation of Chromium(Ⅵ) in liquid effluents by resistant bacteria isolated from the Matanza-Riachuelo basin, in Argentina[J]. Environ Technol, 2017, 9(4): 1-35. |
| [12] | Bharagava RN, Mishra S. Hexavalent chromium reduction potential of Cellulosimicrobium sp. isolated from common effluent treatment plant of tannery industries[J]. Ecotoxicol Environ Saf, 2017, 147: 102-9. |
| [13] | Banerjee S, Joshi SR, Mandal T, et al. Insight into Cr6+ reduction efficiency of Rhodococcus erythropolis isolated from coalmine waste water[J]. Chemosphere, 2017, 167: 269-81. DOI: 10.1016/j.chemosphere.2016.10.012. |
| [14] | Figueiredo NL, Canario J, Serralheiro ML, et al. Optimization of microbial detoxification for an aquatic mercury-contaminated environment[J]. J Toxicol Environ Health A, 2017, 8(29): 1-9. |
| [15] | Mateos LM, Villadangos AF, de la Rubia AG, et al. The arsenic detoxification system in corynebacteria:basis and application for bioremediation and redox control[J]. Adv Appl Microbiol, 2017, 99: 103-37. DOI: 10.1016/bs.aambs.2017.01.001. |
| [16] | Story S, Brigmon RL. Influence of triethyl phosphate on phosphatase activity in shooting range soil:Isolation of a zinc-resistant bacterium with an acid phosphatase[J]. Ecotoxicol Environ Saf, 2017, 137: 165-71. DOI: 10.1016/j.ecoenv.2016.12.003. |
| [17] | Fernandez PM, Cruz EL, Vinarta SC, et al. Optimization of culture conditions for growth associated with Cr(Ⅵ)removal by wickerhamomyces anomalus M10[J]. Bull Environ Contam Toxicol, 2017, 98(3): 400-6. DOI: 10.1007/s00128-016-1958-5. |
| [18] | 谭小庆, 白群华, 韩令力, 等. 耐铬沙雷氏菌CQMUS2 FMN_red基因片段的克隆与序列分析[J]. 生物技术, 2013, 23(5): 8-11. |
| [19] | Deng P, Tan X, Wu Y, et al. Cloning and sequence analysis demonstrate the chromate reduction ability of a novel chromate reductase gene from Serratia sp[J]. Exp Ther Med, 2015, 9(3): 795-800. DOI: 10.3892/etm.2014.2148. |
| [20] | He MY, Li XY, Guo L, et al. Characterization and genomic analysis of chromate resistant and reducing Bacillus cereus strain SJ1[J]. BMC Microbiol, 2010, 10(1): 1-10. DOI: 10.1186/1471-2180-10-1. |
| [21] | He MY, Li XY, Liu HL, et al. Characterization and genomic analysis of a highly chromate resistant and reducing bacterial strain Lysinibacillus fusiformis ZC1[J]. J Hazard Mater, 2011, 185(2/3): 682-8. |
| [22] | Pimentel BE, Moreno-Sanchez R, Cervantes C. Efflux of chromate by Pseudomonas aeruginosa cells expressing the ChrA protein[J]. FEMS Microbiol Lett, 2002, 212(2): 249-54. DOI: 10.1111/fml.2002.212.issue-2. |
| [23] | Nies DH, Rehbein G, Hoffmann T, et al. Paralogs of genes encoding metal resistance proteins in Cupriavidus metallidurans strain CH34[J]. J Mol Microbiol Biotechnol, 2006, 11(1/2): 82-93. |
| [24] | Joutey NT, Sayel H, Bahafid W, et al. Mechanisms of hexavalent Chromium resistance and removal by microorganisms[J]. Rev Environ Contam Toxicol, 2015, 233(121): 45-69. |
| [25] | Das S, Dash HR, Chakraborty J. Genetic basis and importance of metal resistant genes in bacteria for bioremediation of contaminated environments with toxic metal pollutants[J]. Appl Microbiol Biotechnol, 2016, 100(7): 2967-84. DOI: 10.1007/s00253-016-7364-4. |
| [26] | Bröer S, Ji G, Bröer A, et al. Arsenic efflux governed by the Arsenic resistance determinant of Staphylococcus aureus plasmid pI258[J]. J Bacteriol, 1993, 175(11): 3480-5. DOI: 10.1128/jb.175.11.3480-3485.1993. |
| [27] | Moreno-Martinez E, Vallieres C, Holland SL. Novel, synergistic antifungal combinations that target translation fidelity[J]. Sci Rep, 2015, 5(17): 16700. |
 2017, Vol. 37
2017, Vol. 37

