2. 南方医科大学南方医院胸外科,广东 广州 510515;
3. 北京大学人民医院胸外科,北京 100044
2. Department of Thoracic Surgery, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Department of Thoracic Surgery, Peking University People's Hospital, Peking University, Beijing 100044, China
胸腺瘤起源于胸腺上皮细胞,是前纵膈较常见的肿瘤,目前跟据WHO的病理分型标准主要将胸腺瘤分为五型,根据文献报道,一般认为A、AB、B1型相对于B2、B3型和胸腺癌有较好的生物学特征及预后,但是仍然有争议[1]。而Masaoka分期标准也是常用的临床进展分期标准[2]。目前胸腺瘤的治疗主要根据疾病的病理分型、临床分期,手段主要包括外科手术、化疗、放疗等。但是,胸腺瘤患者常伴有一些严重并发症如重症肌无力等,对于伴有重症肌无力等并发症患者的治疗方法的选择仍有一定困难。现报道本科2010年6月收治的一例伴有重症肌无力的巨大胸腺瘤患者并成功手术切除的案例并结合文献讨论该类疾病的治疗方法。
1 病例介绍 1.1 一般资料患者李某,男性,32岁,既往“重症肌无力”病史5年,规律服用“溴比斯的明”,现以“活动后突发胸闷”于2010年6月来我科就诊,入院胸片示前上纵膈肿物,胸部PET-CT示:前上纵膈胸腺区可见一巨大分叶状软组织肿块,边界清楚最大层面9.3 cm×6.2 cm×10.1 cm,侵入纵膈内血管间隙并侵及心包。增强胸部CT示:前上纵膈胸腺区可见一巨大分叶状软组织肿块,边界清楚最大层面12.4 cm×4.5 cm,行胸部穿刺活检示:A型胸腺瘤(图 1)。
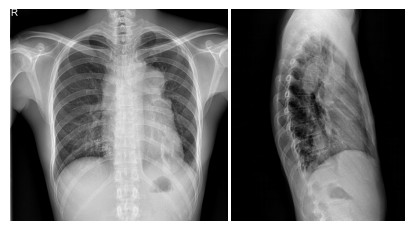
|
图 1 患者入院时胸部正侧位片 Figure 1 Posterior-anterior and lateral chest X-ray before surgery |
因肿物较大,先予以新辅助放化疗,术前予以洛铂+异环磷酰胺+表柔比星+长春新碱规范化疗两个疗程,配合放疗两个疗程,放化疗后复查胸部CT患者胸腺瘤较前无明显缩小(图 2),且患者胸闷、呼吸困难症状无明显减轻,遂决定于2010年10月15日行手术治疗。手术经胸骨正中劈开胸骨,切口长约20 cm,进入胸腔。胸腔探查见前上纵膈区有一巨大不规则软组织肿块,17 cm× 14 cm×4 cm,侵犯双侧纵膈胸膜、双侧膈神经、心包及部分左上肺组织。遂予以完整分离巨大肿块,切除肿块右侧膈神经,切除肿块左侧部分心包组织、左侧纵膈胸膜、膈神经及部分左上肺组织,做整块切除。清扫心包上缘、双侧无名静脉下缘之间的脂肪组织。术程顺利,术中出血约300 mL,术后病理符合A型胸腺瘤。术后患者相继出现重症肌无力加重危象、呼吸功能衰竭、呼吸机相关肺炎(痰培养出泛耐药铜绿假单胞菌)、气胸、支气管胸膜瘘、脓胸、胸骨切口感染(培养出泛耐药鲍曼不动杆菌)等并发症,后于重症监护室予以气管切开、呼吸机辅助呼吸、调整溴比斯的明用量(最高时45 mg,4次/d,后逐渐减少),抗感染(前后共调整使用头孢匹胺、头孢甲肟、头孢哌酮钠舒巴坦钠、拉氧头孢、多西环素、头孢他啶、左氧氟沙星、磺胺甲噁唑、头孢哌酮舒巴坦、美罗培南、亚胺培南/西司他丁钠、甲硝唑、奥硝唑、伏立康唑、伊曲康唑等10余种抗生素)处理后,患者病情逐渐好转(图 3),患者围手术期共住院252 d,其中使用呼吸机102 d。患者出院后定期复查(图 4),指导其在家间断使用简易呼吸机治疗,目前已随访6年余,期间因重症肌无力加重导致呼吸困难行气管切开,后调整用药后患者病情稳定,现可每日跑步5 km并与夫人育有一子。
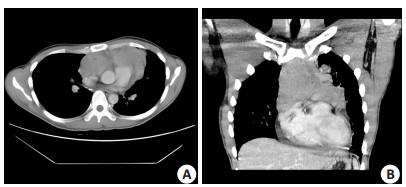
|
图 2 患者入院时胸部CT检查结果 Figure 2 Chest CT scans at first visit. |
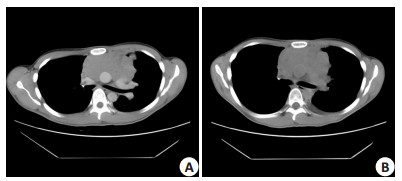
|
图 3 患者放化疗前后胸部CT检查的对比 Figure 3 Comparison of chest CT before (A) and after (B) radiotherapy and chemotherapy. |
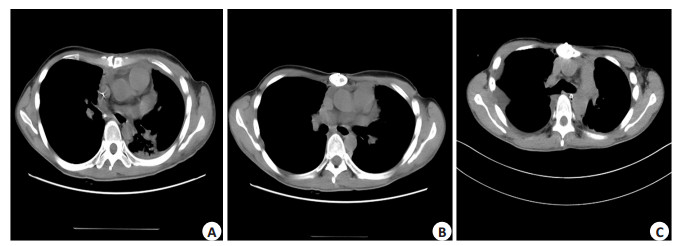
|
图 4 患者术后6个月、1年、3年复查胸部CT情况 Figure 4 Chest CT scans at 6 months (A), 1 year (B) and 3 years (C) after surgery. |
据文献报道,在美国胸腺瘤发病率为0.13~0.15/10万[3],目前对于胸腺瘤的治疗方法仍然是以外科手术治疗为主[4-5],手术切口的选择以良好的暴露、有利于肿瘤的切除为原则,最常见的手术切口是胸骨正中切口[6]。目前随着胸腔镜技术的发展,胸腔镜辅助胸腺瘤切除也正在逐渐开展,但是我们认为,对于较小的、包膜完整的胸腺瘤可以使用胸腔镜,但是对于较大的,侵犯周围组织严重的应该采取开胸手术,以获得更加清楚地暴露从而做到整块切除,Song等[7]的研究表明,手术切除的范围将明显影响患者的5年生存率,所以在手术时要尽可能做到根治性切除。
随着放射治疗技术的不断发展,放疗目前也在不断地应用于胸腺瘤的综合治疗,并且取得了不错的临床疗效。Berman等[8]通过对62名Masaoka分期Ⅱ期胸腺瘤患者的研究显示,手术后放疗能明显降低术后复发的概率。Yan等[9]的研究也表明,胸腺瘤手术切除加放疗的患者比只进行手术切除的患者有着更长的总生存期。但是Forquer等[10]通过对901名胸腺瘤患者的调查显示,术后放疗对于Masaoka分期较高的患者(Ⅱ~Ⅲ)期患者有明显的积极作用,而对于Ⅰ期的患者反而有消极作用。所以我们认为,对于分期较低的、病理学偏稳定的胸腺瘤来说,只进行根治性切除即可,而对于瘤体较大,病理学偏向恶性的胸腺瘤,则需要配合放化疗进行综合治疗。
重症肌无力是胸腺瘤常见的并发症,发生率约为20%~25% [11],而且手术后部分患者会出现重症肌无力危象,所以对于伴有重症肌无力的巨大胸腺瘤患者的治疗仍然有一定难度,虽然Lee等[12]报道了1例通过立体定向放疗(SBRT)治疗伴有重症肌无力的胸腺瘤患者的案例,但是仍然没有证据显示放疗对于该类病人的治疗有很大的优势, 并且放疗也有诱发重症肌无力危象的可能[13]。本例患者手术后出现重症肌无力危象并呼吸衰竭,我们推测可能有以下几方面原因:(1)患者手术损伤较大;(2)患者术前长期服用溴比斯的明;(3)术后感染;(4)手术时切除了双侧膈神经。所以我们果断的进行了气管切开、调整溴比斯的明用量等一系列处理,患者病情逐渐稳定。
手术等刺激常常会诱发重症肌无力危象,而良好的呼吸道管理是治疗重症肌无力危象的关键。我们总结战胜本危重病例的经验为:(1)可根据患者既往病史及手术情况,采取术后延迟拔除气管插管的方法预防呼吸衰竭的发生;(2)如患者发生重症肌无力危象,则可积极地进行气管切开;(3)患者应循序渐进的脱离呼吸机辅助呼吸,并可指导其使用家庭简易呼吸机治疗。本例患者住院期间共使用呼吸机102 d,出院后在家中按指导间断使用简易呼吸机,目前生活质量良好。
综上我们认为,对于伴有重症肌无力的胸腺瘤患者的治疗,仍然要以外科手术为主,但是要把握好手术时机,应该先用药物控制肌无力症状稳定后进行手术,在手术中要做到完整切除。
| [1] | Jiang W, Yu Q. Case report of thymoma tumor reduction following plasmapheresis[J]. Medicine (Baltimore), 2015, 94(47): e2173. DOI: 10.1097/MD.0000000000002173. |
| [2] | 苏家俊, 陈玉, 徐方平, 等. 胸腺瘤临床病理学与分子病理学研究进展[J]. 中华病理学杂志, 2015, 44(9): 683-5. |
| [3] | Lombe DC, Jeremic B. A review of the place and role of radiotherapy in thymoma[J]. Clin Lung Cancer, 2015, 16(6): 406-12. DOI: 10.1016/j.cllc.2015.05.003. |
| [4] | 王彬, 王波, 张连斌, 等. 58例胸腺癌的外科治疗及临床分析[J]. 解放军医学院学报, 2014, 35(6): 561-4. |
| [5] | 付浩, 陈克能. 胸腺癌的诊治现状与争议[J]. 中华胸心血管外科杂志, 2015, 31(2): 126-8. |
| [6] | 张志庸, 陈涛, 崔玉尚, 等. 胸腺癌的外科治疗与预后[J]. 中国胸心血管外科临床杂志, 2005, 12(6): 377-80. |
| [7] | Song Z, Jin X, Zhang Y. Treatment and prognosis of type B2 thymoma[J]. World J Surg Oncol, 2014, 12: 291. DOI: 10.1186/1477-7819-12-291. |
| [8] | Berman AT, Litzky L, Livolsi V, et al. Adjuvant radiotherapy for completely resected stage 2 thymoma[J]. Cancer, 2011, 117(15): 3502-8. DOI: 10.1002/cncr.v117.15. |
| [9] | Yan J, Liu Q, Moseley JN, et al. Adjuvant radiotherapy for stages Ⅱ and Ⅲ resected thymoma: a single-institutional experience[J]. Am J Clin Oncol, 2016, 39(3): 223-7. DOI: 10.1097/COC.0000000000000044. |
| [10] | Forquer JA, Rong N, Fakiris AJ, et al. Postoperative radiotherapy after surgical resection of thymoma: differing roles in localized and regional disease[J]. Int J Radiat Oncol Biol Phys, 2010, 76(2): 440-5. DOI: 10.1016/j.ijrobp.2009.02.016. |
| [11] | Tormoehlen LM, Pascuzzi RM. Thymoma, myasthenia gravis, and other paraneoplastic syndromes[J]. Hematol Oncol Clin North Am, 2008, 22(3): 509-26. DOI: 10.1016/j.hoc.2008.03.004. |
| [12] | Lee CM, Lee JD, Hobson-Webb LD, et al. Treatment of ThymomaAssociated myasthenia gravis with stereotactic body radiotherapy: a case report[J]. Ann Intern Med, 2016, 165(4): 300-1. DOI: 10.7326/L15-0469. |
| [13] | 潘德键, 周锡建, 许亚凤. 胸腺瘤患者伽玛射线立体定向放疗期间突发重症肌无力危象1例报告[J]. 实用癌症杂志, 2011, 26(5): 514-6. |
 2017, Vol. 9
2017, Vol. 9

