2. 西南医科大学药学院,四川 泸州 646000;
3. 重庆三峡中心医院新生儿科,重庆 404000;
4. 重庆三峡中心医院药学部,重庆 404000
2. School of Pharmacy, Southwest Medical University, Luzhou 646000, China;
3. Department of Neonatology, Chongqing Three Gorges Central Hospital, Chongqing 404000, China;
4. Department of Pharmacy, Chongqing Three Gorges Central Hospital, Chongqing 404000, China
银屑病是一种由免疫介导的慢性炎症性皮肤疾病。流行病学调查发现,全世界范围内其发病率为1.5%~3.0% [1]。银屑病病情顽固、易反复发作,同时与心血管疾病、糖尿病、肥胖病和代谢综合征等慢性疾病也密切相关,给患者的身心健康和生活质量带来了严重的影响[2-3]。近年来,以肿瘤坏死因子(TNF)抑制剂为代表的靶向生物制剂广泛应用于对传统抗银屑病药物抵抗的银屑病患者,取得了较好的临床疗效。但临床研究证实TNF抑制剂增加了患者发生恶性肿瘤和严重感染的风险,同时部分患者还出现对TNF抑制剂抵抗的现象,因而临床对银屑病的治疗面临着新的挑战[4]。IL-17是T细胞诱导的炎症反应的早期启动因子,在引发炎症反应中起重要的介导作用[5],患者受损皮肤及外周血中IL-17的浓度较正常人显著增加。抗IL-17抗体可选择性阻断炎症级联反应,从而很大程度上缓解银屑病的皮肤症状[6]。抗IL-17抗体开发较为成功的有Secukinumab、Brodalumab及ixekizumab [7],目前,国内有关于Secukinumab治疗银屑病的系统评价报道,但纳入分析的文献数量较少,未和阳性药物比较,且未对不良反应进行详尽的分析。故抗IL-17抗体治疗银屑病的价值尚存在临床争议。本研究应用系统评价的思想对抗IL-17抗体对比安慰剂或阳性药物(Etanercep、Ustekinuma)治疗银屑病进行系统、全面的评价,进一步探讨抗IL-17抗体的临床疗效和安全性,以期为抗IL-17抗体的临床合理使用提供循证医学参考。
1 资料和方法 1.1 纳入与排除标准 1.1.1 研究类型临床随机对照试验(RCT),文献语种限定为中文或英文。
1.1.2 研究对象临床上诊断为斑块状银屑病患者。年龄≥18岁,性别不限。
1.1.3 干预措施抗IL-17抗体组Secukinumab(300 mg或150 mg,每4周1次)、Brodalumab(210 mg或140 mg,每2周1次)、Ixekizumab(起始给药剂量160 mg,之后每2周给药剂量80 mg);阳性药物组:Etanercep(50 mg,每周2次)、Ustekinumab(患者体质量≤100 kg,用45 mg;体质量>100 kg,用90 mg,均为4周1次)。
1.1.4 结局指标疗效指标银屑病皮损面积和严重性指数积分下降≥75%的患者人数(PASI75)、临床医师总体评价(sPGA)皮肤损伤达到完全清除的患者人数;安全性指标:总不良事件发生率、严重不良事件发生率、因不良事件退出率。
1.1.5 排除标准(1)回顾性研究;(2)重复发表文献;(3)不能提供有效分析数据(包括一般资料)且联系作者无果;(4)试验方案设计不合理或不严谨;(5)脓疱型银屑病、点滴状银屑病以及红皮病型银屑病等。
1.2 检索策略计算机检索PubMed、Cochrane Library、EBSCO、EMbase、CBM、CNKI、VIP及万方数据库,检索时间截止到2017年3月。中文检索词为:白细胞介素17、白细胞介素-17、IL-17、Secukinumab(苏金单抗)、Brodalumab(布罗达单抗)、Ixekizumab(taltz,艾克珠单抗)、bimekizumab(优时比)、银屑病。中文检索策略为:(白细胞介素17 OR白细胞介素-17 OR IL-17 OR Secukinumab OR Brodalumab OR布罗达单抗OR Ixekizumab OR艾克珠单抗OR bimekizumab OR优时比) AND银屑病。英文检索词为:interleukin-17、interleukin17、IL-17、Anti-interleukin-17 antibody、Anti-IL-17、Secukinumab、Brodalumab、Ixekizumab、bimekizumab、Plaque Psoriasis。英文检索策略为:(interleukin-17 OR interleukin17 OR IL-17 OR Anti-interleukin-17 antibody OR Anti-IL-17 OR Secukinumab OR Brodalumab OR Ixekizumab OR bimekizumab)AND Plaque Psoriasis。采用主题词与自由词相结合的方式进行文献检索。并在获取的文献中追踪检索相关的参考文献,以找寻符合要求的研究。
1.3 数据提取与质量评价 1.3.1 数据提取由2名研究者严格按照纳入与排除标准独立进行资料提取(一般资料和结局指标),并进行交叉核对检验,如遇分歧则由第3位研究者协助解决。资料提取完成后进行文献方法学质量评价。
1.3.2 文献质量评价采用Cochrane偏倚风险评估工具[8]对纳入RCT进行偏倚风险评估,包括:(1)随机序列的产生;(2)分配隐藏;(3)对研究者、受试者及研究结果测量者实施盲法;(4)结果数据的完整性:包括干预前各组基线水平是否一致,有无失访或退出,是否说明失访或退出原因以及是否进行意向性(ITT)分析;(5)选择性报告研究结果:对于重要安全性问题(如死亡、恶性肿瘤等不良事件)是否选择性报道、阴性结果是否进行报道;(6)其他偏倚来源。对每个条目根据偏倚风险评估准则作出“低风险偏倚”、“高风险偏倚”、“不清楚”的判定。原始研究完全符合上述标准,提示发生各种偏倚的风险最低,其质量评价为“A”;原始文献部分满足上述标准,提示发生偏倚风险为中度,其质量评价为“B”;原始文献完全不满足上述标准,提示发生偏倚的风险最高,其质量评价为“C”。
1.4 统计学方法采用Cochrane协作网推荐的RevMan 5.0统计软件进行Meta分析。PASI75、sPGA、总不良事件发生率、严重不良事件发生率、因不良事件退出率均采用危险比(relative risk, RR)及其95%可信区间(95% Cl)为效应量分析其统计量。采用χ2检验检测纳入分析的各研究间的异质性,当各研究间无统计学同质性(P>0.1,I2 < 50%)时,采用固定效应模型进行合并分析;当各研究间存在统计学异质性(P≤0.1,I2≥50%)时,则分析其异质性来源(如剂量、疗程、干预措施等差异),对可能造成异质性的因素行亚组分析,若研究结果间存在统计学异质性而无临床异质性,则采用随机效应模型进行合并分析,同时进行敏感性分析,并谨慎解释Meta分析结果。若研究间异质性过大或无法找寻数据来源时则行描述性分析。
2 结果 2.1 文献检索结果按照检索策略,初步检索相关文献889篇,用Endnote软件去重372篇,严格依照纳入与排除标准逐层筛选后,最终纳入10篇文献[9-18],涉及13项RCT,均为英文文献。其中Secukinumab5项,Brodalumab5项,Ixekizumab3项。
2.2 纳入研究的基本特征与质量评价共纳入13项RCT,合计11203例患者,均为多中心临床研究。各项研究中试验组与对照组在年龄、性别比例、疾病严重程度、病程、治疗周期等基线均衡,有可比性。纳入的13项RCT均对实验者和受试者实施了盲法,有2项RCT [14, 16]未提及具体的随机方法;8项RCT阐述了分配隐藏;13项RCT均详细的描述了具体退出和失访的原因,并进行了意向性分析。最终文献质量评价均为B,总体上说文献质量较高(表 1)。
| 表 1 纳入文献的基本信息和质量评价 Table 1 Basic information and quality evaluation of the RCTs included in the analysis |
有12项RCT报道了抗IL-17抗体对比安慰剂治疗斑块状银屑病关于PASI75指标的结果,其中抗IL-17抗体组6790例,12周末达到PASI75指标的5364例(79.00%),安慰剂组2402例,达到PASI75指标的116例(4.83%)。结果显示,抗IL-17抗体较安慰剂可显著增加PASI75的达标率[RR= 15.84,95% CI(13.29~18.89),P < 0.001]。异质性检验P=0.05,I2=44%,表明各研究间存在中度异质性,故对3个抗IL-17抗体进行亚组分析,Secukinumab亚组(I2= 0%)与Brodalumab亚组(I2=43%)的异质性均有一定的降低。Meta分析结果显示:Secukinumab(P < 0.001)、Brodalumab(P < 0.001)及Ixekizumab(P < 0.001)PASI75指标达标率较安慰剂高,差异均有统计学意义(图 1)。
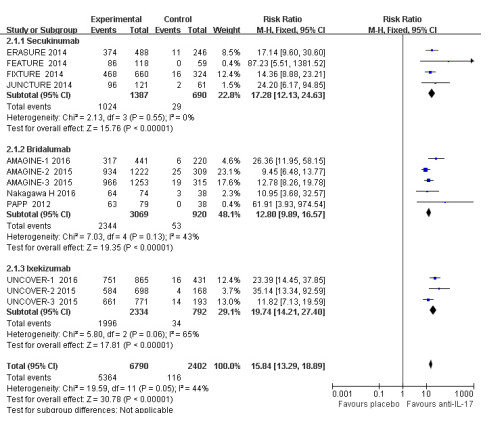
|
图 1 抗IL-17抗体对比安慰剂PASI75的Meta分析森林图 Figure 1 Forest plot of meta-analysis for PASI75 between anti IL -17 antibody and placebo. |
有6项RCT报道了抗IL-17抗体对比阳性药物(Etanercept、Ustekinumab)治疗斑块状银屑病关于PASI75指标的结果,其中抗IL-17抗体组4938例,12周末达到PASI75指标的3917例(79.32%),阳性药物组2011例,达到PASI75指标的1187例(59.03%)。结果显示,抗IL-17抗体较阳性药物可显著增加PASI 75的达标率[P < 0.0001,RR=1.39,95% Cl(1.14~1.68)]。异质性检验P < 0.001,I2=96%,表明各研究间较大异质性,对2个阳性药物进行亚组分析,Etanercept亚组(I2=77%)与Ustekinumab亚组(I2= 0%)异质性均有明显降低。Meta分析结果显示:抗IL-17抗体在PASI75指标达标率较Etanercep(P < 0.001)和Ustekinumab(P < 0.001)高,差异有统计学意义(图 2)。
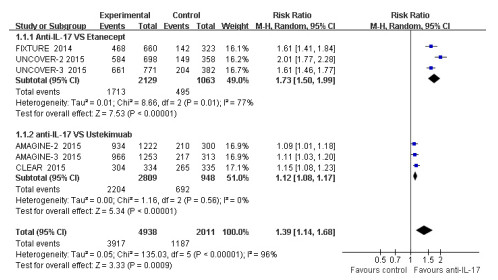
|
图 2 抗IL-17抗体对比阳性药物PASI75的Meta分析森林图 Figure 2 Forest plot of meta-analysis for PASI75 between anti IL-17 antibody and positive drug. |
有8项RCT报道了抗IL-17抗体对比安慰剂治疗斑块状银屑病关于sPGA的结果,其中抗IL-17抗体组5403例,12周末达到sPGA指标的3954例(73.18%),安慰剂组1712例,达到sPGA指标的62例(3.62%)。异质性检验P=0.27,I2=21%,表明各研究间无统计学异质性,采用固定效应模型进行合并分析,Meta分析结果显示,抗IL-17抗体在sPGA指标的达标率显著高于安慰剂组[RR=19.94,95% Cl(15.63~25.43),P < 0.001],差异有统计学意义(图 3)。
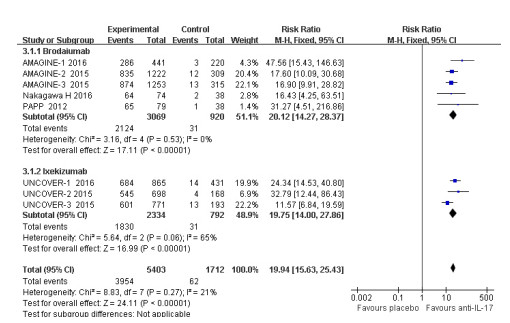
|
图 3 抗IL-17抗体对比安慰剂sPGA的Meta分析森林图 Figure 3 Forest plot of meta-analysis for sPGA between anti IL-17 antibody and placebo |
有4项RCT报道了抗IL-17抗体对比阳性药物(Etanercept、Ustekinumab)治疗斑块状银屑病关于sPGA的结果,其中抗IL-17抗体组3944例,12周末达到sPGA指标的2855例(72.39%),阳性药物组1353例,达到sPGA指标的650例(48.04%),抗IL-17抗体较阳性药物可显著增加sPGA的达标率[P=0.007,RR=1.53,95% Cl(1.12~ 2.09)]。异质性检验P<0.001,I2=97%,表明各研究间较大异质性,对2个阳性药物进行亚组分析,Etanercept亚组(I2=56%)与Ustekinumab亚组(I2=28%)异质性均有明显降低。Meta分析结果显示:抗IL-17抗体在sPGA指标达标率较Etanercep(P < 0.001)和Ustekinumab(P=0.0003)高,差异有统计学意义(图 4)。
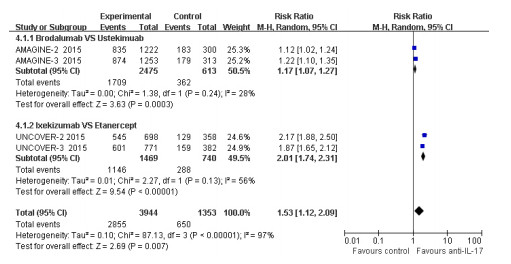
|
图 4 抗IL-17抗体对比阳性药物sPGA的Meta分析森林图 Figure 4 Forest plot of meta-analysis for PASI75 between anti IL-17 antibody and positive drug. |
异质性检验结果显示,各研究间无统计学异质性(I2=0%),故用固定效应模型进行合并分析。抗IL-17抗体治疗斑块状银屑病总不良事件发生率较安慰剂高[RR=1.18,95%Cl(1.12~1.24),P < 0.001];抗IL-17抗体对比阳性药物其总不良事件发生率(P=0.46)、严重不良事件发生率(P=0.36)、因不良事件退出率(P=0.44)均无统计学差异;抗IL-17抗体对比安慰剂在严重不良事件发生率(P=0.70)以及因不良事件退出率(P=0.33)均无统计学意义(表 2)。
| 表 2 安全性指标Meta分析汇总表 Table 2 Summary table of the safety indexes in meta-analysis |
对疗效及安全性的各项指标进行Meta分析时,逐一去除权重比例差异较大RCT(同时改变统计模型)后重新进行Meta分析,排出后的结果与之前分析结果未发生较大的变化,提示敏感性低,结果较为稳健可信。
2.6 发表偏倚分析本次供分析的漏斗图是基于纳入RCT数目较多指标绘制而成,选取的指标为严重不良事件发生率及PASI75。图中各研究散点沿中心线基本对称,且散点落在可信区间内,表明存在发表偏倚的可能性较小(图 5)
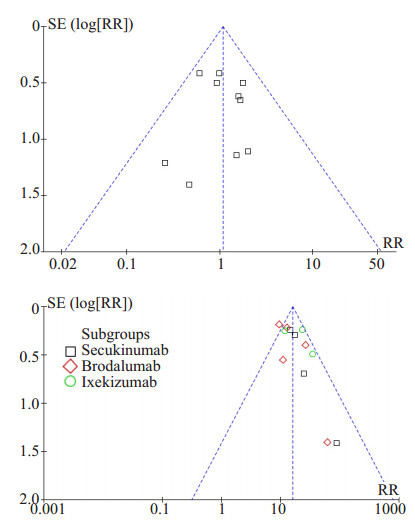
|
图 5 严重不良事件及PASI 75指标的Meta分析漏斗图 Figure 5 Funnel plot of meta-analysis for serious adverse events and PASI75. |
银屑病病理机制为Th17和Th1淋巴细胞以及抗原呈递细胞的活性增加,产生大量炎症细胞因子介导炎症反应,从而使表皮细胞与微血管异常增生,临床表现为明显的鳞屑状红斑和不同程度的自觉症状,严重影响患者的身心健康和生活质量[19-20]。目前,阿达木单抗、依那西普、英夫利昔单抗等TNF抑制剂和抗IL-12/23抗体ustekinumab已成为严重银屑病患者的较为常见的生物制剂[21]。然而,由于TNF抑制剂与感染和恶性肿瘤相关,且存在高达40%的患者对现有生物治疗反应不佳或无反应,从而出现生物制剂疲劳现象[22]。抗IL-17抗体的出现为银屑病患者提供了更多治疗选择,IL-17是Th17细胞主要的效应因子,在银屑病的发病过程中扮演者重要的角色[23]。抗IL-17抗体阻止IL-17与其受体结合,从而阻断引起斑块状银屑病的炎症反应[24]。
3.2 临床疗效分析本次分析结果显示,在PASI75疗效指标上,抗IL-17抗体显著优于阳性药物组,但表现出较大的临床异质性(I2=96%),临床研究发现,在治疗斑块状银屑病五年时限里,Ustekinumab较Etanercep临床疗效更好,且剂量的变更次数更少[25-26]。因此,将阳性药物组分为Etanercep亚组(I2=77%)和Ustekinumab亚组(I2= 0%),2亚组的异质性均有明显的减少,同时亚组结果显示,抗IL-17抗体在PASI75指标优于Etanercep和Ustekinumab;在sPGA疗效指标上,同样对Etanercep和Ustekinumab行亚组分析,总的异质性从I2=96%下降至I2=28%(Ustekinumab亚组)和I2=56%(Etanercep亚组),可见本次按照阳性药物的不同进行亚组分析较为合理。亚组结果显示抗IL-17抗体在sPGA指标优于2个阳性药物;抗IL-17抗体与安慰剂比较PASI75和sPGA指标上均优于安慰剂组。可以得知,抗IL-17抗体治疗斑块状银屑病显示出了强大的临床疗效,且优于Etanercep和Ustekinumab。但对我国银屑病患者是否具有同样临床疗效需要临床试验加以验证。
3.2 安全性分析本次分析结果显示,在安全性指标中,总不良事件发生率、严重事件反应发生率、因不良事件而退出率3个指标Meta分析时,纳入分析的各项研究均无临床异质性(I2=0%),均采用固定效应模型进行合并分析,研究结果发现,抗IL-17抗体总不良时间发生率高于安慰剂组,严重不良反应事件和因不良反应事件退出的发生率与安慰剂相当,差异无统计学意义;3项安全性指标中,抗IL-17抗体与Etanercep和Ustekinumab的发生率相当,有研究显示,secukinumab、ixekizumab、Brodalumab在常规剂量上治疗斑块状银屑病具有较好的耐受性,和本研究结果基本吻合[27-29]。可以得知,抗IL-17抗体安全性较高,但是本研究只纳入了12周的安全性数据加以分析,因此随着抗IL-17抗体的长期使用,会不会导致严重的安全性问题还需长期的随访过程中严密观察,如发现应立即停药。
3.4 本研究的局限性本研究纳入的文献方法学质量较高,但也存在一定的局限性:(1)缺乏药品上市后的临床研究;(2)纳入的文献缺乏未发表的灰色研究,可能遗漏部分阴性结果而导致发表偏倚,甚至对Meta分析的最终结果产生影响;(3)纳入研究的人群中美国和加拿大人较多,因为人种的差异,尚不能将其结果推广至全世界所有人群;(4)由于纳入RCT的剂量较为多样,每个代表药物本次只选用了临床较为常用的两个剂量(12周末)的指标进行了分析,其他剂量的疗效和安全性尚需进一步考究。综上所述,抗IL-17抗体短期内疗效较好,安全性亦较高,可为临床治疗斑块状银屑病提供新的选择,值得临床进一步研究探讨。但该研究结论尚需更多大样本、多中心、高质量临床试验予以进一步证实。
| [1] | Bartlett HS, Million RP. Targeting the IL-17-TH17 pathway[J]. Nat Rev Drug Discov, 2015, 14(1): 11-2. |
| [2] | Ryan C, Kirby B. Psoriasis is a systemic disease with multiple cardiovascular and metabolic comorbidities[J]. Dermatol Clin, 2015, 33(1): 41-55. DOI: 10.1016/j.det.2014.09.004. |
| [3] | Mitra A, Fallen RS, Lima HC. Cytokine-Based therapy in psoriasis[J]. Clin Rev Allergy Immunol, 2013, 44(2): 173-82. DOI: 10.1007/s12016-012-8306-2. |
| [4] | 汪汀, 林碧蓉, 马英. 抗白细胞介素-17抗体治疗自身免疫性疾病的临床研究[J]. 中国新药杂志, 2016, 25(22): 2531-6. |
| [5] | Durham LE, Kirkham BW, Taams LS. Contribution of the IL-17 pathway to psoriasis and psoriatic arthritis[J]. Curr Rheumatol Rep, 2015, 17(8): 55. DOI: 10.1007/s11926-015-0529-9. |
| [6] | Adami S, Cavani A, Rossi F, et al. The role of interleukin-17A in psoriatic disease[J]. BioDrugs, 2014, 28(6): 487-97. DOI: 10.1007/s40259-014-0098-x. |
| [7] | 楼莹, 王绪国, 胡晋红. 同时治疗银屑病及银屑病型关节炎的生物及小分子药物研究进展[J]. 第二军医大学学报, 2015, 36(5): 542-7. |
| [8] | www. cochrane-handbook. org |
| [9] | Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis--results of two phase 3 trials[J]. N Engl J Med, 2014, 371(4): 326-38. DOI: 10.1056/NEJMoa1314258. |
| [10] | Paul C, Lacour JP, Tedremets L, et al. Efficacy, safety and usability of secukinumab administration by autoinjector/pen in psoriasis: a randomized, controlled trial (JUNCTURE)[J]. J Eur Acad Dermatol Venereol, 2015, 29(6): 1082-90. DOI: 10.1111/jdv.12751. |
| [11] | Blauvelt A, Prinz JC, Gottlieb AB, et al. Secukinumab administration by prefilled syringe:efficacy, safety and usability results from a randomized controlled trial in psoriasis (FEATURE)[J]. Br J Dermatol, 2015, 172(2): 484-93. DOI: 10.1111/bjd.2015.172.issue-2. |
| [12] | Tha?i D, Blauvelt A, Reich K, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate to severe plaque psoriasis: CLEAR, a randomized controlled trial[J]. J Am Acad Dermatol, 2015, 73(3): 400-9. DOI: 10.1016/j.jaad.2015.05.013. |
| [13] | Lebwohl M, Strober B, Menter A, et al. Phase 3 studies comparing brodalumab with ustekinumab in psoriasis[J]. N Engl J Med, 2015, 373(14): 1318-28. DOI: 10.1056/NEJMoa1503824. |
| [14] | Papp KA, Leonardi C, Menter A, et al. Brodalumab, an anti-interleukin-17-receptor antibody for psoriasis[J]. N Engl J Med, 2012, 366(13): 1181-9. DOI: 10.1056/NEJMoa1109017. |
| [15] | Nakagawa H, Niiro H, Brodalumab OK. A human antiinterleukin-17 receptor antibody in the treatment of Japanese patients with moderate-to-severe plaque psoriasis: efficacy and safety results from a phase Ⅱ randomized controlled study[J]. J Dermatol Sci, 2016, 81(1): 44-52. DOI: 10.1016/j.jdermsci.2015.10.009. |
| [16] | Papp KA, Reich K, Paul C, et al. A prospective phase 3, randomised, double-blind, placebo-controlled study of brodalumab in patients with moderate-to-severe plaque psoriasis[J]. Br J Dermatol, 2016, 175(2): 273-86. DOI: 10.1111/bjd.14493. |
| [17] | Griffiths CE, Reich K, Lebwohl M, et al. Comparison of ixekizumab with etanercept or placebo in moderate-to-severe psoriasis (UNCOVER-2 and UNCOVER-3): results from two phase 3 randomised trials[J]. Lancet, 2015, 386(9993): 541-51. DOI: 10.1016/S0140-6736(15)60125-8. |
| [18] | Gordon KB, Blauvelt A, Papp KA, et al. Phase 3 trials of ixekizumab in Moderate-to-Severe plaque psoriasis[J]. N Engl J Med, 2016, 375(4): 345-56. DOI: 10.1056/NEJMoa1512711. |
| [19] | Adelzadeh L, Jourabchi N, Wu JJ. The risk of herpes zoster during biological therapy for psoriasis and other inflammatory conditions[J]. J Eur Acad Dermatol Venereol, 2014, 28(7): 846-52. DOI: 10.1111/jdv.12307. |
| [20] | 岳颖, 郑礼胜, 刘巍. 银屑病的生物制剂治疗研究进展[J]. 现代药物与临床, 2014, 29(8): 940-6. |
| [21] | 杨益平. 银屑病治疗用抗体药物研发近况[J]. 药学进展, 2017, 41(1): 71-6. |
| [22] | Levin EC, Gupta R, Brown G, et al. Biologic fatigue in psoriasis[J]. J Dermatolog Treat, 2014, 25(1): 78-82. DOI: 10.3109/09546634.2013.826341. |
| [23] | Kirkham BW, Kavanaugh A, Reich K. Interleukin-17a: a unique pathway in immune-mediated diseases: psoriasis, psoriatic arthritis and rheumatoid arthritis[J]. Immunology, 2014, 141(2): 133-42. DOI: 10.1111/imm.2014.141.issue-2. |
| [24] | Reich K, Burden AD, Eaton JN, et al. Efficacy of biologics in the treatment of moderate to severe psoriasis: a network meta-analysis of randomized controlled trials[J]. Br J Dermatol, 2012, 166(1): 179-88. DOI: 10.1111/j.1365-2133.2011.10583.x. |
| [25] | Zweegers J, Groenewoud JMM, Van Den Reek JMPA, et al. Comparison of the 1-and 5-year effectiveness of adalimumab, etanercept and ustekinumab in patients with psoriasis in daily clinical practice: results from the prospective BioCAPTURE registry[J]. Br J Dermatol, 2017, 176(4): 1001-9. DOI: 10.1111/bjd.15023. |
| [26] | Richter L, Vujic I, Sesti A, et al. Etanercept, adalimumab und ustekinumab bei psoriasis: analyse von 209 behandlungsreihen in?sterreich[J]. J Dtsch Dermatol Ges, 2017, 15(3): 309-18. |
| [27] | Xiong HZ, Gu JY, He ZG, et al. Efficacy and safety of secukinumab in the treatment of moderate to severe plaque psoriasis: a meta-analysis of randomized controlled trials[J]. Int J Clin Exp Med, 2015, 8(3): 3156-72. |
| [28] | Leonardi C, Matheson R, Zachariae C, et al. Anti-interleukin-17 monoclonal antibody ixekizumab in chronic plaque psoriasis[J]. N Engl J Med, 2012, 366(13): 1190-9. DOI: 10.1056/NEJMoa1109997. |
| [29] | Umezawa Y, Nakagawa H, Niiro H, et al. Long-term clinical safety and efficacy of brodalumab in the treatment of Japanese patients with moderate-to-severe plaque psoriasis[J]. J Eur Acad Dermatol Venereol, 2016, 30(11): 1957-60. |
 2017, Vol. 9
2017, Vol. 9

