2. 新疆喀什地区第一人民医院消化内科,新疆 喀什 844000
2. Dpartment of Gastroenterology, Kashi First People's Hospital, Kashi 84400, China
急性胰腺炎是消化系统常见疾病,其重症类型(SAP)因出现持续器官功能衰竭[1-3],死亡率可达30%左右[4-5]。因此,对于入院的AP患者,首要是早期评估,识别潜在的SAP,进而予以密切监测和积极干预以提高生存率。基于此,急性胰腺炎严重度评分系统及判断指标的制定和探究意义重大。目前急性生理学和慢性健康评分Ⅱ量表(APACHE-Ⅱ)预测急性胰腺炎严重程度的有效性受到较多认可[6-7],但由于评价内容繁多,临床操作复杂。SAP早期阶段的器官衰竭往往始于全身炎症反应综合征(SIRS),中性粒细胞与淋巴细胞绝对计数比值(NLR)被证明是反映全身炎症反应水平的一项快速、简便的指标,国内外研究发现其在判断急性胰腺炎严重程度上具有一定价值[8-10]。单核细胞作为另一重要的炎细胞,以巨噬细胞的形式在组织中发挥作用,其介导产生及释放的多种细胞因子与急性胰腺炎的发生、发展密切相关[11-13],而对于外周血单核细胞计数的变化与急性胰腺炎严重度的关系却甚少关注。在SAP胰外器官损伤中肾损伤往往发生在早期,且多提示预后不良[14-15]。血肌酐作为指南中改良Marshall评分系统用于诊断有无肾衰竭的唯一指标,有研究表明是急性胰腺炎不良结局的一个很好预测指标[16-17]。所以,本研究将中性粒细胞单核细胞绝对计数乘积(NMP)与血肌酐联合,探讨其能否在判断急性胰腺炎严重程度能力上媲美APACHE-Ⅱ,成为一种有效且不失简单的方法。
1 资料和方法 1.1 研究资料回顾性分析2014年5月~2016年5月新疆喀什地区第一人民医院收治的380名急性胰腺炎患者的病历资料。纳入标准:(1)维吾尔族急性胰腺炎患者;(2)发病至入院时间≤3 d;(3)年龄≥18周岁。排除标准:(1)病例资料不全者;(2)复发性胰腺炎;(3)妊娠合并胰腺炎;(4)恶性肿瘤患者;(5)既往肝病患者。急性胰腺炎诊断标准依据《急性胰腺炎诊治指南(2014)》,最终纳入120名。
1.2 研究方法结合2012年亚特兰大急性胰腺炎分类标准[1]和本研究目的,将120名急性胰腺炎患者分为非重症急性胰腺炎组(Non-SAP),即包括轻症急性胰腺炎(MAP)和中重症急性胰腺炎(MSAP)患者,共104人,SAP,共16人。其中,MAP指无器官功能衰竭,且无局部或全身并发症;MSAP指器官功能衰竭在48 h内恢复和/或合并有局部或全身并发症;SAP指伴持续性(>48 h)器官功能衰竭。比较两组一般资料包括:年龄、性别、病因、症状发生至住院时间、入院24 h内NLR、NMP、谷丙转氨酶、谷草转氨酶、血肌酐、APACHE-Ⅱ评分、住ICU及住院死亡情况;分析NMP联合血肌酐分别与住ICU和住院死亡的相关性;比较NLR、APACHE-Ⅱ、NMP联合血肌酐3种方法判断急性胰腺炎严重程度的能力。
1.3 统计学方法采用spss20.0统计软件,所有计量资料均进行正态性检验,符合正态分布者以均数±标准差表示,否则以中位数(四分位间距)表示,计数资料以频数(百分率)表示;计量资料使用t检验,计数资料使用χ2检验;指标联合通过建立Logistic回归模型,以预测概率为新的分析指标;相关性分析采用Spearman秩相关检验;不同方法对急性胰腺炎严重程度判断能力的评价采用ROC曲线分析,并通过Z检验比较曲线下面积。双侧P值 < 0.05为差异有统计学意义。
2 结果 2.1 患者一般资料比较Non-SAP组与SAP组一般资料详见表 1。两组在年龄、性别、主要病因及症状发生至住院时间上差异无统计学意义。维吾尔族急性胰腺炎患者无论Non-SAP还是SAP均以中青年(50岁左右)多见,且以胆源性为最主要病因。两组入院24 h内检测的反映肝脏损伤的酶学指标谷丙转氨酶及谷草转氨酶均高于正常值上限,但组间差异无统计学意义。而入院24 h内NLR、NMP、血肌酐及APACHE-Ⅱ评分两组间差异具有统计学意义(P均小于0.05),随着急性胰腺炎严重程度的增加,上述指标水平随之增高。此外,SAP组较Non-SAP组有更高的住ICU和住院死亡率(P值均小于0.001)。
| 表 1 非重症急性胰腺炎与重症急性胰腺炎患者一般资料比较 Table 1 Comparison of general data between the patients in non-SAP group and SAP group |
入院24 h内NMP与血肌酐通过Logistic回归建立模型为logit(P)=-5.837+0.078(NMP)+0.026(血肌酐),由此获取的预测概率作为两者联合指标参与相关性分析。结果显示NMP联合血肌酐与住ICU、住院期间死亡均呈正相关(r=0.489,P < 0.001;r=0.383,P < 0.001)。
2.3 APACHE-Ⅱ评分、NLR及NMP联合血肌酐判断急性胰腺炎严重程度的能力比较应用ROC曲线比较APACHE-Ⅱ评分、NLR及NMP联合血肌酐对急性胰腺炎严重程度判断的能力(表 2,图 1)。3种方法ROC曲线下面积分别为0.913、0.653、0.884,与参考线下的面积相比差异均有统计学意义(P值均小于0.05)。其中APACHE-Ⅱ评分分值达10.5分时,灵敏度81.3%,特异度95.2%,此时的Youden指数最大;NLR达11.93时。灵敏度75.0%,特异度54.8%,此时的Youden指数最大;NMP与血肌酐的联合指标达0.43时,灵敏度75%,特异度100%,此时的Youden指数最大。APACHE-Ⅱ评分与NLR预测能力ROC曲线下面积比较,Z=3.10,P=0.002,差异有统计学意义;APACHE-Ⅱ评分与NMP联合血肌酐预测能力ROC曲线下面积比较,Z=0.38,P=0.704,差异无统计学意义;NLR与NMP联合血肌酐预测能力ROC曲线下面积比较Z=2.43,P=0.016,差异有统计学意义。
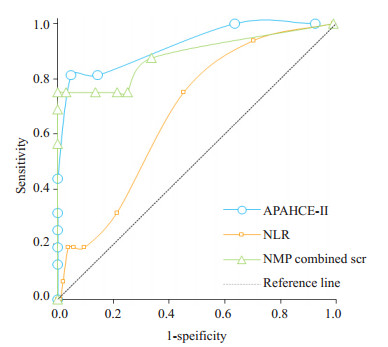
|
图 1 3种方法预测重症急性胰腺炎发生的ROC曲线 Figure 1 ROC curves of three methods for predicting the occurrence of SAP. |
| 表 2 3种方法预测重症急性胰腺炎能力比较 Table 2 Comparison of three methods for predicting the sererity of SAP |
急性胰腺炎是临床常见病,虽然以非重症为主,但一旦发生SAP,多病情凶险、预后不良[18-19]。因此,早期有效判断急性胰腺炎严重程度将具有重要临床意义[20]。其中APACHE-Ⅱ评分量表以其可靠性为多数所认可,将其评分≥8分作为预测SAP发生风险高的一种方法。然而该量表一方面评价内容繁多临床可操作性差,尤其是对于基层医院而言,另一方面≥8分的急性胰腺炎患者并非都发展为SAP,而 < 8分的却存在发展为SAP的情况。所以,不断有研究探索新的判断急性胰腺炎严重程度的指标,以求发现更为有效且简单易行的方法。国内相关研究一般以汉族患者为对象,对于少数民族的急性胰腺炎患者了解较少。在新疆喀什地区,这里聚居着国内最多的维吾尔族人群,占当地总人口的92.16%。本研究从该地区最大一所三甲综合医院喀什地区第一人民医院选取维吾尔族急性胰腺炎患者作为研究对象,探讨判断其急性胰腺炎严重程度的合适方法。
在SAP与Non-SAP两组患者的一般资料对比中,本研究发现不同严重程度的急性胰腺炎均以50岁左右多见,且最主要的病因与汉族人一致,即以胆源性为主。此外,还发现入院24内的NLR随急性胰腺炎严重程度的增加而增大,这一点与汉族急性胰腺炎患者的研究结果也相符[9-10]。急性胰腺炎发生发展离不开大量中性粒细胞的参与,诱发外周血中性粒细胞数目上升,而急性胰腺炎可以导致淋巴细胞凋亡增多,引起外周血淋巴细胞数目减少,故NLR可在一定程度上反映急性胰腺炎的炎症水平,预测急性胰腺炎的严重度。单核细胞作为另一种极其重要的炎症细胞,通过释放多种细胞因子及上调特殊物质的表达积极参与急性胰腺炎的发生发展[11, 21]。本研究发现入院24 h内SAP患者NMP显著高于NonSAP组(P=0.012),前者的中位数超过后者的3倍。
尽管SAP最常合并肺脏[22]和肾脏[23]的损伤,但由于肝脏和胰腺特殊的解剖关系,且我国急性胰腺炎的病因以胆源性为主,所以反映肝功能损害的谷丙转氨酶和谷草转氨酶水平的升高在急性胰腺炎患者中亦十分常见,有研究表明其水平与急性胰腺炎严重程度相关[24]。本研究中Non-SAP组与SAP组患者虽然上述两种酶的水平都高于正常值上限,但组间差异并无统计学意义(P=0.197,P=0.142)。而评估肾脏有无功能障碍的指标血肌酐,在研究的两组中显现出明显差异(P < 0.001),SAP组的血肌酐水平是Non-SAP组的4倍。
单一指标虽然对判断急性胰腺炎严重程度具有一定价值且简便易操作,但由于欠全面,其判断能力多弱于包含多个指标的评价量表[16, 25]。因此,联合指标对构建一个有效的判断急性胰腺炎严重程度的方法十分必要。而为了保证其实用性,还需以最优化为原则精简所要联合的指标。本研究中通过Logistic回归模型将NMP与血肌酐联合起来构建新的指标,在同住ICU和住院死亡的相关性分析中发现,该新的指标与上述两种反映预后的指标都呈正相关(r=0.489,P < 0.001;r=0.383,P < 0.001)。进一步使用ROC曲线比较APACHE-Ⅱ评分、NLR、及NMP联合血肌酐对急性胰腺炎严重程度判断的能力,发现三者ROC曲线下的面积分别为0.913、0.653、0.884,均>0.5(P值均小于0.05)。且三者两两比较示NMP联合血肌酐与APACHE-Ⅱ评分ROC曲线下面积差异无统计学意义(P=0.704),且均大于NLR的(P=0.016,P=0.002)。说明NMP联合血肌酐与APACHE-Ⅱ评分对急性胰腺炎严重程度的判断能力相仿,且明显优于NLR。由于血常规和肾功能检查是绝大数医院都能进行并是临床上检查频率较高的,所以利用NMP联合血肌酐对入院的急性胰腺炎患者进行严重程度的预测,远较使用APACHE-Ⅱ推广性更强。NMP与血肌酐的联合指标在达到0.43时,灵敏度75%,特异度100%,此时的Youden指数最大。由此看出该方法具有很强的排除非重症患者的作用,从而可避免过度治疗,节约更多医疗资源而用于真正需要的患者身上。
综上,NMP联合血肌酐可作为一种有效且不失简单的判断急性胰腺炎严重程度的新方法。本研究也存在一定缺陷,其中最主要就是SAP患者数较少,可能对结果分析产生一定影响,因此有待于大样本的研究进一步证实。
| [1] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-11. DOI: 10.1136/gutjnl-2012-302779. |
| [2] | Tenner S, Baillie J, Dewitt J, et al. American college of gastroenterology guideline: management of acute pancreatitis[J]. Am J Gastroenterol, 2013, 108(9): 1400-15, 1416. DOI: 10.1038/ajg.2013.218. |
| [3] | Yokoe M, Takada T, Mayumi T, et al. Japanese guidelines for the management of acute pancreatitis: Japanese Guidelines 2015[J]. J Hepatobiliary Pancreat Sci, 2015, 22(6): 405-32. DOI: 10.1002/jhbp.v22.6. |
| [4] | Gaisano HY, Gorelick FS. New insights into the mechanisms of pancreatitis[J]. Gastroenterology, 2009, 136(7): 2040-4. DOI: 10.1053/j.gastro.2009.04.023. |
| [5] | Warshaw AL. Improving the treatment of necrotizing pancreatitis-a set up[J]. N EngJ Med, 2010, 362: 1535-7. DOI: 10.1056/NEJMe1001835. |
| [6] | Pezzilli R, Zerbi A, Di Carlo V, et al. Practical guidelines for acute pancreatitis[J]. Pancreatology, 2010, 10(5): 523-35. DOI: 10.1159/000314602. |
| [7] | 编辑委员会, 《中华消化杂志》编辑委员会. 中国急性胰腺炎诊治指南[J]. 临床肝胆病杂志, 2013, 29(9): 656-60. |
| [8] | Suppiah A, Malde D, Arab T, et al. The prognostic value of the neutrophil-lymphocyte ratio (NLR) in acute pancreatitis: identification of an optimal NLR[J]. J Gastrointest Surg, 2013, 17(4): 675-81. DOI: 10.1007/s11605-012-2121-1. |
| [9] | Zhang YS, Yang C, Wang CY, et al. Neutrophil-lymphocyte ratio is superior to total leukocyte in predicting severity, pancreatic necrosis, and organ failure in acute pancreatitis[J]. J Am Coll Surg, 2015, 221(4, 2): E100. |
| [10] | 周天昀, 潘婷婷, 刘嘉琳, 等. 中性粒细胞与淋巴细胞比值在亚特兰大新分类标准下预测急性胰腺炎严重度的价值[J]. 上海交通大学学报, 2016, 36(7): 1023-8. |
| [11] | Yang ZW, Weng CZ, Wang J, et al. The role of Card9 overexpression in peripheral blood mononuclear cells from patients with aseptic acute pancreatitis[J]. J Cell Mol Med, 2016, 20(3): 441-9. DOI: 10.1111/jcmm.2016.20.issue-3. |
| [12] | Badiei A, Chambers ST, Gaddam RR, et al. Cystathionine-gammalyase gene silencing with siRNA in monocytes/macrophages protects mice against acute pancreatitis[J]. Appl Microbiol Biotechnol, 2016, 100(1): 337-46. DOI: 10.1007/s00253-015-6989-z. |
| [13] | Singh P, Garg PK. Pathophysiological mechanisms in acute pancreatitis: Current understanding[J]. Indian J Gastroenterol, 2016, 35(3): 153-66. DOI: 10.1007/s12664-016-0647-y. |
| [14] | Trumbeckaite S, Kuliaviene I, Deduchovas O, et al. Experimental acute pancreatitis induces mitochondrial dysfunction in rat pancreas, kidney and lungs but not in liver[J]. Pancreatology, 2013, 13(3): 216-24. DOI: 10.1016/j.pan.2013.04.003. |
| [15] | Zhou J, Li Y, Tang Y, et al. Effect of acute kidney injury on mortality and hospital stay in patient with severe acute pancreatitis[J]. Nephrology (Carlton), 2015, 20(7): 485-91. DOI: 10.1111/nep.2015.20.issue-7. |
| [16] | Mounzer R, Langmead CJ, Wu BU, et al. Comparison of existing clinical scoring systems to predict persistent organ failure in patients with acute pancreatitis[J]. Gastroenterology, 2012, 142(7): 1476-82. DOI: 10.1053/j.gastro.2012.03.005. |
| [17] | Lipinski M, Rydzewski A, Rydzewska G. Early changes in serum creatinine level and estimated glomerular filtration rate predict pancreatic necrosis and mortality in acute pancreatitis: Creatinine and eGFR in acute pancreatitis[J]. Pancreatology, 2013, 13(3): 207-11. DOI: 10.1016/j.pan.2013.02.002. |
| [18] | Choi JH, Kim MH, Oh D, et al. Clinical relevance of the revised Atlanta classification focusing on severity stratification system[J]. Pancreatology, 2014, 14(5): 324-9. DOI: 10.1016/j.pan.2014.08.001. |
| [19] | Zerem E. Treatment of severe acute pancreatitis and its complications[J]. World J Gastroenterol, 2014, 20(38): 13879-92. DOI: 10.3748/wjg.v20.i38.13879. |
| [20] | Phillip V, Steiner JM, Algül H. Early phase of acute pancreatitis: Assessment and management[J]. World J Gastrointest Pathophysiol, 2014, 5(3): 158-68. |
| [21] | Perides G, Weiss ER, Michael ES, et al. TNF-alpha-dependent regulation of acute pancreatitis severity by Ly-6C(hi) monocytes in mice[J]. J Biol Chem, 2011, 286(15): 13327-35. DOI: 10.1074/jbc.M111.218388. |
| [22] | Wu D, Zeng Y, Fan Y, et al. Reverse-migrated neutrophils regulated by JAM-C are involved in acute pancreatitis-associated lung injury[J]. Sci Rep, 2016, 6: 20545. DOI: 10.1038/srep20545. |
| [23] | Zhang XP, Wang L, Zhou YF. The pathogenic mechanism of severe acute pancreatitis complicated with renal injury: a review of current knowledge[J]. Dig Dis Sci, 2008, 53(2): 297-306. DOI: 10.1007/s10620-007-9866-5. |
| [24] | Wang Y, Liu W, Liu X, et al. Role of liver in modulating the release of inflammatory cytokines involved in lung and multiple organ dysfunction in severe acute pancreatitis[J]. Cell Biochem Biophys, 2015, 71(2): 765-76. DOI: 10.1007/s12013-014-0261-5. |
| [25] | 郝一鸣, 王士祺, 冯全新, 等. 脂肪肝诊断联合急性胰腺炎ACHE-Ⅱ评分提高预测重症急性胰腺炎能力[J]. 中华普通外科杂志, 2016, 31(1): 23-6. |
 2017, Vol. 9
2017, Vol. 9

