大肠侧向发育型肿瘤(LST)最早由Kudo定义为直径≥10 mm,沿肠壁横向生长,很少沿垂直方向生长的一种具有特殊形态学的大肠表浅性肿瘤[1]。近年来,随着内镜诊断技术的发展,对LST的认识也逐渐增加。根据表面有无颗粒聚集,LST按内镜形态学分为颗粒型(LST-G)和非颗粒型(LST-NG),进一步严格细分,颗粒型又分为颗粒均一型(LST-G-H)和结节混合型(LST-G-M),非颗粒型分为扁平隆起型(LST-NG-FE)和假凹陷型(LST-NG-PD)[2]。
目前国内外关于LST的基础研究仍较少,对它特殊生长方式的发生机制仍不明确。有部分研究发现Wnt信号通路中的β-catenin在LST中表达上调,但这些研究多以Wnt信号通路中的β-catenin及其下游信号通路分子c-myc、MMP-7等的表达为主[3-5],对LST中引起β-catenin表达上调的上游信号分子的研究,目前鲜有研究报道。
临床上,LST以结节混合型最为常见,不同内镜分型的LST表现出一定不同的临床病理特征,假凹陷型和结节混合型较其他两种内镜分型往往具有较高的粘膜下浸润恶性潜能,其中假凹陷型的粘膜下浸润癌比例更是高达16.0%[6-7]。近来的研究发现LST的颗粒型和非颗粒型可能具有不同的分子生物发生机制[8-9]。既然LST的四种不同内镜分型表现出一定不同的临床病理特征,四种不同内镜分型的LST的发生机制是否也可能存在一定的差异?目前仍未有关于LST四种不同内镜分型的发生机制是否存在差异的研究。
本研究应用免疫组织化学方法测定Wnt信号通路中的β-catenin、磷酸化GSK-3β及整合素信号通路中的Paxillin、ILK在LST和PA中的表达,首次对LST 4种不同内镜分型的表达是否存在差异进行初步研究,并对LST中可能引起β-catenin表达上调的上游信号通路分子进行探讨。
1 资料和方法 1.1 对象回顾性收集并统计中南大学湘雅二医院胃肠镜室2010年1月1日~2015年6月10日期间确诊的LST病例153例,对于同一患者有两处及以上LST病变的,随机选取其中一处病变,所有LST病例均为行内镜下治疗或外科手术治疗的患者,并行病理组织学诊断。LST四种不同内镜分型由我院消化内科两位高年资主治医师独立完成,对于内镜分型不统一的LST病例,再由两者讨论达成最终意见。利用随机数字生成器工具,随机选取上述153例LST中的52例,其中结节混合型37例,颗粒均一型6例,扁平隆起型5例,假凹陷型4例,获取此52例LST石蜡包块标本。同时随机选取2010年1月1日~ 2015年6月10日期间经中南大学湘雅二医院胃肠镜室做出形态学诊断及病理科做出病理组织学诊断的PA 15例,获取此15例PA患者的石蜡包块标本。
LST和PA病例的排除标准:患者合并炎症性肠病,合并家族性腺瘤性息肉病或家族性结肠癌病史,内镜图片不能明确LST具体内镜分型的病例。
1.2 试剂免疫组化一抗试剂来源:β-catenin兔抗人多克隆抗体(#9587,Cell signaling technology, USA),磷酸化GSK-3β兔抗人多克隆抗体(ab107166, Abcam, USA),Paxillin兔抗人多克隆抗体(ab106955, Abcam, USA),ILK兔抗人多克隆抗体(ab106955, Abcam, US);免疫组化二抗试剂:通用型二步法检测试剂盒PV9000、DAB显色液及免疫组化抗体稀释液,均购于北京中杉金桥生物技术有限公司;PBS缓冲液、柠檬酸钠抗原修复液、3%过氧化氢,均购于武汉博士德生物试剂有限公司,苏木素由我院病理科提供。
1.3 方法 1.3.1 切片对上述67例石蜡包埋标本,连续切片,切片厚度为3 μm。
1.3.2 脱蜡、水化恒温烤箱60 ℃拷片×30 min→二甲苯10 min ×2次→无水乙醇5 min×2次→95%乙醇5 min→80%乙醇5 min→70%乙醇5 min→蒸馏水5 min→PBS洗3 min×3次。
1.3.3 封闭内源性过氧化物酶3%过氧化氢10 min→ PBS洗3 min×3次。
1.3.4 抗原修复暴露抗原决定簇高压锅中加入柠檬酸钠抗原修复液,高压锅煮沸,煮沸后加入组织玻片→高压锅喷气2 min→冷水冷却10 min→PBS洗3 min×3次。
1.3.5 一抗孵育应用免疫组化抗体稀释液稀释配置一抗,加入已稀释的一抗,将组织覆盖完整,放入湿盒中,4 ℃冰箱过夜。
1.3.6 二抗孵育37 ℃下复温45 min,将一抗倒掉并用PBS洗5 min×5次,滤纸擦干,根据通用型二步法检测试剂盒说明,加入试剂1,室温孵育20 min,PBS洗3 min×3次;加入试剂2,室温孵育25 min,PBS洗3 min×3次。
1.3.7 DAB显色加入DAB染色液,显微镜下观察染色情况,控制染色时间为组织标本着色,同时背景染色不可过强,PBS洗3 min×3次,蒸馏水洗5 min。
1.3.8 复染、脱水、透明、封片加一大滴苏木素染色,复燃时间为10~20 s→蒸馏水洗5 min→PBS返蓝5 min;脱水:70%乙醇3 min→ 80%乙醇3 min→95%乙醇3 min→无水乙醇3 min→二甲苯1 min×2次;二甲苯自然风干后,中性树胶封片。
1.3.9 免疫组化结果判定免疫组化染色后以细胞质及胞膜、胞核中染色为标准,按细胞染色强度分为无色、浅黄、棕黄色、棕褐色,分别计分0分、1分、2分、3分;按阳性细胞染色比例分别计分,< 5%计0分,5~25%计1分,26%~50%计2分,51~75%计3分,> 75%计4分;最终按细胞染色强度×阳性细胞染色比例乘积计分,0分(-),1~ 4分(+),5~8分(++),9~12分(+++);随机观察5个高倍镜视野(×400倍),分别统计细胞染色强度和阳性细胞染色比例,取平均值。
1.4 统计学处理采用SPSS 23.0统计学软件(IBM, New York, USA)进行分析。等级资料采用Mann-Whitney U检验及Kruskal-Wallis H检验,相关性分析采用Sperman非参数相关性分析。相关分析中r为相关系数,|r|=0表示完全不相关,0 < |r|≤0.3表示微弱相关,0.3 < |r|≤0.5,表示低度相关,0.5 < |r|≤0.8表示显著相关,0.8 < |r| < 1表示高度相关,|r|=1表示完全相关。所有检验均为双侧检验,P < 0.05表示差异有统计学意义。
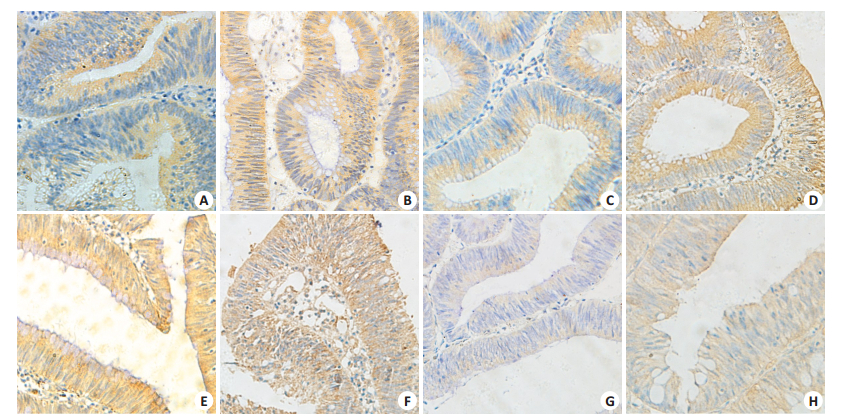
2 结果 2.1 β-catenin、磷酸化GSK-3β、Paxillin、ILK在PA和LST中表达β-catenin、磷酸化GSK-3β、Paxillin、ILK在PA和LST中主要表达在细胞质中,表达分布如表 1。β-catenin在LST中表达较PA中表达升高(图 1A~B× 400倍),且差异具有统计学意义(P < 0.05);磷酸化GSK-3β、Paxillin、ILK在LST中表达较PA中表达均稍升高(图 1C~H×400倍),但差异均无统计学意义(P > 0.05)。
| 表 1 β-catenin、磷酸化GSK-3β、Paxillin、ILK在PA和LST中的表达分布 Table 1 Expression of β-catenin, Phospho-GSK-3β, Paxillin and ILK in PA and LST |
|
图 1 β-catenin、磷酸化GSK-3β、Paxillin、ILK在PA和LST中的免疫组化染色 Figure 1 Immunohistochemical staining of β-catenin, Phospho-GSK-3β, Paxillin and ILK expression in PA and LST. A: Cytoplasmic expression of β-catenin in PA(++); B: Cytoplasmic expression of β-catenin in LST(+++); C: Cytoplasmic expression of Phospho-GSK-3βin PA(++); D: Cytoplasmic expression of Phospho-GSK-3βin LST(+++); E: Cytoplasmic expression of Paxillin in PA(+++); F: Cytoplasmic expression of Paxillin in LST(+++); G: Cytoplasmic expression of ILK in PA(++); H: Cytoplasmic expression of ILK in LST(+++). |
β-catenin、磷酸化GSK-3β、Paxillin、ILK在LST四种不同内镜分型中表达分布如表 2,磷酸化GSK-3β在LST四种不同内镜分型中的表达不完全相同,差异具有统计学意义(P < 0.05),而β-catenin、Paxillin、ILK在LST四种不同内镜分型中的表达差异则均不具有统计学意义(P > 0.05)。
| 表 2 β-catenin、磷酸化GSK-3β、Paxillin、ILK在LST 4种内镜分型中表达分布 Table 2 Expression of β-catenin, Phospho-GSK-3β, Paxillin and ILK in 4 different endoscopic subtypes of LSTs |
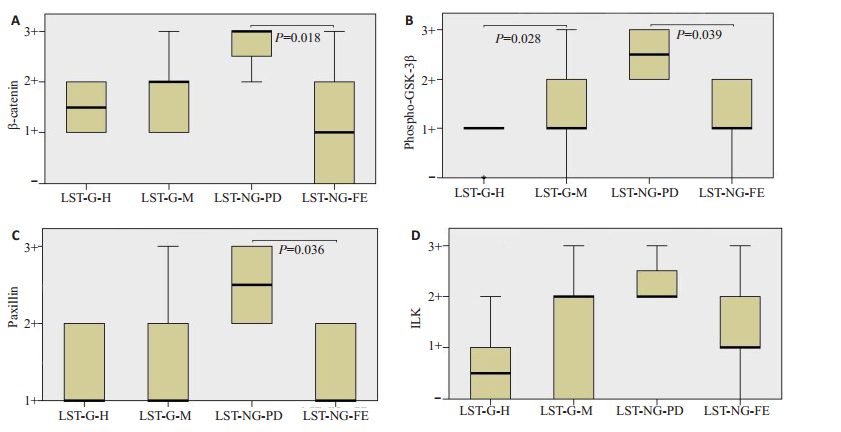
进一步两两比较β-catenin、磷酸化GSK-3β、Paxil lin、ILK在LST-G与LST-NG、LST-G-H与LST-G-M中及LST-NG-PD与LST-NG-FE中的表达差异(图 2),β-catenin、磷酸化GSK-3β、Paxillin在LST-NG-PD中的表达较LST-NG-FE中的表达均升高,且差异均具有统计学意义(P < 0.05)。
|
图 2 β-catenin、磷酸化GSK-3β、Paxillin、ILK在LST不同内镜分型中的两两表达差异 Figure 2 Comparison of β-catenin, Phospho-GSK-3β, Paxillin and ILK expressions in different endoscopic subtypes of LSTs. A: β-catenin expression in different endoscopic subtypes of LSTs; B: Phospho-GSK-3β expression in different endoscopic subtypes of LSTs; C: Paxillin expression in different endoscopic subtypes of LSTs; D: ILK expression in different endoscopic subtypes of LST. |
β-catenin、磷酸化GSK-3β、Paxillin、ILK在LST不同内镜分型中表达与PA中表达差异的P值如表 3,β-catenin、磷酸化GSK-3β、Paxillin、ILK在LST-NG-PD中表达与PA中表达均显著升高,差异均具有统计学意义(P < 0.05)。
| 表 3 β-catenin、磷酸化GSK-3β、Paxillin、ILK在LST不同内镜分型与PA中表达差异的P值 Table 3 P values for comparisons of β-catenin, phospho-GSK-3β, paxillin and ILK expressions between the 4 endoscopic subtypes of LSTs and PAs |
进一步探讨β-catenin、磷酸化GSK-3β、ILK在LST中的表达是否存在相关性,对β-catenin、磷酸化GSK-3β、ILK在LST中的表达进行Sperman非参数相关性分析(表 4,5)。结果显示:β-catenin与磷酸化GSK-3β在LST中的表达存在低度相关(r=0.489,P < 0.001),β-catenin与ILK在LST中的表达存在微弱相关(r=0.258, P < 0.05),ILK与磷酸化GSK-3β在LST中表达存在低度相关(r=0.331, P < 0.05)。
| 表 4 β-catenin与磷酸化GSK-3β、ILK在LST中表达的相关性 Table 4 Correlation of β-catenin expression with Phospho-GSK-3β and ILK expression in LSTs |
| 表 5 ILK与磷酸化GSK-3β在LST中表达的相关性 Table 5 Correlation of ILK expression with Phospho-GSK-3βexpression in LSTs |
对β-catenin、磷酸化GSK-3β、ILK在PA中的表达进行Sperman非参数相关性分析(表 6,7),结果显示:β-catenin、磷酸化GSK-3β、ILK在PA中的表达均不存在相关性。
| 表 6 β-catenin与磷酸化GSK-3β、ILK在PA中表达的相关性 Table 6 Correlation of β-catenin expression with Phospho-GSK-3βand ILK expression in PAs |
| 表 7 ILK与磷酸化GSK-3β在PA中表达的相关性 Table 7 Correlation of ILK expression with Phospho-GSK-3βexpression in PAs |
LST具有特殊的生长方式及表浅的形态学特征,肠镜检查中易漏诊,较临床中常见的突起性腺瘤,基因表达不同,且具有较高的粘膜下浸润比例[10-12],不同内镜分型的LST亦表现一定不同的临床病理特征[12-13]。
β-catenin和磷酸化糖原合成激酶-3β(Phospho GSK-3β)是Wnt信号通路的重要成员,Wnt信号通路的激活在结直肠癌的发生发展中扮演着重要的作用[14-15]。整合素信号通路是细胞粘附分子的重要组成部分,对细胞的形态、运动、存活、增值产生重要调控作用,桩蛋白(Paxillin)和整合素链接激酶(ILK)是整合素信号通路中的重要调节分子[16]。Paxillin作为一种支架蛋白,主要调节细胞的骨架和运动[17],ILK可以磷酸化GSK-3β,促进β-catenin的表达,在大肠突起性腺瘤及结直肠癌的发生发展中均发挥着一定的作用[18]。
目前关于LST的基础研究主要以基因突变、甲基化、Wnt信号通路中分子的表达、细胞凋亡等方面的研究为主,但关于它特殊生长方式的发生机制仍不明确。β-catenin在LST中的表达上调可见于既往的多项研究中[5, 8, 19-21],Wang等[19]发现β-catenin及其下游信号通路分子Cyclin D1、c-myc在LST中表达较PA中表达显著升高,提示Wnt信号通路可能在LST中激活。本研究中β-catenin在LST中表达较PA中表达同样显著升高(P < 0.05),但磷酸化GSK-3β、Paxillin、ILK在LST中表达只是较PA中表达稍升高,差异并无统计学意义(P > 0.05)。Wang等[19]只是将LST看做一个整体与PA相比较,并未将LST具体到不同内镜分型进行研究。在LST的颗粒型和非颗粒型中,β-catenin的表达也存在着差异,Sugimoto等[21]和Nakae等[5]研究均发现β-catenin在LST非颗粒型中表达较颗粒型中表达显著升高。本研究中β-catenin在LST非颗粒型中表达较颗粒型中表达同样升高,但差异并无统计学意义,可能与本课题中LST四种不能内镜分型纳入比例有关。
关于LST的基础研究,从最初将LST看成一个整体进行研究,到近年来逐渐将LST分为颗粒型和非颗粒型两种不同内镜分型进行研究。近来的研究多认为LST中可能存在着至少两种不同途径的分子生物学发生机制,LST的颗粒型和非颗粒型可能具有不同的分子生物学发生机制[5, 8-9, 21-24]。一些研究发现[8-9, 23-25],LST的颗粒型较非颗粒型往往具有更高的Kras基因突变率,LST的非颗粒型则可能与低甲基化更密切相关。
但是,这些研究仅限于将LST简单分为颗粒型和非颗粒型进行研究,并未将LST严格细分到四种内镜分型进行研究。在临床中,LST 4种不同内镜分型亦具有一定不同的临床病理特征。如一项最新的临床研究[26]显示,即便同属于LST的颗粒型,但按照颗粒的直径,将颗粒型LST分为 < 5 mm,5~10 mm,> 10 mm 3种不同类型时,3种不同类型的颗粒型LST的粘膜下浸润率则显著不同。
因此本实验首次研究LST四种不同内镜分型中表达情况,探索LST四种不同内镜分型的发生机制是否存在差异。研究结果显示:虽然磷酸化GSK-3β、ILK、Paxillin在LST总体中的表达与PA中表达相比无显著差异,但是磷酸化GSK-3β、ILK、Paxillin在LST假凹陷型中表达与PA中表达相比均显著升高(P < 0.05)。在LST四种不同内镜分型中,虽然只有磷酸化GSK-3β在四种不同内镜分型中的分布差异具有统计学意义,但β-catenin、磷酸化GSK-3β、Paxillin、ILK均在假凹陷型中表达最高,即便同属于非颗粒型,β-catenin、磷酸化GSK-3β、Paxillin在假凹陷型中的表达较扁平隆起型中的表达均显著升高(P < 0.05)。这些结果提示Wnt及整合素信号通路在LST的假凹陷型中表达最高,LST的假凹陷型可能具有不同于其他内镜分型的特殊发生机制,假凹陷型是否为大肠表浅性肿瘤的另外一种特殊生长方式,仍有待进一步研究。
Wnt信号通路中β-catenin及其下游信号通路分子在LST中的表达上调已见于一些研究中,但目前对LST中β-catenin表达上调原因的研究甚少,有研究认为LST中GSK-3β磷酸化可能是引起β-catenin升高的原因之一[19]。磷酸化GSK-3β(通常在Ser-9位点)是GSK-3β的失活形式,当磷酸化GSK-3β表达增加时,失活的GSK-3β表达增加,对胞质中β-catenin的降解作用减弱,从而引起β-catenin的表达增加[4]。ILK作为β-catenin的上游信号通路调节分子,可以磷酸化GSK-3β,促进β-catenin的表达,当ILK表达增强时,ILK可促进GSK-3β在Ser-9位点的磷酸化,使GSK-3β失活,从而失去对β-catenin的降解作用,使β-catenin表达增加,从而引起下游信号通路的激活[27-28]。本实验首次对LST中可能引起Wnt信号通路中β-catenin表达上调的上游信号通路分子ILK进行探索,研究结果显示β-catenin与磷酸化GSK-3β在LST的表达存在低度相关性(P < 0.05),ILK与磷酸化GSK-3β在LST中表达存在低度相关性(P < 0.05),ILK与β-catenin在LST的中的表达存在微弱相关性(P < 0.05),在PA中β-catenin、磷酸化GSK-3β、ILK三者则不存在相关性。因此提示在LST中,ILK可能通过磷酸化GSK-3β促进β-catenin表达上调,ILK对LST中Wnt信号通路的激活可能发挥一定的作用,但ILK可能仅对LST中β-catenin的上调发挥很小的作用,β-catenin的上调可能还存在别的更主要的调节途径,仍有待进一步研究。本实验尚存在一些不足,如免疫组化实验只是对蛋白表达半定量、定性的测定,仍需要获取LST的新鲜标本,对LST中蛋白的表达进行Western blot等更精确的定量测定;此外,由于临床中LST假凹陷型病例较少,本实验中纳入研究的LST假凹陷型病例同样较少,下一步研究仍有待进一步扩大标本数。
综上所述,LST的假凹陷型,可能具有不同于其他内镜分型的特殊发生机制,临床和基础研究中,将LST更严格细致地进行四种内镜分型,而不是简单地分为颗粒型和非颗粒型,可能具有更好的指导意义。LST中,ILK对Wnt信号通路的表达上调可能发挥一定的作用,对LST特殊生长方式的发生机制仍有待更进一步深入研究。
| [1] | Kudo S. Endoscopic mucosal resection of flat and depressed types of early colorectal cancer[J]. Endoscopy, 1993, 25(7): 455-61. DOI: 10.1055/s-2007-1010367. |
| [2] | Kudo Se, Lambert R, Allen JI, et al. Nonpolypoid neoplastic lesions of the colorectal mucosa[J]. Gastrointest Endosc, 2008, 68(4 Suppl): S3-47. |
| [3] | Hashimoto S, Higaki S, Amano A, et al. Relationship between molecular markers and endoscopic findings in laterally spreading tumors[J]. J Gastroenterol Hepatol, 2007, 22(1): 30-6. DOI: 10.1111/jgh.2007.22.issue-1. |
| [4] | Macdonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009, 17(1): 9-26. DOI: 10.1016/j.devcel.2009.06.016. |
| [5] | Nakae K, Mitomi H, Saito T, et al. MUC5AC/β-catenin expression and KRAS gene alteration in laterally spreading colorectal tumors[J]. World J Gastroenterol, 2012, 18(39): 5551-9. DOI: 10.3748/wjg.v18.i39.5551. |
| [6] | Cong ZJ, Hu LH, Ji JT, et al. A long-term follow-up study on the prognosis of endoscopic submucosal dissection for colorectal laterally spreading tumors[J]. Gastrointest Endosc, 2016, 83(4): 800-7. DOI: 10.1016/j.gie.2015.08.043. |
| [7] | Kim KO, Jang BI, Jang WJ, et al. Laterally spreading tumors of the colorectum: clinicopathologic features and malignant potential by macroscopic morphology[J]. Int J Colorectal Dis, 2013, 28(12): 1661-6. DOI: 10.1007/s00384-013-1741-6. |
| [8] | Sakai E, Ohata K, Chiba H, et al. Methylation epigenotypes and genetic features in colorectal laterally spreading tumors[J]. Int J Cancer, 2014, 135(7): 1586-95. DOI: 10.1002/ijc.28814. |
| [9] | Sugai T, Habano W, Takagi R, et al. Analysis of molecular alterations in laterally spreading tumors of the colorectum[J]. J Gastroenterol, 2017, 52(6): 715-23. DOI: 10.1007/s00535-016-1269-y. |
| [10] | Facciorusso A, Antonino M, Di Maso MA, et al. Non-polypoid colorectal neoplasms: Classification, therapy and follow-up[J]. World J Gastroenterol, 2015, 21(17): 5149-57. DOI: 10.3748/wjg.v21.i17.5149. |
| [11] | Minemura S, Tanaka T, Arai M, et al. Gene expression profiling of laterally spreading tumors[J]. BMC Gastroenterol, 2015, 15: 64. DOI: 10.1186/s12876-015-0295-1. |
| [12] | Yamada M, Saito Y, Sakamoto T, et al. Endoscopic predictors of deep submucosal invasion in colorectal laterally spreading tumors[J]. Endoscopy, 2016, 48(5): 456-64. DOI: 10.1055/s-00000012. |
| [13] | Rotondano G, Bianco MA, Buffoli F, et al. The cooperative Italian FLIN study group: prevalence and clinico-pathological features of colorectal laterally spreading tumors[J]. Endoscopy, 2011, 43(10): 856-61. DOI: 10.1055/s-0030-1256639. |
| [14] | De Sousa E M F, Vermeulen L. Wnt signaling in cancer stem cell biology[J]. Cancers (Basel), 2016, 8(7). |
| [15] | Stamos JL, Weis WI. The beta-Catenin Destruction Complex[J]. Cold Spring Harb Perspect Biol, 2013, 5(1): a007898. DOI: 10.1101/cshperspect.a007898. |
| [16] | Ginsberg MH, Partridge A, Shattil SJ. Integrin regulation[J]. Curr Opin Cell Biol, 2005, 17(5): 509-16. DOI: 10.1016/j.ceb.2005.08.010. |
| [17] | Chen DL, Wang DS, Wu WJ, et al. Overexpression of paxillin induced by miR-137 suppression promotes tumor progression and metastasis in colorectal cancer[J]. Carcinogenesis, 2013, 34(4): 803-11. DOI: 10.1093/carcin/bgs400. |
| [18] | Marotta A, Tan C, Gray V, et al. Dysregulation of integrin-linked kinase (ILK) signaling in colonic polyposis[J]. Oncogene, 2001, 20(43): 6250-7. DOI: 10.1038/sj.onc.1204791. |
| [19] | Wang J, Wang X, Gong W, et al. Increased expression of beta-catenin, phosphorylated glycogen synthase kinase 3beta, cyclin D1, and c-myc in laterally spreading colorectal tumors[J]. J Histochem Cytochem, 2009, 57(4): 363-71. DOI: 10.1369/jhc.2008.953091. |
| [20] | 杨健. Wnt-1及βcatenin在大肠侧向发育型肿瘤组织中的表达及意义[D]. 大连: 大连医科大学, 2010. http://d.wanfangdata.com.cn/Thesis/Y2028974 |
| [21] | Sugimoto T, Ohta M, Ikenoue T, et al. Macroscopic morphologic subtypes of laterally spreading colorectal tumors showing distinct molecular alterations[J]. Int J Cancer, 2010, 127(7): 1562-9. DOI: 10.1002/ijc.25180. |
| [22] | Ichikawa Y, Nagashima Y, Morioka K, et al. Colorectal laterally spreading tumors show characteristic expression of cell polarity factors, including atypical protein kinase C λ/ι, E-cadherin, β-catenin and basement membrane component[J]. Oncol Lett, 2014, 8(3): 977-84. |
| [23] | Mukawa K, Fujii S, Takeda J, et al. Analysis of K-ras mutations and expression of cyclooxygenase-2 and gastrin protein in laterally spreading tumors[J]. J Gastroenterol Hepatol, 2005, 20(10): 1584-90. DOI: 10.1111/jgh.2005.20.issue-10. |
| [24] | Metz AJ, Bourke MJ, Moss A, et al. A correlation of the endoscopic characteristics of colonic laterally spreading tumours with genetic alterations[J]. Eur J Gastroenterol Hepatol, 2013, 25(3): 319-26. DOI: 10.1097/MEG.0b013e32835b57e7. |
| [25] | Hiraoka S, Kato J, Tatsukawa M, et al. Laterally spreading type of colorectal adenoma exhibits a unique methylation phenotype and K-ras mutations[J]. Gastroenterology, 2006, 131(2): 379-89. DOI: 10.1053/j.gastro.2006.04.027. |
| [26] | Shigita K, Oka S, Tanaka S, et al. Clinical significance and validity of the subclassification for colorectal laterally spreading tumor granular type[J]. J Gastroenterol Hepatol, 2016, 31(5): 973-9. DOI: 10.1111/jgh.13238. |
| [27] | Qin J, Ilk WC. A pseudokinase in the center stage of cell-matrix adhesion and signaling[J]. Curr Opin Cell Biol, 2012, 24(5): 607-13. DOI: 10.1016/j.ceb.2012.06.003. |
| [28] | Persad S, Dedhar S. The role of integrin-linked kinase (ILK) in cancer progression[J]. Cancer Metastasis Rev, 2003, 22(4): 375-84. DOI: 10.1023/A:1023777013659. |
 2017, Vol. 37
2017, Vol. 37

