阿尔茨海默病(AD)是一种神经退行性变性疾病,其病理改变主要有Aβ沉积、神经纤维缠结产生和神经元丢失3大特征。在AD患者的Aβ斑块及神经纤维缠结附近的脑组织和转基因AD鼠的脑组织周围存在着异常激活的胶质细胞和炎症细胞因子[1-3],我们前期研究发现IL-33基因的多态性是AD发病的危险因素[4]。这些现象均表明炎症反应与AD的发生发展密切相关,其机制可能与炎症细胞因子加速Aβ的沉积有关[5]。因此,减轻脑细胞的炎症反应可能是延缓AD发生和发展的有效措施。丁苯酞通过保护线粒体、改善微循环两大核心药理作用治疗急性缺血性脑血管病,已取得明显的效果。线粒体保护和微循环改善后也会导致细胞炎症反应减轻,我们前期的系列研究发现丁苯酞可以通过抑制AD模型大鼠脑组织中IL-1的表达和细胞凋亡等途径保护神经血管单元[6-9],但目前尚未见丁苯酞用于治疗AD的临床研究报道,其作用机制也不是十分清楚。本实验拟通过建立Aβ25-35诱导N2a细胞的AD细胞模型,观察丁苯酞对AD细胞存活率、凋亡率、TNF-α和IL-1β等炎性指标表达的影响,进一步探讨炎症反应在AD发生中的作用以及丁苯酞对AD的治疗作用及其潜在的机制,为进一步开发丁苯酞治疗AD提供理论依据。
1 材料和方法 1.1 实验准备、研究对象及实验分组 1.1.1 Aβ25-35的制备将1 mg Aβ25-35的粉末溶解在双蒸水中,37 ℃温箱孵育7 d诱导其变成聚集状态的Aβ 25-35,贮存于-20 ℃冰箱备用。
1.1.2 丁苯酞溶液的配制将丁苯酞原液用DMSO溶解,再用不含血清的细胞培养基稀释至所需的浓度备用(其中DMSO终浓度 < 0.1%)。
1.1.3 MTT的制备在避光条件下用精密天平称取一定量的MTT粉末,用PBS溶液充分溶解,使其终浓度为5 mg/mL,用0.22 µm的滤器将其过滤后避光保存于-20 ℃冰箱中。
1.1.4 细胞培养及AD细胞模型的建立小鼠神经瘤细胞株(N2a)购于Sigma公司。将N2a细胞于完全培养基内(DMEM、10% FBS、1%青霉素/链霉素)在37 ℃、体积分数5% CO2细胞培养箱内进行培养,每2 d更换一次培养基,3~4 d可传1代。取对数生长期的N2a细胞,以每孔2×105/mL接种于96孔板,于37 ℃、5% CO2细胞培养箱培养,待细胞贴壁后,分别加入0、5、10、20、30、40 µmol/L的Aβ25-35,继续放入温箱中孵育24 h后行MTT检测细胞存活率,选择活力降低为正常值的50%~ 60%的Aβ25-35浓度为AD细胞模型。
1.1.5 实验分组实验分为AD组、丁苯酞组、对照组。AD组:细胞培养皿中加入20 µmol/L Aβ25-35;丁苯酞组:分为4个亚组,先加丁苯酞4h后再加入20 µmol/L Aβ25-35,即细胞培养皿中分别为Aβ25-35+0.1 µmol/L丁苯酞、Aβ25-35+1 µmol/L丁苯酞、Aβ25-35+10 µmol/ L丁苯酞、Aβ25-35+100 µmol/L丁苯酞;对照组:细胞培养皿中加入与AD模型组等容积的PBS。
1.2 主要仪器与试剂BCM-1000型超净工作台,二氧化碳细胞培养箱,微量加样器,倒置相差显微镜,全自动酶标仪,BD FACSCalibur流式细胞仪,超低温冰箱,高压蒸汽灭菌器,荧光定量PCR仪等。丁苯酞原液由石家庄恩必普药业有限公司惠赠(纯度 > 99.99%)。Aβ25-35、二甲基亚砜(DMSO)、四甲基噻唑蓝(MTT)均购于Sigma公司,高糖DMEM培养基、胎牛血清均购于Gbico公司,Annexin V-FITC/PI细胞凋亡检测试剂盒,胰酶,PBS,双抗,RNA提取试剂盒,逆转录试剂盒,qRT-PCR试剂盒,TNF-α、IL-1β和GAPDH引物由湖南擎科生物技术有限公司设计合成。TNF-α上游引物:5'-CTCCTCAC CCACACCGTCAG-3',下游引物:5'-CAGAGCAATG ACTCCAAAGTAGACC-3',扩增片段为248 bp;IL-1β上游引物:5'-TTCAGGCAGGCAGTATCACTCATT G-3',下游引物:5'-CAGCACGAGGCTTTTTTGTTGT TCA-3',扩增片段为233 bp;内参GAPDH上游引物:5'-CCTTCCGTGTTCCTACCCCC-3',下游引物:5'-AG CCCAAGATGCCCTTCAGT-3',扩增片段为132 bp。
1.3 方法 1.3.1 MTT法测定活细胞数将按上述药物干预和处理后的细胞放入温箱培养24 h,每孔加入20 µL的MTT,避光培养4 h,弃去培养基,再每孔加入150 µL的DMSO溶液,放在摇床上振荡10 min直至MTT反应的蓝色结晶产物完全溶解,然后用全自动酶标仪检测570 nm波长处各孔的吸光度。独立实验重复3次。
1.3.2 流式细胞仪检测细胞凋亡率按上述分组干预细胞,放入恒温箱中孵育48 h,用不含EDTA的胰酶消化收集细胞,用PBS洗涤细胞2次,收集细胞,加入500 µL的Binding Buffer悬浮细胞,加入5 µL Annexin V-FITC混匀后,再加入5 µL PI混匀,室温避光反应5~15 min,用流式细胞仪检测。
1.3.3 细胞形态学观察将按上述药物干预和处理后的细胞共同孵育48 h后于倒置相差显微镜下观察细胞存活情况及细胞形态。独立实验重复3次。
1.3.4 qRT-PCR测定用于各组细胞TNF-α和IL-1β mRNA表达的检测。将按上述药物干预和处理后的细胞共同孵育48 h,应用Trizol法提取细胞RNA0,按逆转录试剂盒说明进行逆转录获取cDNA,用qRT-PCR方法测定TNF-α和IL-1β mRNA水平。PCR循环条件:98 ℃,2 min(1 cycle);98 ℃,10 s;60 ℃,10 s;68 ℃,30 s(40 cycles)。实时荧光定量PCR仪检测各组细胞中TNF-α和IL-1β mRNA表达水平,记录Ct值,利用2-ΔΔCt的方法分析。独立实验重复3次。
1.3.5 统计学方法采用SPSS 19.0统计软件,计量资料以均数±标准差表示,组间比较采用单因素方差分析,组间多重比较采用LSD检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 AD细胞模型的建立Aβ25-35浓度从10 µmol/L降到20 µmol/L时,细胞存活率下降幅度最明显(P < 0.05,图 1),因此,我们选取经20 µmol/L Aβ25-35处理的N2a细胞为本实验研究的AD细胞模型。
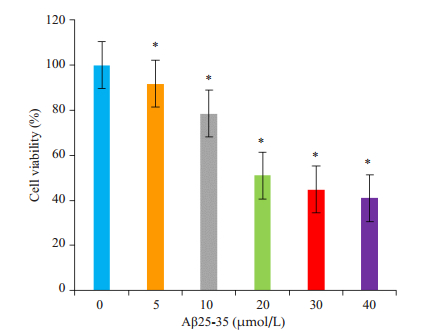
|
图 1 不同浓度的Aβ25-35对N2a细胞存活率的影响比较 Figure 1 Comparison of the effects of different concentrations of Aβ25-35 on N2a cell viability. *P < 0.05 vs 0 µmol/L group. |
与对照组比较,AD组和丁苯酞组的细胞活力均显著下降;与AD组比较,丁苯酞各亚组细胞活力均明显升高(P < 0.05,图 2)。各浓度丁苯酞对细胞存活率没有差别(P > 0.05,图 3)。
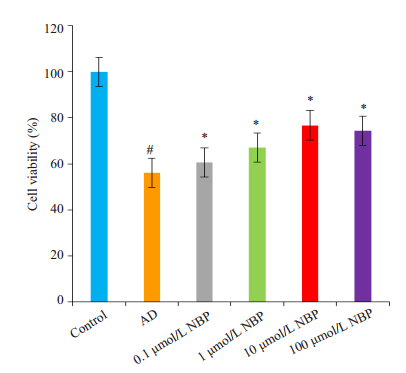
|
图 2 不同浓度的NBP对AD细胞模型细胞存活率影响的比较 Figure 2 Comparison of the effects of different concentrations of butylphthalide on cell viability of AD cell models. #P < 0.05 vs control group; *P < 0.05 vs AD group. |
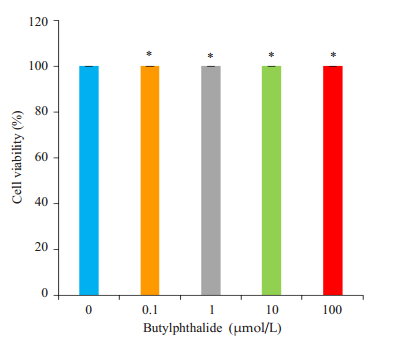
|
图 3 不同浓度的NBP对N2a细胞存活率影响的比较 Figure 3 Comparison of the effects of different concentrations of NBP on N2a cell viability. *P > 0.05 vs 0 µmol/L group. |
与对照组比较,AD模型组细胞凋亡率明显升高(P < 0.05,表 1);与AD组比较,丁苯酞各亚组细胞凋亡率呈降低趋势,其中10 µmol/L和100 µmol/L丁苯酞组的凋亡率明显降低(P < 0.05,图 4)。
| 表 1 各组N2a细胞凋亡率(%)的比较 Table 1 Comparison of apoptosis rate among the groups (Mean±SD, n=3) |
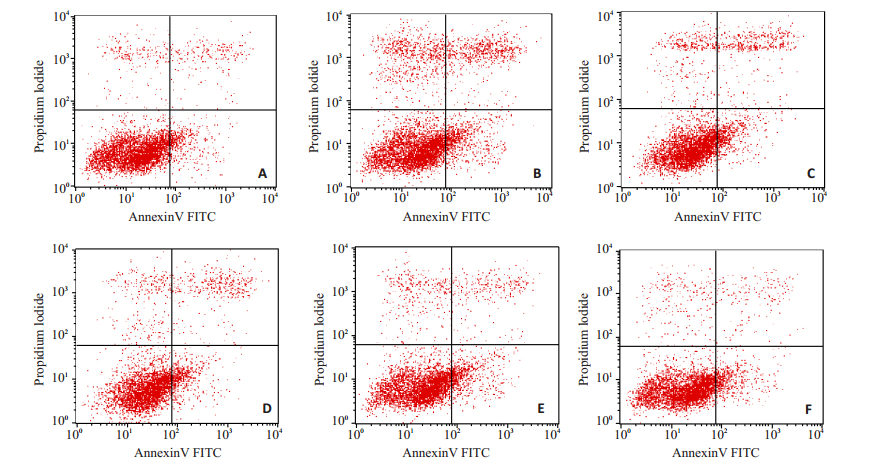
|
图 4 各组N2a细胞凋亡率的比较 Figure 4 Comparison of apoptosis rate among the groups. A: Control group; B: AD group; C: 0.1 µmol/L butylphthalide group; D: 1 µmol/L butylphthalide group; E: 10 µmol/L butylphthalide group; F: 100 µmol/L NBP group. |
倒置显微镜观察各组细胞数量及其形态结构:在40×下,对照组和丁苯酞组细胞数目均较AD组多,细胞分布密度较大(图 5)。在100×下,AD组贴壁细胞数目明显减少;丁苯酞组的细胞突起大致与对照组相似,明显多于AD组,且随着丁苯酞浓度的增加(即10 µmol/L、100 µmol/L),丁苯酞组的细胞形态越接近对照组(图 6)。

|
图 5 不同浓度NBP对AD细胞模型细胞形态学变化 Figure 5 Morphology of AD cell models under inverted microscope after treatment with different concentrations of butylphthalide for 48 h (Original magnification: × 40). A: Control group; B: AD group; C: 0.1 µmol/L butylphthalide group; D: 1 µmol/L butylphthalide group; E: 10 µmol/L butylphthalide group; F: 100 µmol/L butylphthalide group. |

|
图 6 同浓度丁苯酞对AD细胞模型细胞形态学变化 Figure 6 Morphology of AD cell models under inverted microscope after treatment with different concentrations of NBP for 48 h (× 100). A: Control group; B: AD group; C: 0.1 µmol/L butylphthalide group; D: 1 µmol/L butylphthalide group; E: 10 µmol/L butylphthalide group; F: 100 µmol/L butylphthalide group. |
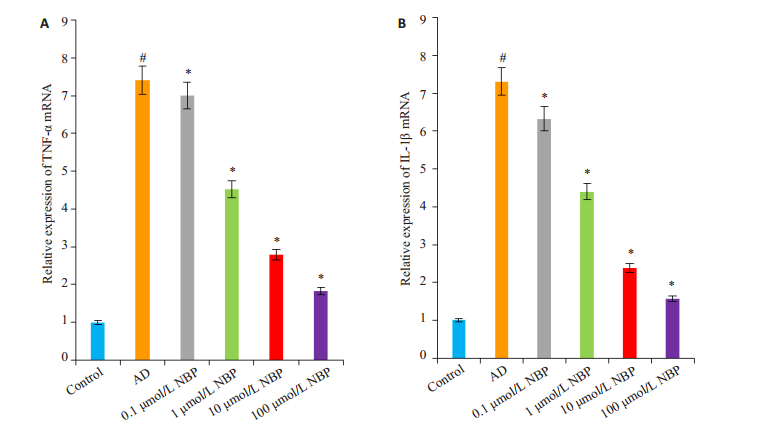
采用qRT-PCR方法检测各组细胞TNF-α和IL-1β mRNA相对表达量。与对照组比较,AD组细胞的TNF-α和IL-1β mRNA表达均明显升高(P < 0.05);与AD组比较,丁苯酞各亚组细胞的TNF-α和IL-1β mRNA的表达明显下降(P < 0.05,图 7)。
|
图 7 各组N2a细胞TNF-α和IL-1β mRNA相对表达量的变化 Figure 7 Changes of relative expression of TNF-α and IL-1β mRNA in different group (n=3). A: TNF-α mRNA expression detected by qRT-PCR; B: IL-1β mRNA expression detected by qRT-PCR. #P < 0.05 vs control group; *P < 0.05 vs AD group. |
丁苯酞是我国自行研发的具有知识产权的一类新药,最初研究证实丁苯酞具有改善脑部微循环、保护线粒体等基本药理作用。近来研究表明丁苯酞还具有神经保护[10]、减少Aβ沉积[11-12]、改善认知功能[13]、促进神经生长因子表达[14]和抗炎[15-16]等作用;研究表明丁苯酞可以通过抑制NF-κB信号途径减轻胶质细胞激活和神经炎症[15],而NF-κB是多种炎性因子的上游因子(如TNF-α、IL-1β),因此,丁苯酞可能通过抑制活化的炎性因子对神经细胞起保护作用。本实验发现:与AD组比较,丁苯酞各亚组细胞存活率明显增加(P < 0.05),细胞凋亡率明显降低(P < 0.05),丁苯酞各亚组贴壁细胞数目增多,细胞间的突起联系较多,10 µmol/L和100 µmol/L丁苯酞组的细胞形态接近对照组。虽然100 µmol/L丁苯酞组较10 µmol/L丁苯酞组的细胞存活率略微下降,而细胞凋亡率是随丁苯酞浓度增加而下降,但因细胞存活率和细胞凋亡率两者检测方法、检测目标均不一样,导致两者反应保护细胞作用的不一致,可能系实验误差、丁苯酞的量效关系所致,有待于进一步研究。以上说明:丁苯酞能拮抗Aβ25-35所致的AD细胞的毒性作用、对神经细胞具有保护作用。
Aβ异常沉积激活胶质细胞引起一系列神经炎症反应被认为是AD发病的重要环节[17-20]。TNF-α是炎症反应的关键调节因子之一,在转基因AD大鼠中,长期高表达TNF-α促进神经元炎症反应,最终导致神经元的死亡[21];TNF阻断剂可以降低Aβ的沉积[22-23]。因此,TNF-α可能是慢性炎症介导AD的调节因子,对维持突触完整性和神经元活力起重要的调控作用。IL-1β是一种重要的促炎因子,以往的研究发现:老化的Tg2576小鼠海马中过度表达IL-1β会导致空间记忆障碍[24],IL-1β表达增加可能通过增加血脑屏障的渗透性、破坏血脑屏障的完整性和促进炎性因子的产生等机制参与AD的发生发展[25]。在本实验中,AD组TNF-α和IL-1β mRNA的相对表达量较正常对照组相比明显增加,证实了AD的发生与这些炎性因子表达增加密切相关。丁苯酞各亚组均能降低TNF-α和IL-1β mRNA的表达,并且随着丁苯酞浓度的增加,炎性因子表达呈逐渐下降的趋势。进一步证实了丁苯酞能减少炎症因子的产生,通过减少细胞氧化应激作用从而减轻细胞损伤,从而对神经细胞起到保护作用。
综上所述,丁苯酞可以减轻Aβ25-35诱导的N2a细胞损伤,其机制可能与下调TNF-α和IL-1β的表达、减轻Aβ导致的炎症反应等因素有关。鉴于丁苯酞的多靶点药理作用和我们的以往的系列基础研究,丁苯酞的临床应用不应该仅局限于最初研发的急性缺血性脑血管病的治疗,我们认为:丁苯酞的临床应用至少可以包括AD和帕金森等在内的、发病机制与线粒体损害和微循环障碍、炎性细胞反应导致细胞损害加重的相关疾病的治疗,这将为进一步开发治疗AD的新药物提供思路。
| [1] | Bonifati DM, Kishore U. Role of complement in neurodegeneration and neuroinflammation[J]. Mol Immunol, 2007, 44(5): 999-1010. DOI: 10.1016/j.molimm.2006.03.007. |
| [2] | Johnston H, Boutin H, Allan SM. Assessing the contribution of inflammation in models of Alzheimer's disease[J]. Biochem Soc Trans, 2011, 39(4): 886-90. DOI: 10.1042/BST0390886. |
| [3] | Takeda S, Sato N, Ikimura K, et al. Increased blood-brain barrier vulnerability to systemic inflammation in an Alzheimer disease mouse model[J]. Neurobiol Aging, 2013, 34(8): 2064-70. DOI: 10.1016/j.neurobiolaging.2013.02.010. |
| [4] | Tian M, Deng YY, Hou DR, et al. Yu ZL. Association of IL-1, IL-18, and IL-33 gene polymorphisms with late-onset Alzheimer's disease in a Hunan Han Chinese population[J]. Brain Res, 2015, 1596: 136-45. DOI: 10.1016/j.brainres.2014.11.019. |
| [5] | Philippens IH, Ormel PR, Baarends GA, et al. Acceleration of amyloidosis by inflammation in the Amyloid-Beta marmoset monkey model of alzheimer's disease[J]. J Alzheimers Dis, 2017, 55(1): 101-13. |
| [6] | 侯德仁, 万顺, 周军, 等. 丁苯酞对Alzheimer病模型大鼠海马S100和胶质纤维酸性蛋白影响的研究[J]. 南方医科大学学报, 2009, 29(6): 1147-9. |
| [7] | 侯德仁, 田怡, 周军, 等. 丁苯酞对阿尔茨海默病模型大鼠P38及ERK表达的影响及意义[J]. 南方医科大学学报, 2009, 29(8): 1592-5. |
| [8] | 侯德仁, 薛俐, 唐交春, 等. 阿尔茨海默病模型大鼠PDI及P53的表达及丁苯酞对其影响的研究[J]. 南方医科大学学报, 2010, 30(9): 2104-7. |
| [9] | 侯德仁, 唐交春, 严文广, 等. 丁苯酞对阿尔茨海默病病模型大鼠NeuN, IL-1的影响[J]. 医学研究杂志, 2011, 40(3): 67-70. |
| [10] | Lei H, Zhao CY, Liu DM, et al. L-3-n-Butylphthalide attenuates beta-amyloid-induced toxicity in neuroblastoma SH-SY5Y cells through regulating mitochondrion-mediated apoptosis and MAPK signaling[J]. J Asian Nat Prod Res, 2014, 16(8): 854-64. DOI: 10.1080/10286020.2014.939586. |
| [11] | Peng Y, Sun J, Hon S, et al. L-3-n-Butylphthalide improves cognitive impairment and reduces amyloid-beta in a transgenic model of alzheimer's disease[J]. J Neurosci, 2010, 30(24): 8180-9. DOI: 10.1523/JNEUROSCI.0340-10.2010. |
| [12] | Zhang Y, Huang LJ, Shi S, et al. L-3-n-butylphthalide rescues hippocampal synaptic failure and attenuates neuropathology in aged APP/PS1 mouse model of alzheimer's disease[J]. CNS Neurosci Ther, 2016, 22(12): 979-87. DOI: 10.1111/cns.2016.22.issue-12. |
| [13] | Xu J, Huai Y, Meng N, et al. L-3-n-butylphthalide activates Akt/ mTOR signaling, inhibits neuronal apoptosis and autophagy and improves cognitive impairment in mice with repeated cerebral ischemia-reperfusion injury[J]. Neurochem Res, 2017, [Epub ahead of time]. http://europepmc.org/abstract/MED/28620824 |
| [14] | Xiang J, Pan J, Chen FJ, et al. L-3-n-butylphthalide improves cognitive impairment of APP/PS1 mice by BDNF/TrkB/PI3K/AKT pathway[J]. Int J Clin Exp Med, 2014, 7(7): 1706-13. |
| [15] | Wang HM, Zhang T, Huang JK, et al. 3-N-butylphthalide (NBP) attenuates the amyloid-β-induced inflammatory responses in cultured astrocytes via the nuclear factor-κB signaling pathway[J]. Cell Physiol Biochem, 2013, 32(1): 235-42. DOI: 10.1159/000350139. |
| [16] | He Z, Zhou Y, Lin L, et al. Dl-3-n-butylphthalide attenuates acute inflammatory activation in rats with spinal cord injury by inhibiting microglial TLR4/NF-κB signaling[J]. J Cell Mol Med, 2017, [Epub ahead of time]. |
| [17] | Terrill-Usery SE, Mohan MJ, Nichols MR. Amyloid-β(1-42) protofibrils stimulate a quantum of secreted IL-1β despite significant intracellular IL-1β accumulation in microglia[J]. Biochim Biophys Acta, 2014, 1842(11): 2276-85. DOI: 10.1016/j.bbadis.2014.08.001. |
| [18] | Bhaskar K, Maphis N, Xu GX, et al. Microglial derived tumor necrosis factor-alpha drives Alzheimer's disease-related neuronal cell cycle events[J]. Neurobiol Dis, 2014, 62: 273-85. DOI: 10.1016/j.nbd.2013.10.007. |
| [19] | Malm TM, Jay TR, Landreth GE. The evolving biology of microglia in Alzheimer's disease[J]. Neurotherapeutics, 2015, 12(1): 81-93. DOI: 10.1007/s13311-014-0316-8. |
| [20] | Minter MR, Taylor JM, Crack PJ. The contribution of neuro inflammation to amyloid toxicity in Alzheimer's disease[J]. J Neurochem, 2016, 136(3): 457-74. DOI: 10.1111/jnc.2016.136.issue-3. |
| [21] | Janelsins MC, Mastrangelo M, Park KM, et al. Chronic neuron specific tumor necrosis factor-alpha expression enhances the local inflammation environment ultimately leading to neuronal death in 3xTg-AD mice[J]. Am J Pathol, 2008, 173(6): 1768-82. DOI: 10.2353/ajpath.2008.080528. |
| [22] | Macpherson KP, Sompol P, Kannarkat GT, et al. Peripheral administration of the soluble TNF inhibitor XPro1595 modifies brain immune cell profiles, decreases beta-amyloid plaque load, and rescues impaired long-term potentiation in 5xFAD mice[J]. Neurobiol Dis, 2017, 102: 81-95. DOI: 10.1016/j.nbd.2017.02.010. |
| [23] | Shammim D, Laskowski M. Inhibition of inflammation mediated through the tumor necrosis factor α biochemical pathway can lead to favorable outcomes in Alzheimer disease[J]. J Chen Nerv Syst Dis, 2017, 9: 1179573517722512. |
| [24] | Menachem-Zidon MO, Menahem YB, Hur TB, et al. Intra hippocampal transplantation of neural precursor cells with transgenic over-expression of IL-1 receptor antagonist rescues memory and neurogenesis impairments in an Alzheimer's disease model[J]. Neuropsychopharmacology, 2014, 39(2): 401-14. DOI: 10.1038/npp.2013.208. |
| [25] | Wang YE, Jin SJ, Sonobe Y, et al. Interleukin-1 beta induces blood-brain barrier disruption by downregulating sonic hedgehog in astrocytes[J]. PLoS One, 2014, 9(10): e110024. DOI: 10.1371/journal.pone.0110024. |
 2017, Vol. 37
2017, Vol. 37

