2. 深圳市龙岗中心医院神经外科//影像科,广东 深圳 518116
2. Department of Radiology, Department of Neurosurgery, Shenzhen Longgang Central Hospital, Shenzhen 518116, China
脑动脉瘤(IAs)是由于局部血管异常改变产生的脑血管瘤样突起,其破裂后致死致残率极高[1-2]。动脉瘤夹闭术仍是颅内动脉瘤常用治疗方法之一,但手术的疗效与动脉瘤夹放置的位置密切相关,如术中夹闭过多,可造成临近血管的狭窄或闭塞;若动脉瘤夹闭不全,动脉瘤复发率高[3-6]。因此,如何将动脉瘤夹的位置放到恰到好处仍然是一个值得探讨的问题。王知非等[7]以3D-CTA模拟入路指导早期手术治疗破裂动脉瘤,结果显示其对指导手术有重要作用,但这种方法只能根据影像学二维平面图像所提供的信息来指导手术,缺乏动脉瘤及毗邻重要结构关系的空间立体信息,更无法在术前进行有针对性的模拟手术训练,因此,如果能在术前对动脉瘤及毗邻重要结构关系的空间立体信息了解比较清楚,并且有目的地进行模拟手术操作,则可能对进一步提高手术质量有较大帮助。本研究以深圳市龙岗中心医院神经外科2012年10月~2016年12月入选的60例行开颅动脉瘤夹闭术患者为研究对象,通过术前对干预组患者颅内动脉瘤进行三维CT血管造影(3D-CTA)检查,并用其所得数据结合3D打印技术[8],将动脉瘤及毗邻重要结构等比例打印出来,使外科医生能在术前通过该全仿真模型对手术进行干预设计及模拟手术训练,从而探讨其在确定手术入路、动脉瘤夹的选择、放置的位置及角度、术中注意事项等的指导价值,结果发现较对照组取得了更好的疗效,现报道如下。
1 资料和方法 1.1 病例入选标准和排除标准入选标准:(1)年龄14~75岁;(2)术前Hunt-Hess分级Ⅰ~Ⅳ级;(3)格拉斯哥昏迷评分(GCS)≥5分;(4)血压≥90/60 mmHg;(5)无明显手术禁忌症。排除标准:(1)年龄偏小( < 14岁)或偏大( > 75岁);(2)术前HuntHess分级Ⅴ级;(3)病情危重,生命体征不稳;(4)伴重要脏器严重疾病;(5)凝血功能障碍。
1.2 病例分组将我科2012年10月~2016年12月入选的60例行开颅动脉瘤夹闭术患者随机分为2组,对照组(n=30),干预组(n=30)。该研究已经深圳市龙岗中心医院伦理委员会同意,并取得所有患者或家属签署的知情同意书。
1.3 主要仪器Leica F40手术显微镜(美国),Siemens Artis FA DSA机(德国),Toshiba Aquilion ONE320排/640层CT机(日本),Vitrea Fx工作站,NIKON摄像机(日本),Utimaker 3D打印机(荷兰)。
1.4 实施方案 1.4.1 两组患者的共同干预措施(1)所有入组患者术前均进行头颅CT平扫、3D-CTA检查,明确诊断颅内动脉瘤;(2)动脉瘤3D-CTA检查方法:应用高压注射器经肘静脉注入非离子型对比剂安射力(碘氟醇,tyco Healthcare,加拿大,质量浓度为350 mg/mL,对比剂用量1.5 mL/kg),注射速度4.5~5 mL/s。扫描范围从颅底到颅顶(16 cm),采用动态容积模式扫描,管电压100 kV,电流225 mA,数据采集320排,层厚0.5 mm。注射后7~55 s连续采集图像。原始数据经减影后导入Vitrea Fx工作站,应用多层面重建、容积再现、最大密度投影及曲面重建等技术进行后处理。获得脑动脉瘤、载瘤脑动脉及颅底骨骼的三维图像。动态观察并分析图像,然后选择各个角度的图像包括手术相关的观察角度图像存储;(3)所有入组患者均进行开颅动脉瘤夹闭术,术中观察3D-CTA所示动脉瘤特征(包括:动脉瘤的位置、大小、形态、瘤顶指向、瘤颈宽窄、载瘤动脉、动脉瘤与周围血管及骨结构关系)与手术所见的吻合度;(4)术后予相应常规等治疗;(5)对术后患者在术后第1、3天行CT检查,了解患者颅内情况;同时完成1次CTA检查,了解动脉瘤夹闭情况;(6)在术后3~6个月对患者行数字减影血管造影(DSA)检查,了解动脉瘤情况;(7)对术后患者进行3个月到半年的随访,了解患者术后恢复情况。
1.4.2 干预组患者的干预措施(1)将入组患者3D-CTA扫描获得的数据结合3D打印技术,将动脉瘤和毗邻重要结构打印出来,制造出该动脉瘤的全仿真模型;(2)术前通过该模型对手术进行干预设计,制定手术方案;并通过该模型进行术前“模拟手术训练”。
1.5 观察指标 1.5.1 术后影像学检查结果对术后患者在术后第1、3天行CT检查,了解患者是否存在与手术相关的脑梗塞或出血。同时完成1次CTA检查,了解患者是否存在载瘤动脉狭窄或闭塞,是否误夹重要的穿支动脉及毗邻血管,是否存在动脉瘤颈残留,以上如出现一种或多种情况即认为手术完成效果不良。
1.5.2 术后3个月到半年DSA检查结果在术后3个月到半年对患者行DSA检查,了解患者是否存在载瘤动脉狭窄或闭塞,是否误夹重要的穿支动脉及毗邻血管,是否存在动脉瘤颈残留,如出现一种或多种情况即认为手术完成效果不良。
1.5.3 格拉斯哥预后评分(GOS)对术后患者进行3个月到半年的随访,使用GOS了解患者术后恢复情况,GOS4-5被认为恢复良好,GOS1-3被认为恢复差。
1.6 临床资料 1.6.1 一般资料本研究所有入组患者均为破裂动脉瘤,临床表现均为急性起病,有头痛、呕吐等症状,部分出现不同程度意识及肢体活动障碍。所有患者入院后立即行头颅CT平扫,均表现为蛛网膜下腔出血,CTA检查均发现颅内动脉瘤。对照组:患者30例,男18例,女12例,年龄23~69岁,42.5±2.6岁。责任动脉瘤的部位:后交通动脉瘤12例,大脑前动脉瘤3例,前交通动脉瘤6例,大脑中动脉动脉瘤9例。入院时Hunt-Hess分级:Ⅰ级5例,Ⅱ级15例,Ⅲ级8例,Ⅳ级2例。干预组:患者30例,男16例,女14例,年龄21~67岁,(43.5± 2.3)岁。责任动脉瘤的部位:后交通动脉瘤11例,大脑前动脉瘤5例,前交通动脉瘤7例,大脑中动脉动脉瘤7例。入院时Hunt-Hess分级:Ⅰ级6例,Ⅱ级14例,Ⅲ级9例,Ⅳ级1例。
1.6.2 手术治疗两组患者均采用静脉插管全麻,均在动脉瘤出血后2 d内接受显微手术夹闭术。两组患者均采用翼点或改良翼点入路。现以翼点入路为例说明手术经过,在显微镜下充分解剖侧裂,显露动脉瘤,分离动脉瘤颈后,对于对照组,在术中临时根据动脉瘤具体情况选择合适的动脉瘤夹夹闭动脉瘤。对于干预组,按术前制定手术方案进行。
1.7 统计学分析使用SPSS 20.0统计软件,对于计量资料用均数±标准差表示,两组间的分布差异使用t检验进行检验;对于计数资料,两组间分布的差异使用χ2分析进行检验,本研究结果以P < 0.05提示有统计学意义。
2 结果 2.1 2组患者的临床特征比较两组患者的性别、年龄、入院时Hunt-Hess分级等两组间比较均无统计学差异(P > 0.05,表 1),具有可比性。
| 表 1 患者临床资料特征 Table 1 Clinical data of the patients |
所有术前3D-CTA显示的动脉瘤特征与术中所见基本一致。对干预组患者,术中依据术前该模型所提供信息及进行的模拟手术训练均顺利地探查到动脉瘤并夹闭。该模型提示有6例动脉瘤向内下生长,术前发现周围有重要穿动脉,已引起重视,术中无法直视,用神经内镜辅助,成功夹闭动脉瘤,保留穿动脉。
2.3 术后影像学检查结果对照组:CT或MRI检查发现手术相关脑梗塞4例。CTA发现瘤颈残留3例,载瘤动脉狭窄2例。干预组:无手术相关脑梗塞。CTA发现瘤颈残留1例,载瘤动脉狭窄1例。结果显示干预组近期手术相关不良事件发生率明显低于对照组,差异有统计学意义(P < 0.05,表 2)。
| 表 2 2组患者近期手术相关不良事件发生率比较 Table 2 Comparing the recent incidence of adverse operation events in the 2 groups (%) |
对照组:失访3例,死亡1例。瘤颈残留4例,载瘤动脉狭窄3例,误夹重要的穿支动脉及毗邻血管4例。干预组:失访3例,无死亡病例。瘤颈残留2例,载瘤动脉狭窄2例,无误夹重要的穿支动脉及毗邻血管。结果显示干预组远期手术相关不良事件发生率明显低于对照组,差异有统计学意义(P < 0.05,表 3)。
| 表 3 2组患者远期手术相关不良事件发生率比较 Table 3 Comparing the Long-term incidence of adverse operation events in the 2 groups (%) |
2组患者均失访3例,对照组死亡1例。对照组:GOS4-5分18例,GOS1-3分8例。干预组:GOS4-5分25例,GOS1-3分2例。结果显示干预组明显优于对照组,差异有统计学意义(P < 0.05,表 4)。
| 表 4 2组患者临床预后良好率比较 Table 4 Distribution of good neurologic function probability in the 2 groups (%) |
患者赵某,女性,64岁,因“突发头痛2 d”入院,术前CTA显示右侧后交通动脉瘤,动脉瘤顶指向下,与前床突相邻(图 1)。
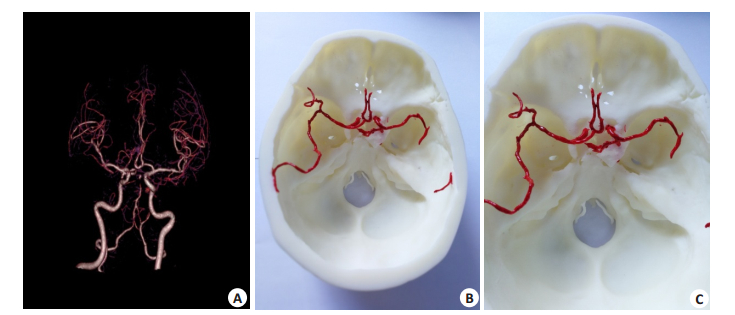
|
图 1 患者脑CTA和脑动脉瘤全仿真模型 Figure 1 Brain CTA and simulation model of intracranial aneurysm. A: Brain CTA, the arrow points to the right posterior communicating aneurysm, and direction is downward; B and C: The simulation model of intracranial aneurysm, printed with a ratio of 1 to 1, the arrow points to the right posterior communicating aneurysm. |
目前脑动脉瘤的治疗方式主要分为血管内介入及开颅显微手术夹闭,手术夹闭主要是治疗复杂动脉瘤(如巨大、不规则动脉瘤等)。长期以来DSA都被视为诊断和评估颅内动脉瘤的金标准,但其存在有创、耗时、昂贵等缺点,随着CT机的进步,CTA检查迅速、低辐射剂量、便宜、无创,而且图像清晰、准确、直观,对急重患者尤为适用[9]。在对CTA与DSA在动脉瘤诊断价值中的研究发现两者在敏感性、特异性、准确性已无明显差别[10-12]。本研究所有术前3D-CTA显示的动脉瘤特征与术中所见基本一致。术中依据该模型所提供信息及进行的模拟手术训练均顺利地探查到动脉瘤并夹闭,结果表明该模型对提高手术质量有较好的指导作用。
3.1 指导细小穿动脉的保护本研究发现干预组无手术相关脑梗塞,即无误夹穿动脉及邻近血管,与对照组相比有统计学差异,说明该模型及借助于其的术前准备及模拟训练对指导细小穿动脉的保护有较强的作用。在对大和巨大动脉瘤行夹闭术治疗的研究中,发现有较多与手术相关的缺血事件发生,究其原因是发现有些动脉瘤颈后方常发出重要穿动脉,受瘤体、瘤颈和载瘤动脉的遮挡,这些穿动脉不能直视(特别是瘤顶指向后内方的)[13-14]。Yasuhiro等[15]和Cho等[16]在研究神经内镜在动脉瘤夹闭术用的作用时也发现了这一点,如果术前对此了解不清楚,分开瘤颈后即上夹夹闭,则必将这些重要穿动脉一起夹闭,造成相应区域的手术相关脑梗塞,引起相应神经功能缺失而影响预后。因此,本研究对干预组患者术前通过该模型的研究已发现部分患者周围有重要穿动脉,已引起重视,并做好手术方案,通过神经内镜辅助(增加局部照明、放大图像),将动脉瘤夹闭,保留穿动脉,避免手术相关脑梗塞。
3.2 指导手术入路的选择本研究对照组在术中发生动脉瘤破裂4例,干预组无破裂。在通过翼点入路夹闭前交通动脉瘤的研究中发现前交通动脉复合体存在较多变异,由于术前对此掌握不清,对手术效果造成了一定的影响[17-19]。本研究通过对术前该模型的分析提示,较多前交通动脉瘤患者存在前交通动脉复合体变异,且以一侧A1段发育不良或缺如为主。另外,术前该模型还清晰地显示了动脉瘤瘤顶的指向。术中我们均选择了优势A1供血侧翼点入路,这样有利于术中必要时行载瘤动脉的临时阻断;对于双侧A1段对称者,选择瘤顶指向的对侧翼点入路,从而避免探查动脉瘤时首先接触到动脉瘤瘤顶而增加动脉瘤术中破裂出血的危险。由此可见,该模型对手术入路的选择也有较好的指导作用。
3.3 指导动脉瘤夹的选择、放置,提高夹闭质量。本研究发现干预组在夹闭质量(有无动脉瘤颈残留、载瘤动脉狭窄)及疗效(GOS评分)明显优于对照组,具有统计学差异(P < 0.05)。为提高动脉瘤夹闭术质量,尝试术中向血管内注入绿荧光[20-21],术中使用三维旋转荧光成像[22]。Li等[23]术中使用体感诱发电位结合吲哚菁绿、微血管多普勒,Hideyuki等[24]使用黄荧光和吲哚菁绿通过不同给药途径在显微镜下进行可视血管造影来判断载瘤动脉是否狭窄或闭塞,Nam等[25]通过术前对动脉瘤进行三维曲面重建指导手术等手段来提高动脉瘤的手术质量,取得了一定的效果,但仍不是十分理想,主要问题是术者对动脉瘤的信息掌握欠全面。本研究术前通过对该模型的分析及模拟训练,可以预先选择大小合适的瘤夹,上夹的位置、角度,避免术中临时反复选择及调整,引发危险。有些动脉瘤颈相当脆弱,如壁薄,有钙化等,在上夹过程中最好一次成功,反复调整则很容易撕裂,引发灾难性后果。本研究对照组有2例患者在术中瘤颈撕裂,1例改行孤立术,术后重残,1例造成载瘤动脉狭窄。干预组未出现此情况。另外,干预组在动脉瘤颈残留、载瘤动脉狭窄等方面明显少于对照组是由于手术上夹的位置、角度恰到好处,夹闭质量较高所致。
总之,该模型可清晰地显示动脉瘤与周围血管及骨性结构的三维关系,术前通过其对手术进行干预设计,制定手术方案;并通过该模型进行术前“模拟手术训练”,有助于避免损伤重要的组织结构而引起各种术后并发症,提高手术质量,改善患者的预后,是一种有效的手段。
| [1] | Shimada K, Furukawa H, Wada K, et al. Protective role of peroxisome Proliferator-Activated receptor-γ in the development of intracranial aneurysm rupture[J]. Stroke, 2015, 46(6): 1664-72. DOI: 10.1161/STROKEAHA.114.007722. |
| [2] | Stanlies D. Aneurysmal subarachnoid hemorrhage[J]. J Neurosurg Anesthesiol, 2015, 27(3): 222-40. DOI: 10.1097/ANA.0000000000000130. |
| [3] | Della Puppa A, Volpin F, Gioffre GA, et al. Microsurgical clipping of intracranial aneurysms assisted by green indocyanine videoangiography (ICGV) and ultrasonic perivascular microflow probe measurement[J]. Clin Neurol Neurosurg, 2014, 116(1): 35-40. |
| [4] | Mohr JP, Michael KP, Christian SM, et al. Management with or without interventional therapy for unruptured brain arteriovenous malformations (Aruba): a multicentre, non-blinded, randomised trial[J]. Lancet, 2014, 383(9917): 614-21. DOI: 10.1016/S0140-6736(13)62302-8. |
| [5] | Li J, Lan ZG, Liu Y, et al. Large and giant ventral paraclinoid carotid aneurysms: Surgical techniques, complications and outcomes[J]. Clin Neurol Neurosurg, 2012, 114(7): 907-13. DOI: 10.1016/j.clineuro.2012.01.039. |
| [6] | El Beltagy M, Muroi C, Roth P, et al. Recurrent intracranial aneurysms after successful neck clipping[J]. World Neurosurg, 2010, 74(4/5): 472-7. |
| [7] | 王知非, 廖达光, 张天一, 等. CTA模拟入路早期手术治疗破裂动脉瘤[J]. 南方医科大学学报, 2009, 29(12): 2492-4-2496. |
| [8] | Peltola SM, Melchels FP, Grijpma DW. A review of rapid prototyping techniques for tissue engineering purposes[J]. Ann Med, 2008, 40(4): 268-80. DOI: 10.1080/07853890701881788. |
| [9] | Westerlaan HE, Gravendeel J, Fiore D, et al. Multi slice CT angiography in the selection of patients with ruptured intracranial aneurysms suitable for clipping or coiling[J]. Neuroradiology, 2017, 49(24): 997-1007. |
| [10] | Rustemi O, Alaraj A, Shakur SF, et al. Detection of unruptured intracranial aneurysms on noninvasive imaging. Is there still a role for digital subtraction angiography[J]. Surg Neurol Int, 2015, 6(4): 175. |
| [11] | Lu D, Li CL, Lv WF, et al. Diagnostic value of multislice computerized tomography angiography for aortic dissection: A comparison with DSA[J]. Exp Ther Med, 2017, 13(2): 405-12. DOI: 10.3892/etm.2016.3985. |
| [12] | Feng TY, Han XF, Lang R, et al. Subtraction CT angiography for the detection of intracranial aneurysms: A meta-analysis[J]. Exp Ther Med, 2016, 11(5): 1930-6. DOI: 10.3892/etm.2016.3166. |
| [13] | Imai H, Watanabe K, Miyagishima TA, et al. The outcome of a surgical protocol based on ischemia overprotection in large and giant aneurysms of the anterior cerebral circulation[J]. Neurosurg Rev, 2016, 39(3): 505-17. DOI: 10.1007/s10143-016-0721-z. |
| [14] | Joo SP, Kim TS. The clinical importance of perforator preservation in intracranial aneurysm Ssurgery: An overview with a review of the literature[J]. Chonnam Med J, 2017, 53(1): 47. DOI: 10.4068/cmj.2017.53.1.47. |
| [15] | Yasuhiro Y, Yoko K, Kohei I, et al. Role of endoscopy in multi modality monitoring during aneurysm surgery: A single center experience with 175 consecutive unruptured aneurysms[J]. Asian J Neurosurg, 2015, 10(1): 52. DOI: 10.4103/1793-5482.151518. |
| [16] | Cho WS, Kim JE, Kang HS, et al. Keyhole approach and neuro endoscopy for cerebral aneurysms[J]. J Korean Neurosurg Soc, 2017, 60(3): 275-81. DOI: 10.3340/jkns.2017.0101.002. |
| [17] | Liu P, Pan L, An XF, et al. Effect of clipping anterior commu nicating artery aneurysms via pterional approach contralateral to supply of dominant blood: report of 15 patients[J]. Int J Clin Exp Med, 2015, 8(2): 1912-7. |
| [18] | Hitoshi F, Koichi I, Kenichi M, et al. Risk factors and Consequences of unexpected trapping for ruptured anterior communicating artery aneurysms[J]. Surg Neurol Int, 2016, 25(8): 106. |
| [19] | Kim H, Kim TS, Joo SP, et al. Pterional-subolfactory approach for treatment of high positioned anterior communicating artery aneurysms[J]. J Cerebrovasc Endovasc Neurosurg, 2016, 15(3): 177-83. |
| [20] | Jing Z, Ou S, Ban Y, et al. Intraoperative assessment of anterior circulation aneurysms using the indocyanine green videoangio graphy technique[J]. J Clin Neurosci, 2010, 17(1): 26-8. DOI: 10.1016/j.jocn.2009.03.034. |
| [21] | Vinodh TD, Nitin G, William H, et al. Comparison of intraoperative indocyanine green angiography and digital subtraction angiography for clipping of intracranial aneurysms[J]. Interv Neurol, 2015, 3(3/ 4): 129-34. |
| [22] | Westermaier T, Linsenmann T, Homola GA, et al. 3D rotational fluoroscopy for intraoperative clip control in patients with intracranial aneurysms -assessment of feasibility and image quality[J]. BMC Med Imaging, 2016, 16(5): 30. |
| [23] | Li ZL, Zhang GN, Huang GF, et al. Intraoperative combined use of somatosensory evoked potential, microvascular doppler sonogr aphy, and indocyanine green angiography in clipping of intracranial aneurysm[J]. Med Sci Monit, 2016, 22(3): 373-9. |
| [24] | Hideyuki Y, Hiroyuki K, Yoshihisa N, et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: Case report[J]. Neurologia Medico-Chirurgica, 2016, 54(3): 192-5. |
| [25] | Nam TK, Park YS, Byun JS, et al. Use of Three-Dimensional Curved-Multiplanar Reconstruction images for sylvian dissection in microsurgery of middle cerebral artery aneurysms[J]. Yonsei Med J, 2017, 58(1): 241-7. DOI: 10.3349/ymj.2017.58.1.241. |
 2017, Vol. 37
2017, Vol. 37

