2. 国家实验猕猴种源基地,四川 雅安 625014
2. National Experimental Macaque Reproduce Laboratory, Ya'an 625014, China
糖尿病视网膜病变是一种常见的可致视觉损伤的可预防糖尿病并发症[1],临床上按视网膜血管异常情况主要分为非增殖期糖尿病病变和增殖期糖尿病视网膜病变。血管内皮生长因子(VEGF)及色素上皮衍生因子(PEDF)是眼内新生血管形成的重要的细胞因子,其作为血管生长因子和血管抑制因子的典型代表,两者间的平衡在维持视网膜正常结构及功能维持上具有重要意义[2]。而目前研究主要针对增生性糖尿病病变[3-5],关于糖尿病视网膜病变早期,VEGF和PEDF表达水平如何变化研究较少,如:研究不同病程糖尿病大鼠视网膜VEGF、PEDF的表达[6],但未对糖尿病视网膜早期两种因子的表达进行单独阐述。大鼠为啮齿类,不能完全模拟人类糖尿病视网膜病变过程,而猕猴的立体视觉、色觉及视网膜结构与人类最为接近,其作为实验动物更具可模拟性和科学性。本文以高脂饲料诱导的自发性糖尿病猕猴为研究对象,观察视网膜病变早期猕猴视网膜中VEGF和PEDF的表达情况,从而探讨糖尿病视网膜病变早期的发病机制,为临床早期诊断与治疗奠定理论基础,同时也为新药临床前药效研究提供参考。
1 材料和方法 1.1 实验动物与分组实验模型动物由四川农业大学实验动物工程技术中心/国家实验用猕猴种源基地提供(SYXK(川):2014-186,SCXK(川):2014-027),已成功建立由高脂饲料诱导的Ⅱ型糖尿病模型。实验动物分为两组:7~10岁患病2年的高脂饲料诱导的自发性糖尿病猕猴3只,相同年龄的健康猕猴3只。实验动物选用全身状态良好,无传染病,无寄生虫感染及其他疾病猕猴,眼科常规检查无异常、无视网膜疾病史、无青光眼及遗传性眼病家庭史等眼科疾病。实验中对动物的处置符合中华人民共和国科学技术部《关于善待实验动物的指导性意见》[7]。6只猕猴的基本信息见表 1,Ⅱ型糖尿病(T2DM)猕猴空腹血糖值及糖化血红蛋白水平达到猕猴关于糖尿病的诊断标准[8-9]。
| 表 1 选用猕猴基本信息 Table 1 Basic information of Macaca mulatta (n=3) |
VEGF多克隆抗体(ab46154 Abcom,英国);PEDF多克隆抗体(bs-0731R博奥森公司,中国);武汉博士德生物公司SABC即用型兔抗人二抗试剂盒;宝生物试剂盒Total RNA Extractor (Trizol);宝生物实时荧光定量试剂盒SYBR Premix EXTaq;宝生物反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser;DNA Marker(500 bp);Leika RM2235切片机(德国Leika);Nikon DS-Ri1光学数码显微镜(日本Nikon);多波长结构功能偶联视网膜图像仪(MSFRI仪)。
1.3 实验方法 1.3.1 动物的处理6只猕猴在氯胺酮(10 mg/kg)肌肉麻醉下,迅速摘除眼球(保留视神经2 mm左右),去除巩膜上眼肌附着肌及筋膜等多余的组织,尽量使巩膜表面保持光滑,用0.01 mol/L PBS冲洗。将猕猴的右眼置于液氮中保存,用于实时荧光定量PCR检测。左眼置于4%多聚甲醛固定液中,用于免疫组织化学检测。
1.3.2 实时荧光定量PCR检测VEGF和PEDF mRNA表达取液氮冻存的视网膜组织,参照RNA提取试剂盒(Total RNA extractor, TaKaRa)提取总RNA,然后使用反转录试剂盒(Prime Script RT reagent Kit, TaKaRa)将RNA发转录成cDNA。引物(表 2)由上海生工生物工程技术服务有限公司合成,通过1.2%琼脂糖凝胶电泳对PCR产物特异性进行检测,然后用Light Cycler480系统进行荧光定量检测,反应完成后,得到记录曲线,然后软件自动计算出CT值。
| 表 2 实时荧光定量PCR引物序列 Table 2 Sequences of the real-time fluorescence quantitative PCR primers |
将用多聚赖氨酸处理好的切片脱蜡至水,用含3% H2O2去除内源性过氧化酶,然后将切片放入柠檬酸缓冲液中进行微波炉抗原修复,用含5% BSA的山羊血清常温下封闭1 h,一抗孵育4 ℃过夜,然后二抗室温下孵育1 h,加SABC反应1 h,最后用DAB蓝色显色液显色,蒸馏水终止显色,梯度酒精脱水,二甲苯透明后封片。每次实验设置阴性对照组,以PBS液取代一抗,其他步骤完全相同。
1.4 统计学分析免疫组化染色后,每只动物选取3张切片,每张切片选取2个视野,在400倍视野下采集图像,使用Image proplus6.0图像分析软件测定阳性表达产物的积分光密度值取平均值进行统计学分析。实时荧光定量PCR的最终结果用相对含量表示。实验结果以均数±标准差表示,采用SPSS20.0统计软件对数据进行分析。多组均数比较采用单因素方差分析,各组数据间两两比较采用q检验进行处理,P < 0.05差异有统计学意义。
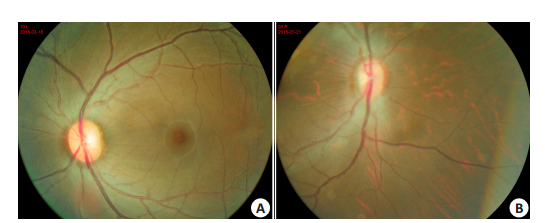
2 结果 2.1 猕猴眼底彩照结果正常组、T2DM组猕猴麻醉、散瞳后,使用多波长结构功能偶联视网膜图像仪(MSFRI仪)进行猕猴眼底照相,拍摄结果如图 1所示,眼底镜下未见明显的出血点遮挡,微血管瘤,硬性渗出,静脉串珠样改变,毛细血管形成等糖尿病视网膜病变症状。临床上,通过多焦视网膜电图(fERG)、眼底彩照及OCT等技术未检查出视网膜内血管异常,那么判断糖尿病性视网膜病变为非增殖性糖尿病性视网膜病变或甚至处于更早的病变时期,这个阶段的糖尿病视网膜病变称为糖尿病视网膜病变早期[10];本实验中T2DM组猕猴空腹血糖值及糖化血红蛋白水平已达到糖尿病的诊断标准[8-9],结合猕猴糖尿病病程及眼底彩照结果,诊断T2DM组猕猴处于糖尿病视网膜病变早期。
|
图 1 猕猴眼底彩照结果 Figure 1 A fundus photograph of a control (A) and a T2DM Macaca mulatta (B). |
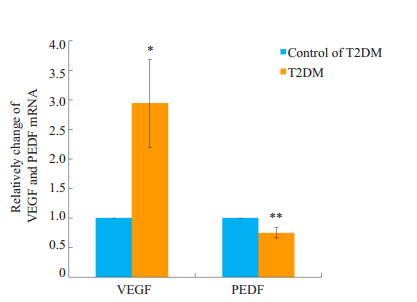
荧光定量检测猕猴视网膜中VEGF及PEDF的mRNA表达情况见图 2,处于糖尿病视网膜病变早期的猕猴视网膜VEGF mRNA的表达量为对照组的2.947倍(P < 0.05);而模型组猕猴视网膜中PEDF mRNA的表达为对照组的0.749倍(P < 0.01)。
|
图 2 T2DM组及对照组视网膜中VEGF、PEDF mRNA相对表达量 Figure 2 Expression of VEGF and PEDF mRNA in retinas of Macaca mulatta detected by quantitative real-time PCR. *P < 0.05, **P < 0.01. |
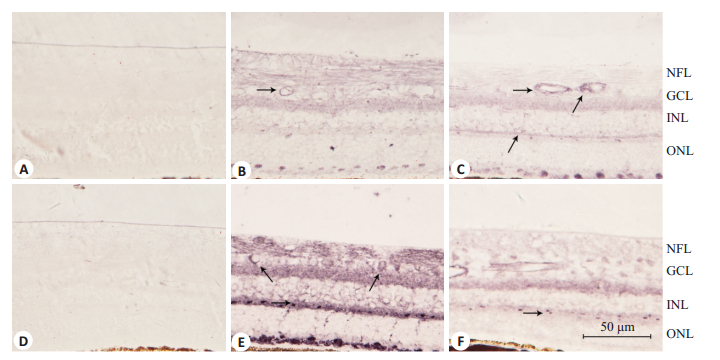
在400倍光镜(图 3)下观察可见,VEGF表达阳性细胞呈现蓝色,对照组猕猴视网膜VEGF阳性物质主要表达于视网膜神经节细胞层、内核层以及血管等部位,VEGF阳性物质在T2DM糖尿病猕猴视网膜各层均有表达,在神经节细胞层、内核层及血管表达明显,对视网膜结构中VEGF表达平均光密度值进行统计发现,VEGF在对照组猕猴0.48±0.27的视网膜各个部位表达显著(P < 0.05)低于Ⅱ型糖尿病猕猴0.614 ± 0.72,表明VEGF蛋白表达与mRNA相对表达变化趋势具有一致性。
|
图 3 VEGF和PEDF在T2DM对照组及T2DM猕猴视网膜中免疫组化染色 Figure 3 Immunohistochemical staining of the retinas for detecting VEGF (A-C) and PEDF (D-F) in T2DM (B, E) and control (C, F) Macaca mulatta. The positive expression is shown by arrows. A, C was the negative control for VEGF ad PEDF, respectively. NFL: Nerve fiber layer; INL: Inner nuclear layer; ONL: Outer nuclear layer. |
在400倍光镜下可见(图 3),PEDF蛋白阳性表达呈现蓝色,对照组猕猴视网膜内PEDF阳性物质主要表达于神经节细胞层、内丛状层、外核层等部位,而在T2DM糖尿病猕猴视网膜的这些部位也可见有表达,但其表达量减少。对视网膜结构中PEDF表达平均光密度值进行统计发现,对照组猕猴视网膜和T2DM组猕猴视网膜的平均积分光密度值为0.698±0.44、0.480±0.44,差异显著(P < 0.05)。表明PEDF在对照组猕猴视网膜的蛋白水平表达显著高于T2DM组糖尿病视网膜,其蛋白表达与mRNA相对表达变化趋势一致。
3 讨论糖尿病视网膜病变动物模型主要包括啮齿类及灵长类,其中啮齿类动物模型因具有构建周期短,较易建立的特点,在国内外研究中较为成熟[11],但其种属及解剖学的差异与人类存在一定的差距。非人灵长类动物—猕猴因其具有立体视觉、色觉、双目视力、与人类视网膜结构极其相似等特点,是眼科研究的理想模型。自发性糖尿病视网膜病变和肥胖、遗传因素具有一定的关系[12],本实验通过高脂饲料诱导的自发性糖尿病猕猴,来模拟人体内糖尿病视网膜病变的发生发展过程,相比以往通过链脲佐菌素诱导啮齿类动物进行的研究[6, 13],具有重要的研究价值和可模拟特性。
VEGF是糖尿病视网膜病变发生发展的关键细胞因子,在色素上皮细胞、神经胶质细胞、神经元、内皮细胞、睫状上皮细胞、MÜller细胞均有表达[14]。本实验结果显示相比对照组的猕猴视网膜,处于糖尿病视网膜病变早期的猕猴视网膜内VEGF在蛋白水平和mRNA水平上均有显著的增加,与在糖尿病大鼠早期模型的研究结果一致[15]。VEGF的上调是一种遏制血管和缺血性改变的代偿机制,临床上常用VEGF抑制剂来进行糖尿病视网膜病变治疗,且被认为与治疗增生性视网膜病变的金标准—视网膜激光光凝固法的治疗效果相当[16],但对于VEGF抑制剂治疗是否安全也缺乏长期的临床数据[17],且长期使用VEGF抑制剂治疗可能会导致神经元及血管变性[18-19]。VEGF家族成员众多,因其对血管的发生发展具有不同的作用而引起重视[20]。目前,治疗糖尿病视网膜病变的靶点主要针对VEGF-A、VEGF-B及胎盘生长因子,研究VEGF家族各成员的表达水平可推测出猕猴模型中糖尿病视网膜损害的水平。
PEDF是重要的内源性抗血管生成因子,能够引起有活性的血管内皮细胞发生凋亡从而抑制血管形成[21]。本文PEDF的蛋白表达水平和mRNA水平在猕猴糖尿病视网膜病变早期时呈现显著的下降趋势,与以往在糖尿病小鼠模型上的研究结论一致[22]。糖尿病患者血清中PEDF水平有所增加,可能是对糖尿病病人的保护性反应[23]。因此,其在外周血的变化可能对糖尿病视网膜病变的发生具有一定的指导意义。在糖尿病视网膜病变早期大鼠玻璃体内注射PEDF,可抑制氧化应激产生[24]及视网膜内白细胞停滞[25],增加血管通透性。恢复视网膜内PEDF水平对糖尿病视网膜病变具有治疗意义,能缓解神经退行性病变,增加血管通透性,抑制新生血管的形成,可尝试合成重组PEDF蛋白衍生肽用于临床治疗。
糖尿病眼底视网膜病变是众多糖尿病并发症之一,其产生的基础为微血管病变[26],视网膜血管生成是一个严格调控的过程,由于缺血或代谢性应激分泌血管生长因子,从而引起内皮细胞增生、迁移、管壁的形成[27]。实验证明,糖尿病视网膜病变早期视网膜内出现VEGF上调、PEDF下调,实验结果与先前在大鼠上的研究[6]一致,再次验证了视网膜内VEGF、PEDF表达失调在糖尿病视网膜病变早期已存在,同时提示其水平的改变在糖尿病视网膜早期研究中可能没有较大的种属差异。糖尿病视网膜病变一旦进入纤维增生期,很难通过药物逆转,所以对糖尿病视网膜病变的早期诊断、干预、阻断糖尿病视网膜病变的发生发展具有重要意义。虽然临床上从人体获得视网膜标本不现实,但利用荧光分子成像技术,可实现活体、无创、实时和动态的观察VEGF、PEDF蛋白表达水平的变化,同时联合影像学技术可为早期糖尿病视网膜病变提供辅助诊断。本研究结果提示,消除VEGF过表达,增加PEDF的表达量可能有助于预防视网膜病变早期糖尿病视网膜病变的进一步加重。目前,关于PEDF及VEGF抑制剂联合使用效果有待于进一步探索,且外源性细胞因子应用于玻璃体时,需多次注射且神经营养因子容易失活,尚不能完全应用于临床,仍需大量基础研究及药理评价以证明其用于临床的有效性及安全性。
| [1] | Yau JW, Rogers SL, Kawasaki R, et al. Global prevalence and major risk factors of diabetic retinopathy[J]. Diabetes Care, 2012, 35(3): 556-64. DOI: 10.2337/dc11-1909. |
| [2] | Chen SL, Chakrabarti R, Keats EC, et al. Regulation of vascular endothelial growth factor expression by extra domain B segment of fibronectin in endothelial cells[J]. Invest Ophthalmol Vis Sci, 2012, 53(13): 8333-43. DOI: 10.1167/iovs.12-9766. |
| [3] | 樊小娟, 张小玲. 糖尿病视网膜病变发病机制中VEGF与PEDF的研究进展[J]. 国际眼科杂志, 2007, 7(2): 485-8. |
| [4] | Duh EJ, Yang HS, Haller JA, et al. Vitreous levels of pigment epithelium-derived factor and vascular endothelial growth factor: implications for ocular angiogenesis[J]. Am J Ophthalmol, 2004, 137(4): 668-74. |
| [5] | 陈小红, 王云鹏, 陈梅珠. VEGF和PEDF在增殖性糖尿病视网膜病变中的研究进展[J]. 国际眼科杂志, 2015, 15(1): 55-7. DOI: 10.3980/j.issn.1672-5123.2015.1.15. |
| [6] | 李小璐. 不同病程糖尿病大鼠视网膜病理改变及其VEGF、PEDF的动态表达[D]. 宁夏医科大学, 2013. http://d.wanfangdata.com.cn/Thesis/D421618 |
| [7] | Ministry of science, Technology of the People's Repubilc of China. Guidance suggestions for the care and use of laboratory animals[M]. Beijing: 2006. |
| [8] | 曾文. 恒河猴川西亚种生物学特性背景数据建立及在新药评估中的应用研究[D]. 雅安: 四川农业大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10626-1011222517.htm |
| [9] | Gong L, Zeng W, Yang ZY, et al. Comparison of the clinical manifestations of type 2 diabetes mellitus between rhesus monkey (macaca mulatta lasiotis) and human being[J]. Pancreas, 2013, 42(3): 537-42. DOI: 10.1097/MPA.0b013e3182732501. |
| [10] | Simó R, Hernández C. European consortium for the Early treatment of diabetic retinopathy (EUROCONDOR).Neurodegeneration in the diabetic eye: new insights and therapeutic perspectives[J]. Trends Endocrinol Metab, 2014, 25(1): 23-33. DOI: 10.1016/j.tem.2013.09.005. |
| [11] | Zhou Q, Xiao A, Ophthalmology DO. Effects of ranibizumab on retinal structure at early stage of diabetic rats[J]. Rec Adv Ophthalmol, 2015, 45(6): 452. |
| [12] | Chen Y, Ono F, Yoshida T, et al. Relationship between body weight and hematological and serum biochemical parameters in female cynomolgus monkeys(Macaca fascicularis)[J]. Exp Anim, 2002, 51(2): 125-31. DOI: 10.1538/expanim.51.125. |
| [13] | 李艳, 李筱荣, 袁佳琴, 等. 糖尿病大鼠视网膜中VEGF、PEDF的表达与血-视网膜屏障损伤[J]. 眼科新进展, 2013, 33(1): 29-32. |
| [14] | Gupta N, Mansoor S, Sharma A, et al. Diabetic retinopathy and VEGF[J]. Open Ophthalmol J, 2013, 7(1): 4-10. DOI: 10.2174/1874364101307010004. |
| [15] | Sone H, Kawakami Y, Okuda Y, et al. Ocular vascular endothelial growth factor levels in diabetic rats are elevated before observable retinal proliferative changes[J]. Diabetologia, 1997, 40(6): 726-30. DOI: 10.1007/s001250050740. |
| [16] | Network WC, Cross JG, Glassman AR, et al. Panretinal photocoagulation vs intravitreous ranibizumab for proliferative diabetic retinopathy: a randomized clinical trial[J]. JAMA, 2015, 314(20): 2137. DOI: 10.1001/jama.2015.15217. |
| [17] | Al-Latayfeh M, Silva PS, Sun JK. Antiangiogenic therapy for ischemic retinopathies[J]. Cold Spring Harb Perspect Med, 2012, 2(6): a006411. |
| [18] | Kurihara T, Westenskow PD, Bravo SA, et al. Targeted deletion of Vegfa in adult mice induces vision loss[J]. J Clin Invest, 2012, 122(11): 4213-7. DOI: 10.1172/JCI65157. |
| [19] | Hombrebueno JR, Ali IH, Xu H, et al. Sustained intraocular VEGF neutralization results in retinal neurodegeneration in the Ins2(Akita) diabetic mouse[J]. Sci Rep, 2015, 5(4): 18316. |
| [20] | Moran EP, Wang Z, Chen J, et al. Neurovascular crosstalk in diabetic retinopathy: pathophysiological roles and therapeutic implications[J]. Am J Physiol Heart Circ Physiol, 2016, 311(3): H738-49. DOI: 10.1152/ajpheart.00005.2016. |
| [21] | Stellmach V, Crawford SE, Zhou W, et al. Prevention of ischemia induced retinopathy by the natural ocular antiangiogenic agent pigment epithelium-derived factor[J]. Proc Natl Acad Sci USA, 2001, 98(5): 2593-7. DOI: 10.1073/pnas.031252398. |
| [22] | Liu Y, Lan FL, Mcgregor C, et al. Pigment epithelium-derived factor (PEDF) peptide eye drops reduce inflammation, cell death and vascular leakage in diabetic retinopathy in Ins2akita mice[J]. Mol Med, 2012, 18(1): 1387. |
| [23] | He XE, Cheng R, Benyajati S, et al. PEDF and its roles in physiological and pathological conditions: implication in diabetic and hypoxia-induced angiogenic diseases[J]. Clin Sci (Lond), 2015, 128(11): 805-23. DOI: 10.1042/CS20130463. |
| [24] | Yoshida Y, Yamagishi SI, Matsui TA, et al. Protective role of pigment epithelium-derived factor (PEDF) in early phase of experimental diabetic retinopathy[J]. Diabetes Metab Res Rev, 2009, 25(7): 678-86. DOI: 10.1002/dmrr.v25:7. |
| [25] | Yamagishi SI, Matsui T, Nakamura KA, et al. Pigment epithelium derived factor (PEDF) prevents diabetes-or advanced glycation end products (AGE)-elicited retinal leukostasis[J]. Microvasc Res, 2006, 72(1/2): 86-90. |
| [26] | Muir IK. Shock. pathology, metabolism, shock cell, treatmen[J]. Brit J Plast Surg, 1978, 32(2): 939. |
| [27] | Sapieha P, Hamel D, shao D, et al. Proliferative retinopathies: Angiogenesis that blinds[J]. Int J Biochem Cell Biol, 2010, 42(1): 5-12. DOI: 10.1016/j.biocel.2009.10.006. |
 2017, Vol. 37
2017, Vol. 37

