黄花败酱草为败酱科败酱属植物黄花败酱(Patrinia scabiosaefolia Fisch.)的干燥全草,又名黄花龙芽、野共花、鹤立鸡群、鹿肠等,广泛分布于全国大部分地区。该植物始载于《神农本草经》,在我国有着悠久的用药历史。其性味辛、苦,微寒,具有清热解毒、消痈排脓、祛瘀止痛之功效[1-2]。现代药理学研究表明,黄花败酱草乙醇提取部位可抑制结肠癌血管新生,阻滞细胞周期,并可通过STAT3信号通路诱导多发性骨髓瘤细胞凋亡[3-5],但其具体的抗肿瘤成分及作用机制尚不明确。我们前期经MTT法筛选黄花败酱草抗肿瘤活性成分研究发现,黄花败酱草中的五环三萜皂苷巨头刺草皂甙D(GD)具有较好的抗原发性肝癌Hep 3b细胞的活性。因此,我们拟在前期实验的基础上,对GD抗肝癌细胞作用进行进一步研究,并对其抗肝癌的作用机制进行初步探索,以期为阐明黄花败酱草抗肿瘤的活性成分及其抗肿瘤的作用机制奠定初步的实验基础。
1 材料和方法 1.1 细胞株人原发性肝癌细胞Hep 3b购于美国ATCC。
1.2 药物及试剂GD由本实验室分离得到,经HPLC检测其纯度高于98%。RPMI 1640、胎牛血清(FBS)、胰蛋白酶和青-链霉素购于Gibco公司;Bcl-2、PARP抗体购于Santa Cruz公司;MAPK通路试剂盒、β-actin和羊抗兔IgG-HRP购于Cell Signaling公司;JC-1和化学发光检测系统电化学发光反应液购于Invitrogen公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、碘化吡啶(PI)、核糖核酸酶A(RNAase A)和Hoechst 33258及其它试剂均购于美国Sigma公司。
1.3 细胞培养细胞接种于盛有适量RPMI 1640培养液(含10% FBS和1%青-链霉素溶液)的培养瓶中,在37 ℃、5%(v/v)CO2的细胞培养箱中培养。于对数生长期进行传代或实验。
1.4 肿瘤细胞体外增殖抑制试验[6]取1×106个处于对数生长期的肝癌细胞Hep 3b配成细胞悬液接种于96孔培养板中,每孔加100 μL。在37 ℃、5%(v/v)CO2培养箱中培养24 h后加药。空白对照组换入新鲜培养液,实验组换入不同浓度的加药培养液,每组设8个平行孔。再将细胞置于培养箱中继续培养。72 h后弃去培养液,每孔加30 μL MTT(5 mg/mL),然后放入培养箱作用4 h,再弃去MTT,每孔加入100 μL DMSO,轻拍板缘使其将反应产物充分溶解。用酶标仪在570 nm波长处测量各孔的吸光度(Oplical Density, OD)值,再代入以下公式计算Hep 3b的生长抑制率。
生长抑制率%=(1-实验组平均A值/对照组平均A值)×100%
1.5 细胞形态学变化观察取1×106处于对数生长期的肝癌细胞Hep 3b配成细胞悬液接种于96孔培养板中,每孔加100 μL。在37 ℃、5%(v/v)CO2培养箱中培养24 h后加药。空白对照组换入新鲜培养液,实验组换入不同浓度的加药培养液,每组设8个平行孔。再将细胞置于培养箱中继续培养。72 h后弃去培养液,用适量PBS洗2次,在光学显微镜下观察细胞形态变化情况。
1.6 细胞克隆实验[7]取1.8×103个处于对数生长期的肝癌细胞Hep 3b接种于6孔培养板中,每孔再加3 mL新鲜培养液。在37 ℃、5%(v/v)CO2培养箱中培养24 h后换入含不同浓度的药物的培养液,继续培养24 h。然后吸去原培养液,用PBS洗细胞2次,再加入适量新鲜培养液,置于培养箱中继续培养。10 d后用倒置Ⅸ51显微镜计数每孔细胞团落数。
1.7 流式细胞术测定细胞DNA含量[6]取1.8×106个处于对数生长期的肝癌细胞Hep 3b接种于6孔培养板中,每孔再加3 mL新鲜培养液。在37 ℃、5%(v/v)CO2培养箱中培养24 h后换入含不同浓度药物的培养液,继续培养72 h。然后弃去培养液,收集细胞,PBS洗细胞2次,再于每个样品中分别加入10 μL PI、50 μL RNase A和400 μL PBS进行染色。37 ℃、避光条件下作用30 min后,用Epics XL型流式细胞仪(Beckman Coulter)在Ex=488 nm、Em=620 nm条件下测定细胞DNA含量。
1.8 Hoechst 33258染色观察[8]取1.8×106个处于对数生长期的肝癌细胞Hep 3b接种于6孔培养板中,每孔再加3 mL新鲜培养液。在37 ℃、5%(v/v)CO2培养箱中培养24 h后换入含不同浓度的药物的培养液,继续培养72 h。然后吸去原培养液,用PBS洗细胞2次,再在每孔加入1 mL PBS后分别加入1 μL Hoechst 33258染色剂(终浓度为10 μg/mL)。30 min后,用PBS清洗2次,用荧光显微镜在激发波长360 nm、发射波长450 nm条件下观察细胞状态并随机拍照。
1.9 JC-1染色法检测线粒体膜电位(ΔΨm)[9]取1.8×106个处于对数生长期的肝癌细胞Hep 3b接种于6孔培养板中,每孔再加3 mL新鲜培养液。在37 ℃、5%(v/v)CO2培养箱中培养24 h后换入含不同浓度药物的培养液,继续培养72 h。然后弃去培养液,收集细胞,PBS洗细胞2次,再于每个样品中分别加入0.5 μL终浓度为10 μmol/mL的JC-1和500 μL PBS进行染色。37 ℃下孵育30 min后,用流式细胞仪在Ex=488 nm,Em=525、575 nm条件下测定平均荧光强度。
1.10 Western blot免疫印迹法[6]取2×106个处于对数生长期的肝癌细胞Hep 3b接种于100 mm培养皿中,在37 ℃、5%(v/v)CO2培养箱中培养24 h后换入含不同浓度药物的培养液,作用72 h后收集各皿细胞,于冰上裂解细胞,提取总蛋白,用考马斯兰试剂法测定蛋白浓度。经SDS聚丙烯酰胺凝胶电泳后将凝胶上的蛋白转至PVDF膜。然后室温下在含5%脱脂奶粉的TBS-T中封闭1 h。TBS-T洗膜后加5%脱脂奶粉稀释的一抗(1:1000)室温下孵育1 h。洗膜后加入5%脱脂奶粉稀释的HRP标记的相应二抗(1:1000)室温下孵育1 h。用ECL化学发光试剂显色,于暗室中进行曝光、显影、定影。拍片后TBS-T洗膜,再加入5%脱脂奶粉稀释的β-actin(1:1000),室温下孵育1 h,孵育二抗、显影拍片操作同上。
1.11 统计学方法实验结果以均数±标准差表示,采用Graphpad Prism 5.0软件进行统计学分析。采用单因素方差分析(One-way ANOVA)、Post Hoc比较和Tukey检验法进行统计学分析,P<0.05时,差异有统计学意义。
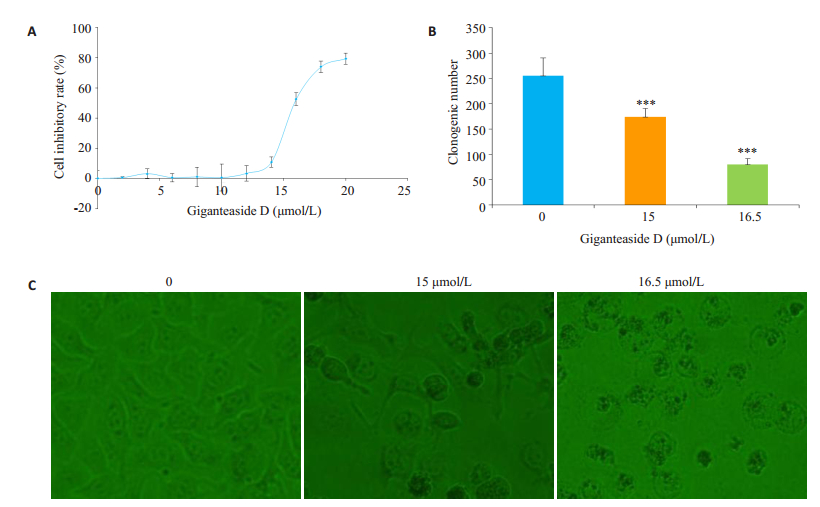
2 结果 2.1 GD对原发性肝癌细胞Hep 3b的细胞毒性通过比较分析实验组与对照组的吸光度值和生长抑制率(图 1A),发现GD对Hep 3b具有较强的细胞毒性,且呈现剂量依赖性,浓度越高,药物对Hep 3b的抑制作用越强,其中半数抑制浓度IC50=16.08 µmol/L。
|
图 1 GD抗肿瘤活性评价 Figure 1 Inhibitory effect of GD on hepatocellular carcinoma cells in vitro. A: Cytotoxicity of GD at different concentrations in Hep 3b cells for 72 h; B: Clone formation of Hep 3b cells after GD treatment; C: Morphological changes of Hep 3b cells after GD treatment for 72 h. |
细胞克隆实验显示,随着药物浓度的增加,细胞团落数逐渐减少(图 1B),表明GD对Hep 3b的长期增殖有抑制作用。
2.3 GD对Hep 3b细胞形态学的影响光学显微镜下观察可见,对照组Hep 3b细胞形态正常,呈梭形,饱满,折光率强;低浓度组的细胞变为长条状,少数变圆;随着药物浓度的增加,越来越多细胞呈圆形,折光率降低;最高浓度组几乎无活细胞,培养液中漂浮大量细胞碎片(图 1C)。
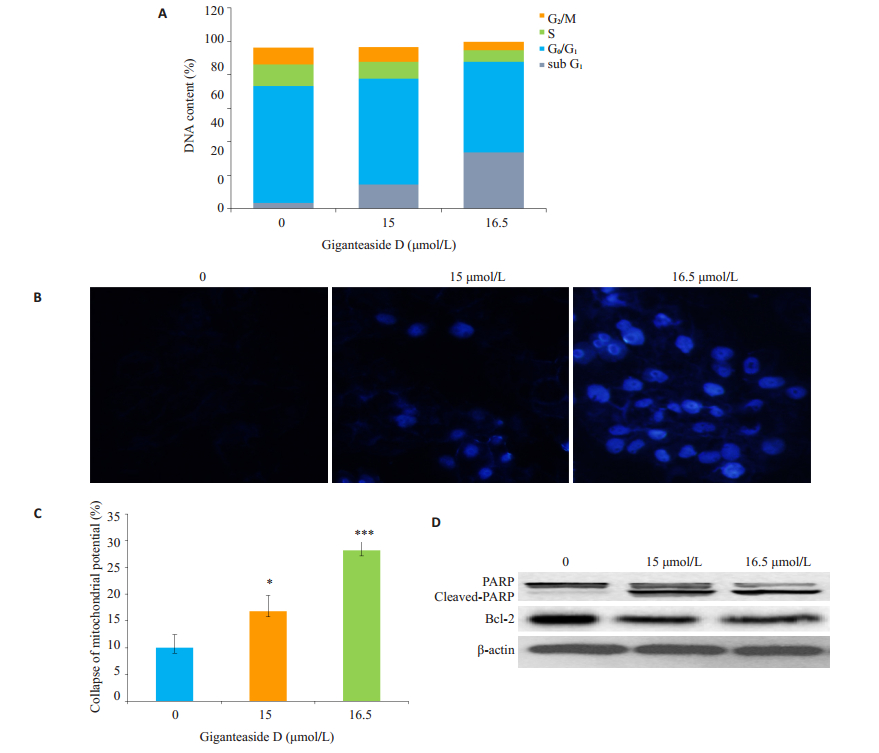
2.4 GD对Hep 3b的细胞周期的影响流式细胞术测定细胞DNA含量结果显示,GD作用72 h后,细胞周期无明显改变,但是随着药物浓度增加,阻滞作用时间延长,细胞凋亡率增加,呈现一定的时间和剂量依赖性(图 2A)。
|
图 2 GD诱导Hep 3b细胞凋亡 Figure 2 GD-induced apoptosis in Hep 3b cells. A: Flow cytometric analysis of DNA content in Hep 3b cells after GD treatment for 72 h; B: Morphological changes of Hep 3b cells induced by GD (Hoechst33258 staining, original magnification: ×400); C: Changes of mitochondrial membrane potential in Hep 3b cells treated with different concentrations of GD; D: Expression levels of PARP and Bcl-2 in Hep 3b cells treated with different concentrations of GD for 72 h. |
荧光显微镜下观察Hoechst 33258染色后的细胞,对照组细胞显均匀的淡蓝色,随着药物浓度的增加,细胞逐渐变小变圆,细胞核内显现强荧光颗粒物质,药物浓度越高,强荧光颗粒物质越多(图 2B)。
2.6 GD对Hep 3b细胞线粒体膜电位的影响JC-1染色法检测线粒体膜电位结果表明,GD可降低Hep3b线粒体膜电位,且呈显著的剂量依赖关系(图 2C),提示GD可能经由线粒体信号通路诱导肝癌细胞凋亡。
2.7 GD对Hep 3b凋亡蛋白PARP及线粒体通路相关蛋白Bcl-2的影响通过Western blot免疫印迹法检测发现,GD作用Hep 3b 72 h后,与凋亡相关的调控因子PARP的活化形式增加,非活化形式减少;线粒体通路相关蛋白Bcl-2表达减少(图 2D)。
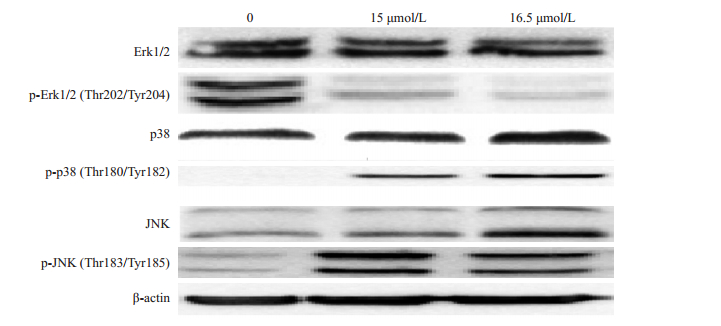
2.8 GD对MAPK通路关键蛋白的影响Western blotting结果显示,GD作用Hep 3b 72 h后,MAPK通路关键蛋白Erk磷酸化形式表达减少,p38和JNK磷酸化形式表达增加,提示MAPK通路可能参与了GD诱导的凋亡作用(图 3)。
|
图 3 不同浓度GD作用Hep 3b细胞72 h后对MAPK信号通路关键蛋白的影响 Figure 3 Expression levels of the key proteins of MAPK signaling pathway in Hep 3b cells treated with different concentrations of giganteaside D for 72 h. |
原发性肝癌在常见癌症死因中位列第二,严重影响人类生命健康,而我国的原发性肝癌病例就达到全世界肝癌总病例的50%以上[10-11],故防治肝癌刻不容缓。目前,肝癌的治疗手段主要包括化学药物治疗、放射治疗、外科手术等[12-15]。其中,化学药物治疗占有重要的地位,发展最快。但目前的化学抗癌药物均存在极大的毒副作用,因此从天然药物(中药)中发现高效低毒的化学成分是抗肝癌药物研究的热点[11, 13, 15-17]。
黄花败酱草为败酱科败酱属植物黄花败酱的干燥全草,临床使用发现该中药具有较好的抗肿瘤作用。现代药理学研究表明,黄花败酱草的乙醇提取物可抑制结肠癌[3-5, 18]。但其具体的抗肿瘤成分及作用机制尚不明确。我们前期初步研究发现,黄花败酱草中的五环三萜皂苷GD具有较好的抗肝癌细胞Hep 3b的活性。因此,我们对GD的抗原发性肝癌的机制进行初步探索。
MTT实验和细胞克隆实验表明,GD不仅具有较强的细胞毒性,并且可以抑制肝癌细胞的长期增殖,提示GD具有良好的抗肝癌细胞Hep 3b活性。进一步的细胞形态学观察发现GD作用细胞72 h后,Hep 3b变得瘦长,部分变圆,折光率下降,有细胞碎片漂浮在培养液中。随着浓度增高,大部分细胞变圆,贴壁能力减弱,漂浮于培养液中。该研究结果进一步证实了GD对Hep 3b的抑制作用。
我们通过流式细胞术测定GD作用Hep 3b细胞后DNA含量的变化。结果发现GD对细胞周期无明显影响。但有研究发现,黄花败酱草的乙醇提取物可以阻滞结肠癌细胞于G1/S期[3],我们推测,这可能与细胞种类以及提取物中的化合物种类密切相关。但细胞周期结果证明,随着GD浓度提高,sub G1期的Hep 3b细胞明显增加,提示凋亡的发生。因此,我们进一步用Hoechst 33258染色法观察细胞的形态学变化。结果发现GD作用后的Hep 3b细胞在荧光显微镜下可观察到特异性的蓝色亮点,证明GD可诱导肝癌细胞Hep 3b凋亡。
线粒体在细胞凋亡中扮演着重要角色。线粒体膜电位下降是线粒体膜结构与功能开始出现不可逆改变的早期征兆,可作为凋亡的特征性标志。随着线粒体膜电位的下降,线粒体将释放细胞色素c,激活Caspase,最终导致细胞凋亡[19]。JC-1染色法检测线粒体膜电位结果表明GD可降低Hep 3b线粒体膜电位,提示GD诱导Hep 3b凋亡可能与线粒体功能变化有关。PARP是死亡受体家族的一种调控因子,与基因完整性监护和DNA修复有关。PARP的功能失常导致受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解核小体间的DNA,引起细胞凋亡。Bcl-2属于Bcl-2家族,为参与线粒体凋亡通路的关键蛋白[20]。Western blotting检测PARP及Bcl-2的变化,结果发现GD作用后,活化的PARP表达增加而非活化型表达减少,Bcl-2表达减少,表明GD可能作用于Bcl-2及凋亡调控因子进而诱导Hep 3b凋亡。
研究表明某些信号通路调控肝癌细胞的生长、分化、转移等,在肝癌的发生发展中起重要作用,其中丝裂原活化蛋白激酶(MAPK)信号通路的异常活化与肝癌密切相关[14, 21-24]。MAPK通路是参与肿瘤死亡、分化及增殖的重要信号通路,主要由Erk,p38,JNK组成[25-27]。通过级联反应,MAPK通路将细胞外的刺激传导至细胞内,磷酸化的MAPK激活细胞内的转录因子,转录和表达目的基因,从而调控肿瘤细胞的生命过程。其中,Erk信号通路由生长因子激活,对肝癌细胞的增殖、转移及肿瘤血管形成发挥促进作用,Erk活化可抑制细胞凋亡;而激活p38与JNK信号通路则诱导肝癌细胞凋亡[20, 28-29]。我们研究发现,GD作用肝癌细胞Hep 3b后,能够减少Erk磷酸化形式的表达并增加p38和JNK磷酸化水平。该结果提示MAPK信号通路可能参与了GD诱导的凋亡。
综上所述,我们的实验初步证明GD具有良好的抗肝癌细胞Hep 3b活性,其抗肝癌的作用机制可能是通过MAPK通路,损伤线粒体,降低Bcl-2水平,进而激活Caspase,切割PARP,诱导肝癌细胞Hep 3b凋亡。但是GD是否具有体内抗肝癌活性及其诱导肝癌细胞凋亡的具体信号通路还有待于进一步研究。
| [1] | 杨柳, 姜海, 王雪莹, 等. 黄花败酱草化学成分和药理作用的研究进展[J]. 中医药信息, 2012, 29(4): 169-72. |
| [2] | 彭康, 张一昕. 中药学[M]. 北京: 科学出版社, 2013: 58. |
| [3] | Zhang M, Sun G, Shen A, et al. Patrinia scabiosaefolia inhibits the proliferation of colorectal cancer in vitro and in vivo via G1/S cell cycle arrest[J]. Oncol Rep, 2015, 33(2): 856-60. DOI: 10.3892/or.2014.3663. |
| [4] | Chen L, Liu L, Ye L, et al. Patrinia scabiosaefolia inhibits colorectal cancer growth through suppression of tumor angiogenesis[J]. Oncol Rep, 2013, 30(3): 1439-43. DOI: 10.3892/or.2013.2582. |
| [5] | Peng J, Chen Y, Lin J, et al. Patrinia scabiosaefolia extract suppresses proliferation and promotes apoptosis by inhibiting the STAT3 pathway in human multiple myeloma cells[J]. Mol Med Rep, 2011, 4(2): 313-8. |
| [6] | Zhang DM, Liu JS, Tang MK, et al. Bufotalin from Venenum Bufonis inhibits growth of multidrug resistant HepG2 cells through G2/M cell cycle arrest and apoptosis[J]. Eur J Pharmacol, 2012, 692(1/3): 19-28. |
| [7] | Zhang DM, Liu JS, Deng LJ, et al. Arenobufagin, a natural bufadienolide from Toad venom, induces apoptosis and autophagy in human hepatocellular carcinoma cells through inhibition of PI3K/ Akt/mTOR pathway[J]. Carcinogenesis, 2013, 34(6): 1331-42. DOI: 10.1093/carcin/bgt060. |
| [8] | Liu J, Wei X, Wu Y, et al. Giganteaside D induces ROS-mediated apoptosis in human hepatocellular carcinoma cells through the MAPK pathway[J]. Cell Oncol (Dordr), 2016, 39(4): 333-42. |
| [9] | Liu J, Zhang D, Li Y, et al. Discovery of bufadienolides as a novel class of ClC-3 chloride Channel activators with antitumor activities[J]. J Med Chem, 2013, 56(14): 5734-43. DOI: 10.1021/jm400881m. |
| [10] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262. |
| [11] | Chen J, Jin R, Zhao J, et al. Potential molecular, cellular and microenvironmental mechanism of sorafenib resistance in hepatocellular carcinoma[J]. Cancer Lett, 2015, 367(1): 1-11. DOI: 10.1016/j.canlet.2015.06.019. |
| [12] | Attwa MH, El-Etreby SA. Guide for diagnosis and treatment of hepatocellular carcinoma[J]. World J Hepatol, 2015, 7(12): 1632-51. DOI: 10.4254/wjh.v7.i12.1632. |
| [13] | Wang X, Wang N, Cheung F, et al. Chinese medicines for prevention and treatment of human hepatocellular carcinoma: current progress on pharmacological actions and mechanisms[J]. J Integr Med, 2015, 13(3): 142-64. DOI: 10.1016/S2095-4964(15)60171-6. |
| [14] | Ma L, Ji L, Yu Y, et al. Novel molecular targets for diagnosis and treatment of hepatocellular carcinoma[J]. Discov Med, 2015, 19(12): 7-14. |
| [15] | Ge SH, Huang DZ. Systemic therapies for hepatocellular carcinoma[J]. Drug Discov Ther, 2015, 9(5): 352-62. DOI: 10.5582/ddt.2015.01047. |
| [16] | Zhu YY, Huang HY, Wu YL. Anticancer and apoptotic activities of oleanolic acid are mediated through cell cycle arrest and disruption of mitochondrial membrane potential in HepG2 human hepato cellular carcinoma cells[J]. Mol Med Rep, 2015, 12(4): 5012-8. DOI: 10.3892/mmr.2015.4033. |
| [17] | Hu Y, Wang S, Wu X, et al. Chinese herbal medicine-derived compounds for cancer therapy: a focus on hepatocellular carcinoma[J]. J Ethnopharmacol, 2013, 149(3): 601-12. DOI: 10.1016/j.jep.2013.07.030. |
| [18] | Liu L, Shen A, Chen Y, et al. Patrinia scabiosaefolia induces mitochondrial-dependent apoptosis in a mouse model of colorectal cancer[J]. Oncol Rep, 2013, 30(2): 897-903. DOI: 10.3892/or.2013.2528. |
| [19] | 刘俊珊, 张冬梅, 陈敏锋, 等. 沙蟾毒精抑制血管生成的作用[J]. 药学学报, 2011, 46(5): 527-33. |
| [20] | Zhang H, Qian Y, Liu Y, et al. Celastrus orbiculatus extract induces mitochondrial-mediated apoptosis in human hepatocellular carcinoma cells[J]. J Tradit Chin Med, 2012, 32(4): 621-6. DOI: 10.1016/S0254-6272(13)60081-3. |
| [21] | Nakagawa H, Maeda S. Molecular mechanisms of liver injury and hepatocarcinogenesis: focusing on the role of stress-activated MAPK[J]. Patholog Res Int, 2012, 2012: 172894. |
| [22] | Chen C, Wang G. Mechanisms of hepatocellular carcinoma and challenges and opportunities for molecular targeted therapy[J]. World J Hepatol, 2015, 7(15): 1964-70. DOI: 10.4254/wjh.v7.i15.1964. |
| [23] | 张蕊, 彭芳. 中药影响肝癌细胞信号转导通路的研究进展[J]. 医学综述, 2017, 23(5): 931-4. |
| [24] | Delire B, Stärkel P. The Ras/MAPK pathway and hepatocarcinoma: pathogenesis and therapeutic implications[J]. Eur J Clin Invest, 2015, 45(6): 609-23. DOI: 10.1111/eci.2015.45.issue-6. |
| [25] | Feng YM, Feng CW, Chen SY, et al. Cyproheptadine, an antihistaminic drug, inhibits proliferation of hepatocellular carcinoma cells by blocking cell cycle progression through the activation of P38 MAP kinase[J]. BMC Cancer, 2015, 15: 134. DOI: 10.1186/s12885-015-1137-9. |
| [26] | Wang C, Cigliano A, Delogu S, et al. Functional crosstalk between AKT/mTOR and Ras/MAPK pathways in hepatocarcinogenesis: implications for the treatment of human liver cancer[J]. Cell Cycle, 2013, 12(13): 1999-2010. DOI: 10.4161/cc.25099. |
| [27] | Roberts PJ, Der CJ. Targeting the Raf-MEK-ERK mitogen activated protein kinase cascade for the treatment of cancer[J]. Oncogene, 2007, 26(22): 3291-310. DOI: 10.1038/sj.onc.1210422. |
| [28] | 次旦旺久, 林坤, 卢再鸣, 等. MAPK信号通路在肝癌发生发展及治疗中的作用[J]. 临床肝胆病杂志, 2016, 32(9): 1810-3. |
| [29] | 李会宣, 杨虹, 张红兵, 等. 姜黄素通过MAPK信号通路诱导人肝癌SMMC-7721细胞凋亡[J]. 天然产物研究与开发, 2014, 26: 329-34. |
 2017, Vol. 37
2017, Vol. 37

