高盐摄入是高血压发病重要的危险因素之一,同时也造成心血管病发病与死亡风险增加[1-3]。适度抑制钠欲以降低钠盐摄入量有望成为最有效的限盐策略,为此,研究钠欲的神经调控机制具有重要的现实意义和临床意义。
杏仁中央核与传递味觉和内脏信息的脑干核团之间存在双向的纤维联系,还与前脑奖赏神经环路、室周器官存在密切的联系。由于有这些确切的形态学基础,使杏仁中央核在体钠稳态的调控中扮演着重要的角色。研究表明,中枢阿片能机制在钠欲调控中发挥着重要作用[4-5],如激活臂旁外侧核μ-阿片受体(OR)促使脱钠大鼠对高钠盐的摄入增加[6-7]。研究发现,杏仁中央核神经元上存在μ-ORs,杏仁中央核的内在神经元和轴突末梢含有阿片肽[8-9];通过原位杂交(脑啡肽和μ-OR mRNA)结合免疫组织化学(FOS),Grondin等发现血容量不足引起Fos蛋白在杏仁中央核中的脑啡肽能神经元上和在杏仁中央核中表达μ-ORs的神经元上表达[10]。新近的研究发现中枢内源性阿片肽通过μ-ORs强烈促进小鼠钠欲的表达,而且在动物缺钠期间,杏仁中央核、孤束核、臂旁外侧核的Fos阳性神经元数目显著增多[11]。以上研究表明,杏仁中央核中的脑啡肽/μ-OR系统极可能参与对钠欲的中枢调控。
本研究运用精细的大脑插管术和脑内核团微量注射法,通过观察双侧杏仁中央核内单独注射或联合注射选择性μ-OR激动剂[D-Ala2, N-Me-Phe4, Gly5-ol]-enkephalin(DAMGO)和高选择性μ-OR拮抗剂D-Phe-Cys-Trp-Arg-Thr-Pen-Thr-NH2(CTAP)对不同摄钠模型大鼠0.3 mol/L NaCl溶液和水摄入的影响,深入探讨了杏仁中央核参与钠欲中枢调控的阿片能机制。
1 材料和方法 1.1 实验动物本研究中所用的健康成年雄性SD大鼠,初始体质量为250±20 g,由西安交通大学医学院实验动物中心提供。在室温维持在23±2 ℃、湿度为(55±10)%和光暗周期为12: 12 h(7: 00~19: 00) 的房间里,大鼠单独在代谢笼里随意进食颗粒状的实验室啮齿类动物食物、蒸馏水和0.3 mol/L NaCl溶液以确保大鼠饱食、体内水、钠正常。代谢笼是摄食-摄水-活动度分析仪(型号41800111213,UGO,意大利)上的一个组件,每台摄食-摄水-活动度分析仪上各安装有一个代谢笼。蒸馏水和0.3 mol/L NaCl溶液分别装在配有金属饮水嘴的带有0.1 mL刻度的透明塑料瓶中。当大鼠体质量增至290± 20 g时即可作为实验对象。
1.2 药品与试剂选择性μ-OR激动剂DAMGO、高选择性μ-OR拮抗剂CTAP、利尿剂呋塞米(FURO)和血管紧张素转换酶抑制剂卡托普利(CAP),均购自Sigma-Aldrich公司。所有的药物都溶解在无菌的生理盐水中。注射到杏仁中央核内的药物DAMGO剂量为1 nmol、2 nmol和4 nmol/0.5 μL,CTAP剂量为0.5 nmol、1 nmol和2 nmol/ 0.5 μL。FURO(10 mg/kg)联合CAP(5 mg/kg)皮下注射给药参照在先前的研究[12-13]中所述。生理盐水和药物都在注射前配制。
1.3 大脑插管腹膜腔内注射10%(质量/容积)水合氯醛(300 mg/ kg)使大鼠麻醉后,将大鼠固定在脑功能立体定位仪上(SN-2N,日本成茂集团),然后进行双侧杏仁中央核套管(不锈钢,23号)植入术。杏仁中央核的立体坐标根据大鼠脑图谱[14]确定,分别为:前囟后2.3 mm,中线缝外侧4.0 mm,颅骨表面下7.0 mm。套管末端放置在杏仁中央核正上方1 mm处。套管用牙科丙烯酸树脂和微小螺钉固定在颅骨上并用充塞器(30号)填充。大脑手术后,让大鼠单独在代谢笼里至少恢复7 d后方可进行实验。
1.4 双侧杏仁中央核内微量注射使用1 μL微量注射器进行双侧杏仁中央核内注射,该微量注射器通过聚乙烯管(PE-10) 与30号注射管相连接。在注射时,除去充塞器,把注射管(比导向套管长1 mm)小心地插入到导向套管中15 s后开始手动注射。注射量为0.5 μL/侧杏仁中央核,注射速度是0.5 μL/min,注射后注射管在注射部位保持不动30s以最大限度地减少回流。注射后充填器被重新放回。
1.5 实验步骤 1.5.1 双侧杏仁中央核内注射DAMGO对“禁水-不完全补水(WD-PR)”摄钠模型大鼠0.3 mol/L NaCl和水摄入的影响(双瓶测试)WD-PR是指先给大鼠禁水,随后让大鼠饮水以补充部分血容量。在本研究中,先让双侧杏仁中央核插管大鼠经受1次WD-PR,即先给大鼠禁水但不禁食(不给水和0.3 mol/L NaCl溶液,但给大鼠颗粒状食物)24 h (实验前1 d 8: 00至实验当天8: 00),然后撤去食物,让大鼠自由饮水2 h,紧接着依次进行双侧杏仁中央核内药物注射和钠欲测试。
1.5.2 双侧杏仁中央核内联合注射DAMGO和CTAP对WD-PR摄钠模型大鼠0.3 mol/L NaCl和水摄入的影响(双瓶测试)步骤同1.5.1。
1.5.3 双侧杏仁中央核内联合注射DAMGO和CTAP对“皮下联合注射呋塞米(FURO)与卡托普利(CAP) (FURO+CAP)”摄钠模型大鼠0.3 mol/L NaCl和水摄入的影响(双瓶测试)FURO+CAP是指给大鼠皮下联合注射利尿剂呋塞米(10 mg/kg)与血管紧张素转换酶抑制剂卡托普利(5 mg/kg)。在本研究中,先让双侧杏仁中央核插管大鼠在实验当天的8: 00经受1次FURO+CAP,即给大鼠皮下联合注射利尿剂呋塞米(10 mg/kg)与血管紧张素转换酶抑制剂卡托普利(5 mg/kg),然后把大鼠送回它们各自的代谢笼里,同时撤去代谢笼中的食物,水和0.3 mol/L NaCl溶液,1 h后即9: 00开始依次进行双侧杏仁中央核内药物注射和钠欲测试。
1.5.4 双侧杏仁中央核内注射DAMGO对WD-PR摄钠模型大鼠和FURO+CAP摄钠模型大鼠水摄入的影响(单瓶测试) 1.6 组织学分析每个实验完成后,给每只大鼠双侧杏仁中央核内各注射0.5 μL的2%的滂胺天蓝溶液。紧接着,经腹膜腔内注射高剂量10%水合氯醛深度麻醉大鼠,依次用生理盐水和10%福尔马林经心脏-主动脉进行灌流。灌流结束后立即取出大鼠大脑并依次在10%福尔马林溶液中固定、在冰冻切片机上切成40 μm厚度的连续冠状切片和在光学显微镜下参照Paxinos和Watson所著的大鼠脑图谱[14]分析确认注射部位(杏仁中央核)。
1.7 统计学分析使用SPSS13.0进行统计分析,数据以平均值±标准误表示。通过适当的重复测量方差分析(即单向或双向)对处理和时间的主效应及其交互效应进行分析,进一步的多重比较采用SNK-q检验。P < 0.05时认为差异有统计学意义。
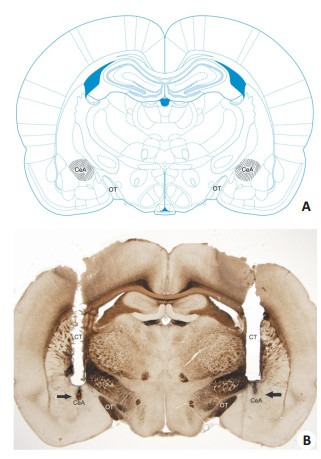
2 结果 2.1 组织学分析图 1A是根据Paxinos和Watson所著的大鼠脑图谱[14]绘制的表示杏仁中央核位置的冠状切片示意图,图 1B是一张具有代表性的杏仁中央核内注射的显微照片。
|
图 1 注射到杏仁中央核内的冠状切片示意图及显微照片 Figure 1 Diagram based on the Paxinos and Watson Atlas[14] showing a coronal section of the areas reached by the injections within (hachured area) the central nucleus of amygdala (CeA) (A) and a representative photomicrograph showing the sites of injections into the CeA (arrows in B). OT: Optic tract; CT: Cannula tract; Magnification: ×1.25. |
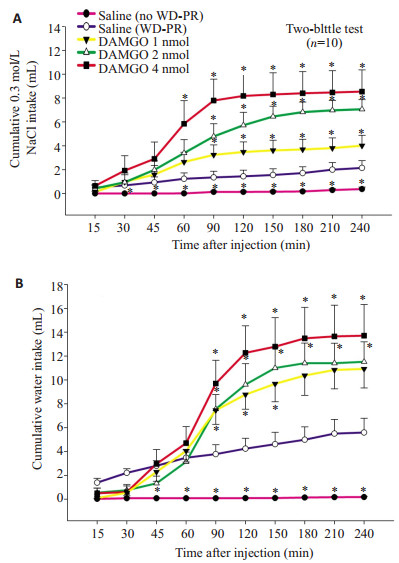
WD-PR摄钠模型大鼠双侧杏仁中央核内注射不同剂量的DAMGO引起0.3 mol/L NaCl摄入量和水摄入量都呈剂量相关性增长,双向重复测量方差分析显示出显著的处理效应(P < 0.05) 和处理与时间之间的交互效应(P < 0.05,图 2)。正如预期的那样,WD-PR摄钠模型大鼠在双侧杏仁中央核内注射生理盐水后比未经受WD-PR(no WD-PR)大鼠在杏仁中央核内注射生理盐水后摄入更多的0.3 mol/L NaCl (P < 0.05) 和水(P < 0.05)。
|
图 2 WD-PR摄钠模型大鼠双侧杏仁中央核内注射生理盐水或不同剂量的DAMGO后(A)累积的0.3 mol/L NaCl摄入量和(B)累积的水摄入量(双瓶测试) Figure 2 Cumulative 0.3 mol/L NaCl (A) and water (B) intake by WD-PR-treated rats receiving bilateral injections of saline or different doses of DAMGO into the CeA (two-bottle test). *P < 0.05 compared to saline (WD-PR). |
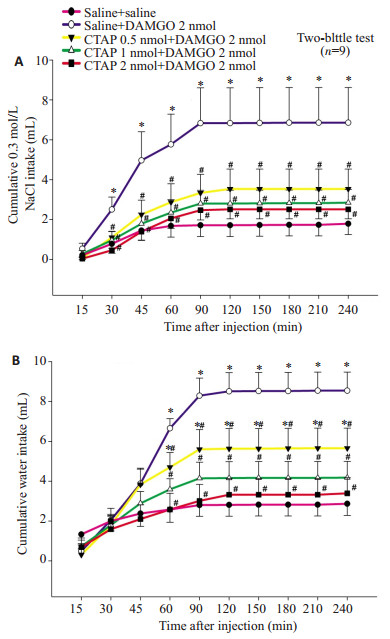
WD-PR摄钠模型大鼠双侧杏仁中央核内预先注射的CTAP以剂量依赖性的方式显著抑制DAMGO 2 nmol注射到同一部位所引起的从注射后30 min开始直到测试结束时的0.3 mol/L NaCl的累积摄入量和从注射后60 min开始直到测试结束时水的累积摄入量。双向重复测量方差分析显示出显著的处理效应(P < 0.05)、时间效应(P < 0.05) 和处理与时间之间的交互效应(P < 0.05,图 3)。
|
图 3 WD-PR摄钠模型大鼠双侧杏仁中央核内联合注射saline、DAMGO 2 nmol和CTAP 0.5,1 and 2 nmol后(A)累积的0.3 mol/L NaCl摄入量和(B)累积的水摄入量(双瓶测试) Figure 3 Cumulative 0.3 mol/L NaCl (A) and water (B) intake by WD-PR-treated rats receiving bilateral injections of different combinations of saline, DAMGO and CTAP into the CeA (two-bottle test). *P < 0.05 compared to saline + saline. #P < 0.05 compared to saline+DAMGO 2 nmol. |
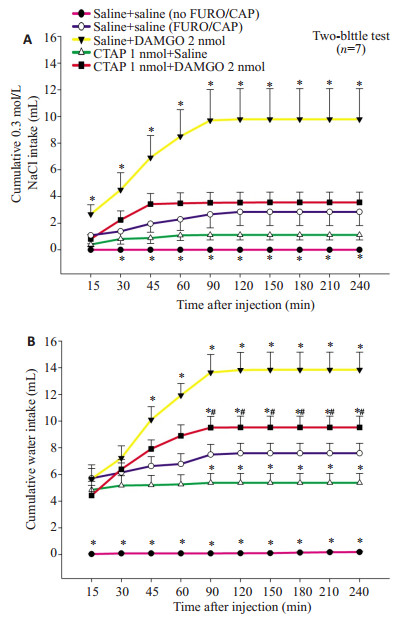
双向重复测量方差分析显示出显著的处理效应(P < 0.05)、时间效应(P < 0.05) 和处理与时间之间的交互效应(P < 0.05)。正如预期的那样,FURO+CAP摄钠模型大鼠在双侧杏仁中央核内注射生理盐水后比皮下注射生理盐水代替FURO+CAP(no FURO+CAP)大鼠在双侧杏仁中央核内注射生理盐水后摄入更多的0.3 mol/L NaCl(P < 0.05)。双侧杏仁中央核内预先注射CTAP 1 nmol显著抑制DAMGO 2 nmol注射到同一部位引起的0.3 mol/L NaCl摄入量和水摄入量的增加。虽然杏仁中央核内CTAP单独给药(CTAP 1 nmol+Saline)显示出减少0.3 mol/L NaCl摄入量,但是这一趋势并没有达到统计学意义,然而却显著地减少伴随0.3 mol/L NaCl摄入的摄水量和总的液体摄入量(0.3 mol/L NaCl+水,P < 0.05,图 4)。
|
图 4 FURO+CAP摄钠模型大鼠双侧杏仁中央核内联合注射saline、DAMGO 2 nmol和CTAP 1 nmol后(A)累积的0.3 mol/L NaCl摄入量和(B)累积的水摄入量(双瓶测试) Figure 4 Cumulative 0.3 mol/L NaCl (A) and water (B) intake by FURO + CAP-treated rats receiving bilateral injections of different combinations of saline, DAMGO (2 nmol) and CTAP (1 nmol) into the CeA (two-bottle test). *P < 0.05 compared to saline+ saline (FURO+CAP). #P < 0.05 compared to saline + DAMGO 2 nmol. |
当只饮水时,WD-PR摄钠模型大鼠双侧杏仁中央核内注射DAMGO 2 nmol对水摄入量没有影响(P > 0.05,图 5A)。当只饮水时,FURO+CAP摄钠模型大鼠双侧杏仁中央核内注射DAMGO 2 nmol对水摄入量没有影响(P > 0.05,图 5B)。
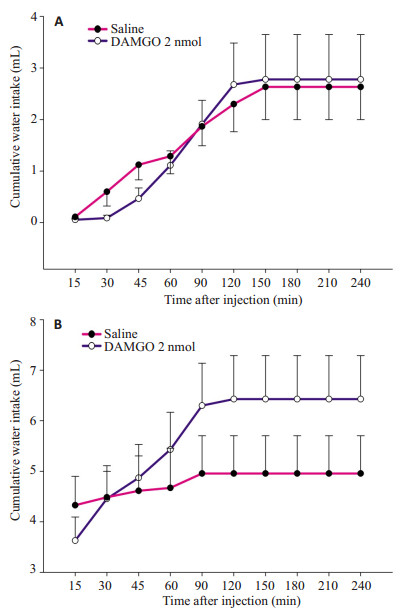
|
图 5 WD-PR摄钠模型大鼠(A)和FURO+CAP摄钠模型大鼠(B)双侧杏仁中央核注射saline或DAMGO 2 nmol后当只饮水时的累积水摄入量(单瓶测试) Figure 5 Cumulative water intake by WD-PR-treated rats (A) and by FURO+CAP-treated rats (B) with bilateral injections of saline or DAMGO (2 nmol) into the CeA when they had access only to water in one-bottle test. |
本研究结果显示,在WD-PR摄钠模型大鼠,双侧杏仁中央核内注射选择性μ-OR激动剂DAMGO引起0.3 mol/L NaCl和水摄入量呈剂量相关性增加,而双侧杏仁中央核内预先注射高选择性μ-OR拮抗剂CTAP以剂量依赖性的方式显著抑制DAMGO注射到同一部位所引起的0.3 mol/L NaCl和水摄入量的增加;在FURO+CAP摄钠模型大鼠,双侧杏仁中央核内注射选入量增加,而双侧杏仁中央核内预先注射高选择性μ-OR拮抗剂CTAP抑制了DAMGO注射到同一部位所引起的0.3 mol/L NaCl和水摄入量增加的效应。在本研究中,在WD-PR和FURO+CAP摄钠模型大鼠,如果同时给0.3 mol/L NaCl和水(双瓶测试),双侧杏仁中央核内注射选择性μ-OR激动剂DAMGO都引起0.3 mol/L NaCl和水摄入量明显增加,然而,在只给水时,双侧杏仁中央核内注射DAMGO都对水摄入量没有影响(单瓶测试),这表明在双瓶测试中水的摄入可能是由于高渗NaCl的过量摄入引起血浆渗透压增大的结果。选择性μ-OR激动剂DAMGO对μ-ORs有很高的亲和力,它结合μ-ORs的选择性至少是结合κ-和δ-ORs的1000倍;高选择性μ-OR拮抗剂CTAP阻断μ-ORs的效力是非选择性OR拮抗剂纳洛酮的10倍,与μ-ORs的亲和力比δ-ORs高达1000倍,对κ-ORs的亲合力也很弱。综上所述,本研究结果表明了杏仁中央核μ-ORs兴奋性介导钠盐摄入。
已经证实WD-PR方案能诱导钠欲[15],Pereira等[16]也发现WD-PR能显著增强大鼠杏仁中央核中的c-Fos免疫反应性。在WD-PR方案中,首先让禁水大鼠饮水直到它的渴感得以解除,紧接着给大鼠高渗NaCl溶液进行钠欲测试,在此种情况下,高渗NaCl的摄入能被认为是钠欲的表达,因为它是负钠平衡和持久性低血容量的结果[16-17]。不同的研究表明FURO+CAP方案也能诱导钠欲,这可能是由于FURO+CAP能增加中枢中ANGⅡ水平的结果[12-13]。
上传到孤束核的内脏和味觉的信息,在臂旁核进行第二次中继之前投射到杏仁中央核,从而形成了调控味觉和钠欲的一个主要的神经轴[18-19],这种特定的通路可能是解释杏仁中央核调控钠盐摄入的神经解剖学上的环路之一[18]。臂旁外侧核在钠盐摄入调控中主要起抑制性作用[20-21]。在调控钠欲中杏仁中央核和臂旁外侧核是密切联系的,钝化臂旁外侧核抑制机制引起钠盐摄入增加似乎完全依赖于杏仁中央核对钠欲调控的易化作用[22]。杏仁中央核神经元上存在μ-ORs并且杏仁中央核的内在神经元和轴突末梢含有阿片肽[8-9];杏仁中央核大多数神经元可被μ-OR激动剂所抑制[9, 23-24];杏仁中央核神经元及其传出纤维主要是GABA能[23, 25],这表明杏仁中央核绝大多数神经元是GABA能神经元,至少它们中的一些发出GABA能传出纤维[26];杏仁中央核与臂旁外侧核之间存在着GABA能纤维联系[27]。因此,基于既往的研究结果,我们推测本研究中杏仁中央核中μ-ORs的激活所引起的促钠欲作用的机制之一,可能是杏仁中央核中的内源性释放的阿片肽通过激活μ-ORs而抑制杏仁中央核中的GABA能投射神经元,继而减少其对投射靶部位如臂旁外侧核的抑制作用,这种去抑制作用钝化了臂旁外侧核调控钠欲的抑制性机制从而促进钠欲增强,摄入高渗NaCl的量增多。新近的研究[28]报道杏仁中央核中的阿片能机制参与对钠欲的调节,这与我们的实验结果是一致的,而且该研究还证实当臂旁外侧核抑制机制失活或减弱时,杏仁中央核中的阿片能机制对于高渗氯化钠的摄入是必不可少的。
总之,本研究的结果证实了激活杏仁中央核μ-ORs使WD-PR和FURO-CAP摄钠模型大鼠对高渗钠盐的摄入增加,反之,阻断杏仁中央核μ-ORs则使高渗钠盐摄入减少。这些神经药理学数据表明了杏仁中央核μ-ORs参与对钠欲的调节,μ-ORs阻断剂有望成为研发钠欲抑制剂的靶标。
| [1] | Mozaffarian D, Fahimi S, Singh GM, et al. Global sodium consumption and death from cardiovascular causes[J]. N Engl J Med, 2014, 371(7): 624-34. DOI: 10.1056/NEJMoa1304127. |
| [2] | He FJ, Macgregor GA. Effect of longer-term modest salt reduction on blood pressure[J]. Cochrane Database Syst Rev, 2013(4): CD004937. |
| [3] | Graudal NA, Hubeck-Graudal T, Jurgens G. Effects of low sodium diet versus high sodium diet on blood pressure, renin, aldosterone, catecholamines, cholesterol, and triglyceride[J]. Cochrane Database Syst Rev, 2017(4): CD004022. |
| [4] | Nascimento A, Ferreira HS, Saraiva RM, et al. Central kappa-opioid receptors modulate salt appetite in rats[J]. Physiol Behav, 2012, 106(4): 506-14. DOI: 10.1016/j.physbeh.2012.03.028. |
| [5] | Nascimento A, Ferreira HS, Cerqueira D. Blockade of central delta-opioid receptors inhibits salt appetite in sodium-depleted rats[J]. Peptides, 2014, 55: 110-9. DOI: 10.1016/j.peptides.2014.02.012. |
| [6] | Andrade CA, De Oliveira LB, Andrade-Franzé GM, et al. Gabaergic and opioid receptors mediate the facilitation of NaCl intake induced by α2-adrenergic activation in the lateral parabrachial nucleus[J]. Behav Brain Res, 2015, 278: 535-41. DOI: 10.1016/j.bbr.2014.10.007. |
| [7] | Pavan CG, Roncari CF, Barbosa SP, et al. Activation of μ opioid receptors in the LPBN facilitates sodium intake in rats[J]. Behav Brain Res, 2015, 288: 20-5. DOI: 10.1016/j.bbr.2015.03.047. |
| [8] | Poulin JF, Chevalier B, Laforest S, et al. Enkephalinergic afferents of the centromedial amygdala in the rat[J]. J Comp Neurol, 2006, 496(6): 859-76. DOI: 10.1002/(ISSN)1096-9861. |
| [9] | Glass MJ, Vanyo L, Quimson L, et al. Ultrastructural relationship between N-methyl-D-aspartate-NR1 receptor subunit and mu-opioid receptor in the mouse central nucleus of the amygdala[J]. Neuroscience, 2009, 163(3): 857-67. DOI: 10.1016/j.neuroscience.2009.07.020. |
| [10] | Grondin ME, Gobeil-SimardA, Drolet G, et al. Na+ appetite induced by depleting extracellular fluid volume activates the enkephalin/ mu-opioid receptor system in the rat forebrain[J]. Neuroscience, 2011, 192: 398-412. DOI: 10.1016/j.neuroscience.2011.06.054. |
| [11] | Smith CM, Walker LL, Leeboonngam T, et al. Endogenous central amygdala mu-opioid receptor signaling promotes sodium appetite inmice[J]. ProcNatlAcadSciUSA, 2016, 113(48): 13893-8. DOI: 10.1073/pnas.1616664113. |
| [12] | Pereira DT, Menani JV, De Luca LA Jr. FURO/CAP: a protocol for sodium intake sensitization[J]. Physiol Behav, 2010, 99(4): 472-81. DOI: 10.1016/j.physbeh.2009.12.009. |
| [13] | Da Silva CZ, Menani JV, Callera JC. AT1 receptor blockade in the lateral parabrachial nucleus reduces the effects of muscimol on sodium intake[J]. Brain Res, 2011, 1403: 28-36. DOI: 10.1016/j.brainres.2011.06.004. |
| [14] | Paxinos G, Watson C. The rat brain in stereotaxic coordinates[M]. 2007. |
| [15] | De Luca LA, Xu Z, Schoorlemmer GH, et al. Water deprivation-induced sodium appetite: humoral and cardiovascular mediators and immediate early genes[J]. Am J Physiol Regul Integr Comp Physiol, 2002, 282(2): R552-9. DOI: 10.1152/ajpregu.00295.2000. |
| [16] | Pereira-Derderian DT, Vendramini RC, Menani JV, et al. Water deprivation-induced sodium appetite and differential expression of encephalic c-Fos immunoreactivity in the spontaneously hypertensive rat[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(5): R1298-309. DOI: 10.1152/ajpregu.00359.2009. |
| [17] | Johnson AK. The sensory psychobiology of thirst and sodium appetite[J]. Med Sci Sports Exerc, 2007, 39(8): 1388-400. DOI: 10.1249/mss.0b013e3180686de8. |
| [18] | Geerling JC, Loewy AD. Aldosterone-sensitive neurons in the nucleus of the solitary tract: bidirectional connections with the central nucleus of the amygdala[J]. J Comp Neurol, 2006, 497(4): 646-57. DOI: 10.1002/(ISSN)1096-9861. |
| [19] | Norgren R, Hajnal A, Mungarndee SS. Gustatory reward and the nucleus accumbens[J]. Physiol Behav, 2006, 89(4): 531-5. DOI: 10.1016/j.physbeh.2006.05.024. |
| [20] | Callera JC, Oliveira LB, Barbosa SP, et al. GABA(A) receptor activation in the lateral parabrachial nucleus induces water and hypertonic NaCl intake[J]. Neuroscience, 2005, 134(3): 725-35. DOI: 10.1016/j.neuroscience.2005.05.009. |
| [21] | Gasparini S, Melo MR, Leite GF, et al. Rapid stimulation of sodium intake combining aldosterone into the 4th ventricle and the blockade of the lateral parabrachial nucleus[J]. Neuroscience, 2017, 346: 94-101. DOI: 10.1016/j.neuroscience.2017.01.005. |
| [22] | Andrade-Franzé GM, Andrade CA, De Luca LA, et al. Lateral parabrachial nucleus and central amygdala in the control of sodium intake[J]. Neuroscience, 2010, 165(3): 633-41. DOI: 10.1016/j.neuroscience.2009.11.011. |
| [23] | Zhu W, Pan ZZ. Synaptic properties and postsynaptic opioid effects in rat central amygdala neurons[J]. Neuroscience, 2004, 127(4): 871-9. DOI: 10.1016/j.neuroscience.2004.05.043. |
| [24] | Chieng BC, Christie MJ, Osborne PB. Characterization of neurons in the rat central nucleus of the amygdala: cellular physiology, morphology, and opioid sensitivity[J]. J Comp Neurol, 2006, 497(6): 910-27. DOI: 10.1002/(ISSN)1096-9861. |
| [25] | Sah P, Faber ES, Lopez De Armentia M, et al. The amygdaloid complex: anatomy and physiology[J]. Physiol Rev, 2003, 83(3): 803-34. DOI: 10.1152/physrev.00002.2003. |
| [26] | Baxter MG, Murray EA. The amygdala and reward[J]. Nat Rev Neurosci, 2002, 3(7): 563-73. DOI: 10.1038/nrn875. |
| [27] | Jia HG, Zhang GY, Wan Q. A GABAergic projection from the central nucleus of the amygdala to the parabrachial nucleus: an ultrastructural study of anterograde tracing in combination with post-embedding immunocytochemistry in the rat[J]. Neurosci Lett, 2005, 382(1/2): 153-7. |
| [28] | Andrade-Franzé GM, Gasparini S, De Luca LA Jr, et al. Lateral parabrachial nucleus and opioid mechanisms of the central nucleus of the amygdala in the control of sodium intake[J]. Behav Brain Res, 2017, 316: 11-7. DOI: 10.1016/j.bbr.2016.08.035. |
 2017, Vol. 37
2017, Vol. 37

