2. 广州医科大学第六医院神经外科,广东 广州 511500;
3. 南方医科大学南方医院 临床医学教育中心,广东 广州 510515;
4. 中山大学孙逸仙纪念医院神经外科,广东 广州 510000;
5. 南方医科大学第五附属医院神经外科,广东 广州 510900
2. Department of Neurosurgery, Sixth Affiliated Hospital, Guangzhou Medical University, Guangzhou 511500, China;
3. Nanfang Glioma Center, Center for Clinical Medical Education, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
4. Department of Neurosurgery, Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510000, China;
5. Department of Neurosurgery, Fifth Affiliated Hospital, Southern Medical University, Guangzhou 510900, China
胶质母细胞瘤(GBM)是中枢神经最常见的原发恶性肿瘤,约占成人原发颅内恶性肿瘤的65%。GBM具有非常高的复发率和致死性[1-2]。无论是目前普遍采用的包括最大范围手术切除、替莫唑胺(TMZ)化疗和放疗在内的STUPP综合治疗方案还是贝伐单抗均只能延长患者几个月的中位生存期[3]。TMZ是针对GBM的一线化疗药物,是一种DNA烷化剂,可以通过血脑屏障。通常认为细胞凋亡是TMZ导致细胞毒性的主要机制[4-6]。TMZ导致细胞双链DNA断裂,通过其对O6-甲基鸟嘌呤的细胞毒性作用诱导细胞周期G2/M期阻滞[7-8],从而导致其发生凋亡。研究表明O6-甲基鸟嘌呤-DNA-甲基转移酶(MGMT)可以修复TMZ导致的DNA损伤,可能导致肿瘤的TMZ药物抵抗[9-10]。除此之外,目前仍然比较少文献可以阐明GBM的TMZ药物抵抗的具体分子机制[10-18]。
有文献报道,GBM在经过TMZ治疗后发生应激反应,细胞骨架重排,细胞的形态发生变化[19-25]。肿瘤的发生发展的病理生理过程与不少细胞骨架相关蛋白相关,其中一些蛋白已经被证实在TMZ治疗GBM后表达上调[20-21, 25-28]。微管微丝交连因子1(MACF1),也被称作ACF7,是血影斑蛋白家族中一个608 000的蛋白,可以介导微管沿微丝应力纤维定向组装,调节细胞受到胞外信号刺激后发生的细胞骨架重排[29-30]。在我们的前期研究中,我们通过蛋白质组学分析发现GBM经过TMZ刺激后其MACF1表达水平上调[31]。而关于MACF1在GBM中的研究极少,其在TMZ刺激GBM细胞导致细胞毒性中的作用仍没有相关文献报道。因此,在本研究中我们试图研究MACF1在胶质母细胞瘤应对TMZ刺激中的作用。
1 材料和方法 1.1 细胞培养与试剂人类胶质母细胞瘤细胞系U87(ATCC No. HTB-14TM)购自美国ATCC细胞库(ATCC, Manassas, VA),在含10%胎牛血清(Gibco,美国)、青霉素100 U/mL及链霉素100 mg/mL(Gibco,美国)的改良Eagle培养基(DMEM,含糖4.5 g/L,Gibco,美国)的培养基中,37 ℃,5% CO2的培养箱中培养。
TMZ购自美国Sigma(Sigma-Aldrich, St. Louis, MO, USA),在DMSO(Sigma-Aldrich)中溶解。体外培养加入培养基中的TMZ的最终浓度为200 μmol/L。U87细胞培养基中加入TMZ持续刺激2周。体内成瘤实验中TMZ溶解于生理盐水,最终浓度为0.5 mg/mL。anti-MACF1兔抗购自美国ABcam,#ab117418;β-actin兔抗购自美国Santa Cruz;HRP-羊抗兔二抗购自美国CST,#7074;anti-actin兔抗购自美国CST,#8480;anti-actin鼠抗购自美国CST,#3700;anti-tubulin鼠抗购自美国CST,#3873;荧光二抗羊抗兔IgM-FITC购自美国Life,#F-2765;荧光二抗兔抗鼠IgM-Dylight550购自美国Life,#SA5-10159。0.25%胰酶-EDTA购自美国Gibco,#25200-056;台盼蓝购自美国Sigma-Aldrich,#T8154。
1.2 Western blot用添加蛋白酶抑制剂(Sigma-Aldrich, 美国)的RIPA裂解液(购自碧云天)冰上裂解U87细胞。BCA法(Sigma-Aldrich, 美国)检测蛋白浓度。40 µg待测蛋白在10%的聚丙烯酰胺SDS-PAGE进行电泳分离,电泳条件为浓缩胶90 V 30 min、分离胶120 V 1 h,然后在250 V条件下湿转膜(Millipore, 美国)1.5 h,5% BSA溶解于含0.1% Tween 20的Tris缓冲盐溶液(TBST)中室温封闭膜1 h,一抗(1: 500稀释)4 ℃孵育过夜,TBST洗膜,HRP-羊抗兔二抗(1: 2000稀释)室温1 h,洗膜,ECL显影。用Quantity One 4.6.2软件(美国Bio-Rad公司)进行条带的灰度分析。
1.3 实时荧光定量PCR(Quantitative Real-time)采用Troil法提取U87细胞的总RNA,逆转录得到cDNA,进行RT-PCR(罗氏L480实时荧光定量PCR仪,瑞士Roche)。引物序列如下:MACF1 mRNA的正向引物为:5'-TTCCTAAAGCAGCGACAGGT-3',反向引物为:5'-CACTCCAGCAGGAGGAAAAG-3';GAPDH mRNA正向引物为:5'-ATCATCAGCAATGCCTCCT G-3',反向引物为:5'-ATGGACTGTGGTCATGAGT C-3'。引物由上海英潍捷基生物技术有限公司设计与合成。PCR反应条件为95 ℃ 5 min,随后95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s重复35个循环。采用2-ΔΔCT法分析目的基因的相对表达量。各组均设置3个复孔,实验重复3次。
1.4 裸鼠皮下成瘤小鼠成瘤模型在南方医科大学实验动物中心批准下进行。U87细胞计数1×106个细胞/mL皮下注射到12只裸鼠(BALB/c-nu,4~6周龄,购自南方医科大学实验动物中心,NO.44007200030884)的左侧腹股沟。成瘤后其中6只腹腔注射TMZ(0.25 mg/mL,溶于0.8% DMSO,每只20 mg/kg),1/d连续注射1周,另取6只腹腔注射等量DMSO作为正常对照组。连续给药1周后将所有裸鼠处死,切除肿瘤,分离肿瘤中心部位和周边部位。
1.5 免疫组化常规脱蜡,梯度乙醇水化处理,磷酸盐缓冲液(PBS)漂洗5 min×3次,3% H2O2去离子水孵育10 min,枸橼酸钠缓冲液(pH6.0)高压修复,自然冷却,一抗4 ℃孵育过夜(PBS液取代一抗作阴性对照);去除一抗后,PBS漂洗5 min×3次,滴加二抗,37 ℃孵育30 min,PBS漂洗5 min×3次,滴加DAB显色剂,室温下显色,镜下控制显色时间,蒸馏水洗涤终止反应,苏木素复染、脱水、透明、中性树脂封片,显微镜下观察,拍照。免疫组织化学方法结果判断:由2位经验丰富的病理医师进行双盲阅片。MACF1阳性表达为细胞胞膜和(或)胞浆上呈现棕黄色颗粒;采用半定量结果判断,分别对镜下阳性细胞的百分比和染色强度给予评分。阳性染色细胞数:每张切片上观察5个高倍视野(×200),计数阳性细胞百分比,阳性细胞数 < 5%为0分,5~25%为1分,26~50%为2分,51~75%为3分,76~100%为4分。阳性染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者计分相乘即为阳性等级:0分为阴性(-),1-4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.6 免疫荧光U87细胞计数1×105个细胞/mL铺到35 mm的共聚焦皿(Corning,美国),然后用TMZ(200 μmol/L)持续刺激1周或2周。PBS漂洗5 min×2次,室温下4%多聚甲醛固定,0.2% Triton X-100细胞膜通透处理。5%脱脂奶粉封闭10 min后滴加一抗(anti-MACF1兔抗,1: 200;anti-actin兔抗,1: 50;anti-actin鼠抗,1: 200;anti-tubulin鼠抗,1: 50)4 ℃孵育过夜,漂洗5 min×3次。避光条件下滴加荧光二抗(1: 2000)室温孵育30 min,DAPI染色。共聚焦激光扫描显微镜(日本Nikon公司)暗室下观察。
1.7 siRNA转染靶向MACF1基因的特异性si-RNA序列为:MACF1-#1:5'-CUCGAUGGAAUACAUUGAAUAT T-3',MACF1-#2:5'-AGGAUGCGUAUCGACCAAC AATT-3',阴性对照:5'-UUCUCCGAACGUGUCAC GUTT-3('上海吉玛公司)[32]。合成的siRNA粉末溶解在RNase Free dH2O中,配制成20 mmol/L储存液分装保存,按照转染试剂说明书进行转染)。转染前1 d,将U87细胞传代于6孔板中培养,细胞密度应能在24 h内使细胞汇合达到70%~90%。按Lipofectamine2000 Reagent说明书进行转染。转染后6~8 h更换含血清的完全培养液培养。
1.8 细胞计数0.25%胰酶-EDTA消化细胞,台盼蓝染色,滴加15 μL细胞混悬液于血球计数板上,显微镜下计数,死细胞染成蓝色,活细胞不染色。
1.9 统计学方法各组实验数据以均数±标准差表示,统计处理采用SPSS 20.0和Graph pad 6.0软件进行分析,当方差齐性时使用One-way ANOVAs分析组间差异,LSD比较两组均数差异;当方差不齐时使用Welch分析组间差异,Dunnett's T3比较两组均数差异。P < 0.05为差异有统计学意义。
2 结果 2.1 体外培养下TMZ刺激U87细胞MACF1表达上调体外培养条件下U87细胞用TMZ(200 μmol/L)分别持续刺激1周或2周后通过RT-PCR检测MACF1的mRNA水平。我们发现无论是加药刺激1周还是2周,TMZ刺激组的MACF1的mRNA水平均明显高于阴性对照组(图 1A,P < 0.01)。通过Western blot检测MACF1的蛋白表达水平发现,TMZ刺激1周及2周的U87细胞的MACF1表达水平均明显高于相应的阴性对照组(图 1B,P < 0.01)。
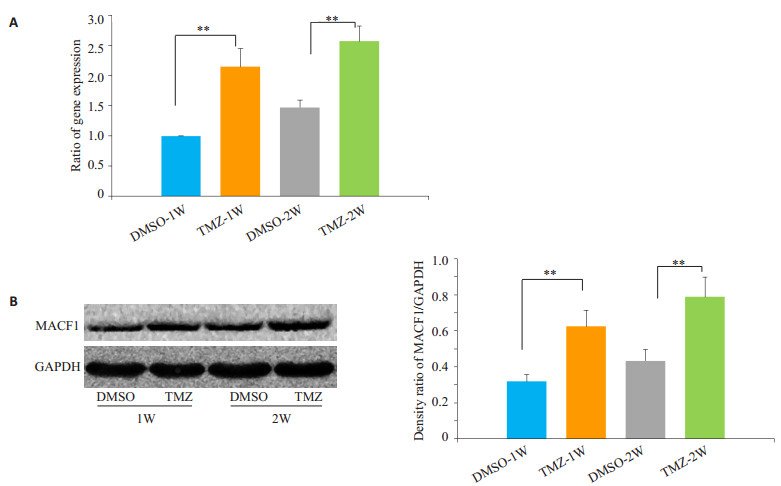
|
图 1 TMZ上调U87细胞的MACF1表达 Figure 1 TMZ increases MACF1 expression in U87 cell lines. A: RT-PCR analysis of MACF1 mRNA levels of cells treated with either DMSO or 200 μmol/L TMZ for 7 or 14 consecutive days; B: Western blotting for measuring the protein levels of MACF. *P < 0.05, **P < 0.01). |
对阴性对照组的裸鼠皮下成瘤后肿瘤组织切片进行免疫组织化学分析,MACF1蛋白分布于细胞质中,而且蛋白表达水平非常低(图 2A,2B)。TMZ刺激组裸鼠肿瘤组织切片中发现MACF1蛋白表达水平明显上调,而且主要分布于细胞核区域(图 2C,2D,P < 0.01)。
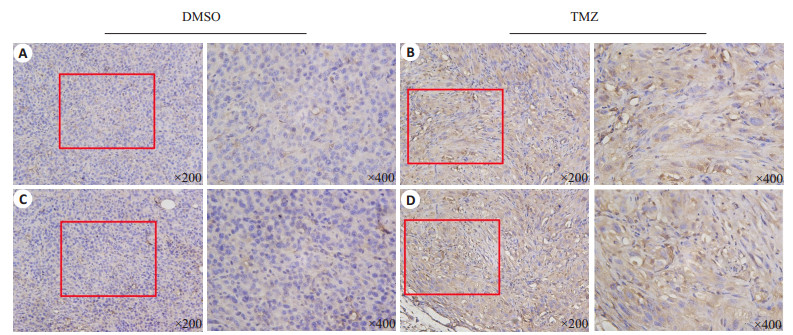
|
图 2 免疫组化分析MACF1在裸鼠成瘤模型TMZ或DMSO刺激2周以后的肿瘤组织中的表达 Figure 2 Immunohistochemistry analysis of MACF1 in tissue from xenograft models treated with TMZ (0.25 mg/mL, 20 mg/kg) or DMSO daily for two weeks. A, B: Expression of MACF1 in the DMSO group; C, D: Expression of MACF1 in the TMZ group. |
通过免疫荧光我们发现,TMZ刺激后U87细胞的肌动蛋白微丝大部分崩解,几乎看不到连续的微丝存在。同时我们观察到其细胞质中的微丝似乎变成了散在的颗粒状(图 3A)。另外,微丝和微管均由细胞质聚合到细胞的边缘,尤其是细胞凸起处,细胞骨架的重排可能导致了细胞质的不连续。MACF1在细胞中与微丝和微管存在共定位的关系(图 3B)。
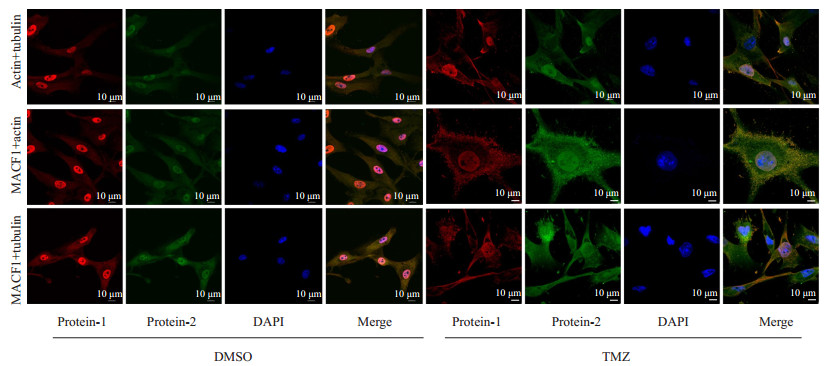
|
图 3 免疫荧光分析TMZ或DMSO持续刺激U87细胞2周后actin,tubulin和MACF1的表达 Figure 3 Immunofluorescence analysis of actin, tubulin, and MACF1 in U87 cells following treatment with TMZ or DMSO for two weeks (Original magnification: ×1200). |
为了进一步研究MACF1与U87细胞的细胞骨架的完整性以及其TMZ化疗敏感性的关系,我们通过两个不同的siRNA干扰序列特异性干扰了U87细胞的MACF1表达。siRNA转染后通过Western Blot验证MACF1的干扰效率(图 4A)。1# siRNA干扰序列将MACF1表达水平下调到大约1/3,而2# siRNA干扰序列将MACF1表达水平下调到大约1/2(P < 0.01)。siRNA转染24 h后的U87细胞用TMZ持续刺激1周,然后观察其细胞活力和细胞形态变化(图 4B)。siRNA-MACF1(1#)干扰序列转染后加TMZ刺激,存活的U87细胞数明显减少(P < 0.01)。在细胞形态上,siRNA-NC转染后加TMZ刺激,U87细胞胞体及胞核变大,几乎所有存活的细胞均从胞体伸出较长的细胞凸起。而siRNA-MACF1转染后加TMZ刺激的U87细胞胞体圆钝,细胞凸起较少且较短。因此,干扰MACF1表达可能增强了U87细胞的TMZ化疗敏感性。
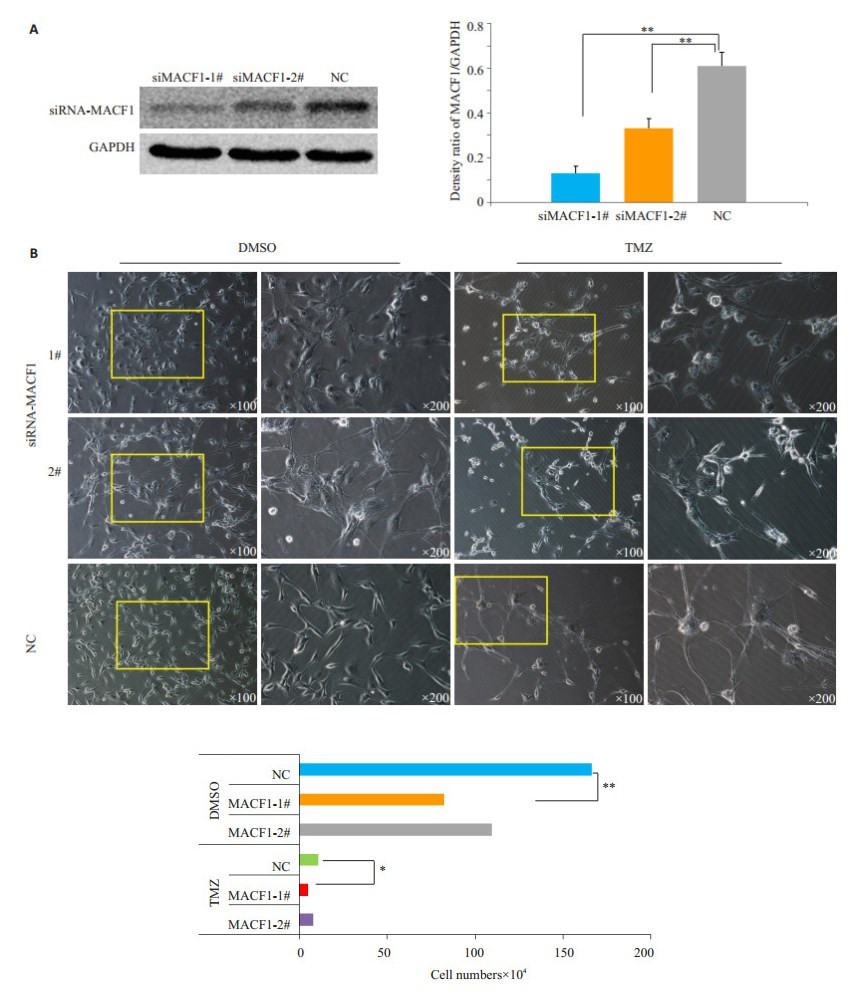
|
图 4 siRNA转染后细胞的MACF1干扰效率(A)和转染后加TMZ或DMSO刺激1周后细胞活力和形态变化(B) Figure 4 Western blotting for MACF1 expression in cells transfected with two different siRNAs (A) and cell viability and morphological changes of transfected cells treated TMZ or DMSO for one week (B). *P < 0.05, **P < 0.01. |
在本研究中我们证实TMZ可以促进GBM细胞的MACF1表达,而且可能通过MACF1在细胞骨架重排中的作用导致GBM细胞的TMZ化疗抵抗。
细胞骨架在一些细胞进程中发挥重要作用,是多种肿瘤治疗的靶点[33-34]。有文献报道,TMZ可以导致GBM细胞的细胞骨架重排,细胞形态发生变化[21]。我们的实验表明,TMZ持续刺激2周后,存活的GBM细胞伸出瘦长的细胞凸起,说明TMZ诱导GBM细胞发生了细胞骨架的重排。我们推测这一细胞骨架的重排可能导致GBM细胞的TMZ化疗抵抗。我们通过干扰MACF1影响细胞骨架的重排增强了GBM细胞的TMZ药物敏感性也在一定程度上支持这一假设。
MACF1广泛存在于脑、骨骼肌、皮肤、心肌等组织[32],并且在微管的形成中其重要作用。MACF1是F-肌动蛋白结合蛋白,并与微管蛋白等其它细胞骨架蛋白相结合。特异性敲除MACF1后,迁移中的细胞的微管由笔直放射状从核周向细胞边缘分布变成弯曲、卷曲状[29, 32]。在乳腺癌中,微管被捕获并稳定于细胞边缘促进微管形成细胞凸起的细胞骨架,并促进细胞迁移,这一过程需要ErbB2募集MACF1到细胞膜上[35]。而我们的实验结果表明,特异性干扰MACF1表达后,TMZ刺激诱导的GBM细胞形成的瘦长的细胞凸起消失。另外也有文献报道MACF1与伤口愈合及细胞迁移相关。伤口愈合前沿的细胞的迁移能力的上调需要MACF1的表达,这可能与它在毛囊干细胞中被证实的介导微管的动态变化和极化的功能相关[29, 36]。因此,MACF1可能与GBM细胞的迁移能力变化相关。
MACF1在Wnt受体信号通路中起着正调节蛋白的作用。它与Axin1蛋白及其相关的复合体(由APC、CTNNB1和GSK3β构成)从细胞质易位到细胞膜的过程相关[37]。MACF1参与肌动蛋白调节的ATP酶活性,并借此在黏附斑的形成和动态变化中起重要作用[30]。另外,MACF1可能通过其与GOLGA4蛋白的相互作用,在包含有糖基磷脂酰肌醇(GPI)相关蛋白的囊泡从高尔基复合体转运到细胞膜的过程中其重要作用[38]。我们的研究表明MACF1在GBM细胞的TMZ化疗抵抗中起重要作用,这可能与其在上述的Wnt受体信号通路、ATP酶活性或者细胞囊泡转运的过程中的作用相关,这些具体相关机制值得我们去进行深入研究。
我们前期研究结果表明,TMZ诱导GBM细胞自噬流水平上调,并促进细胞的上皮细胞-间充质转化过程(EMT),包括细胞形态的变化和细胞迁移能力的增强[39]。在本实验中,我们发现TMZ诱导的GBM细胞的MACF1表达水平变化与其细胞骨架的重排相关。而且,MACF1已经被证实在小鼠皮肤的上皮细胞受到胞外信号刺激时,介导微管沿微丝组装调节细胞骨架变化[29-30]。因此,MACF1可能通过其在细胞骨架的重排和细胞迁移中的作用,在TMZ诱导的GBM细胞的自噬流水平上调和EMT水平上调的过程中发挥重要的作用,这值得我们在后续试验中进行进一步的研究。
综上所述,我们的研究检测了GBM细胞中细胞骨架蛋白MACF1的表达,并发现其与TMZ治疗的相关性。特异性干扰MACF1的表达促进了GBM细胞的TMZ药物敏感性。因此,MACF1可能成为未来针对GBM的治疗的新的靶点。
| [1] | Fisher JL, Schwartzbaum JA, Wrensch M, et al. Epidemiology of brain tumors[J]. Methods Mol Biol, 2007, 25(4): 867-90. |
| [2] | Wen PY, Kesari S. Malignant gliomas in adults[J]. N Engl J Med, 2008, 359(5): 492-507. DOI: 10.1056/NEJMra0708126. |
| [3] | Stupp RP, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10): 987-96. DOI: 10.1056/NEJMoa043330. |
| [4] | Roos WP, Batista LF, Naumann SC, et al. Apoptosis in malignant glioma cells triggered by the temozolomide-induced DNA lesion O6-methylguanine[J]. Oncogene, 2007, 26(2): 186-97. DOI: 10.1038/sj.onc.1209785. |
| [5] | Gratas CS, Sery Q, Rabe M, et al. Bak and Mcl-1 are essential for Temozolomide induced cell death in human glioma[J]. Oncotarget, 2014, 5(9): 2428-35. DOI: 10.18632/oncotarget.v5i9. |
| [6] | Pirtoli LC, Cevenini G, Tini P, et al. The prognostic role of Beclin 1 protein expression in high-grade gliomas[J]. Autophagy, 2009, 5(7): 930-6. DOI: 10.4161/auto.5.7.9227. |
| [7] | Friedman HS, Prados MD, Wen PY, et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma[J]. J Clin Oncol, 2009, 27(28): 4733-40. DOI: 10.1200/JCO.2008.19.8721. |
| [8] | Weller MT, Tabatabai G, Kastner B, et al. MGMT promoter methylation is a strong prognostic biomarker for benefit from doseintensified temozolomide rechallenge in progressive glioblastoma: the DIRECTOR trial[J]. Clin Cancer Res, 2015, 21(9): 2057-64. DOI: 10.1158/1078-0432.CCR-14-2737. |
| [9] | Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma[J]. N Engl J Med, 2005, 352(10): 997-1003. DOI: 10.1056/NEJMoa043331. |
| [10] | Cho HY, Wang W, Jhaveri N, et al. NEO212, temozolomide conjugated to perillyl alcohol, is a novel drug for effective treatment of a broad range of temozolomide-resistant gliomas[J]. Mol Cancer Ther, 2014, 13(8): 2004-17. DOI: 10.1158/1535-7163.MCT-13-0964. |
| [11] | Hsieh CH, Lin YJ, Wu CP, et al. Livin contributes to tumor hypoxia-induced resistance to cytotoxic therapies in glioblastoma multiforme[J]. Clin Cancer Res, 2015, 21(2): 460-70. DOI: 10.1158/1078-0432.CCR-14-0618. |
| [12] | Munoz JL, Rodriguez CV, Ramkissoon SH, et al. Temozolomide resistance in glioblastoma occurs by miRNA-9-targeted PTCH1, Independent of sonic hedgehog level[J]. Oncotarget, 2015, 6(2): 1190-201. DOI: 10.18632/oncotarget.v6i2. |
| [13] | Nguyen SA, Stechishin SA, LuchmanHA, et al. Novel MSH6 mutations in treatment-naive glioblastoma and anaplastic oligodendroglioma contribute to temozolomide resistance independently of MGMT promoter methylation[J]. Clin Cancer Res, 2014, 20(18): · 1188 · J South Med Univ, 2017, 37(9): 1183-1189 http://www.j-smu.com4894-903. http://www.ncbi.nlm.nih.gov/pubmed/25078279 |
| [14] | Peres EA, Gerault AN, Valable S, et al. Silencing erythropoietin receptor on glioma cells reinforces efficacy of temozolomide and X-rays through senescence and mitotic catastrophe[J]. Oncotarget, 2015, 6(4): 2101-19. DOI: 10.18632/oncotarget.v6i4. |
| [15] | Stupp RE, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-66. DOI: 10.1016/S1470-2045(09)70025-7. |
| [16] | Weiler MB, Blaes MJ, Pusch S, et al. mTOR target NDRG1 confers MGMT-dependent resistance to alkylating chemotherapy[J]. Proc NatlAcad Sci USA, 2014, 111(1): 409-14. DOI: 10.1073/pnas.1314469111. |
| [17] | Wick W, Platten M. Understanding and targeting alkylator resistance in glioblastoma[J]. Cancer Discov, 2014, 4(10): 1120-2. DOI: 10.1158/2159-8290.CD-14-0918. |
| [18] | Garros-Regulez LA, Aldaz LP, Arrizabalaga O, et al. mTOR inhibition decreases SOX2-SOX9 mediated glioma stem cell activity and temozolomide resistance[J]. Expert Opin Ther Targets, 2016, 20(4): 393-405. DOI: 10.1517/14728222.2016.1151002. |
| [19] | Bordji KG, Grandval A, Cuhna-Alves L, et al. Hypoxia-inducible factor-2alpha (HIF-2alpha), but not HIF-1alpha, is essential for hypoxic induction of class Ⅲ beta-tubulin expression in human glioblastoma cells[J]. FEBS J, 2014, 281(23): 5220-36. DOI: 10.1111/febs.2014.281.issue-23. |
| [20] | Fujimura AM, Michiue H, Cheng Y, et al. Cyclin G2 promotes hypoxia-driven local invasion of glioblastoma by orchestrating cytoskeletal dynamics[J]. Neoplasia, 2013, 15(11): 1272-81. DOI: 10.1593/neo.131440. |
| [21] | Gu FW, Wang L, He J, et al. Girdin, an actin-binding protein, is critical for migration, adhesion, and invasion of human glio-blastoma cells[J]. JNeurochem, 2014, 131(4): 457-69. DOI: 10.1111/jnc.2014.131.issue-4. |
| [22] | Guo KT, Fu P, Juerchott K, et al. The expression of Wnt-inhibitor DKK1(Dickkopf 1) is determined by intercellular crosstalk and hypoxia in human malignant gliomas[J]. J Cancer Res Clin Oncol, 2014, 140(8): 1261-70. DOI: 10.1007/s00432-014-1642-2. |
| [23] | Lan JX, Xue Y, Chen H, et al. Hypoxia-induced miR-497 decreases glioma cell sensitivity to TMZ by inhibiting apoptosis[J]. FEBS Lett, 2014, 588(18): 3333-9. DOI: 10.1016/j.febslet.2014.07.021. |
| [24] | Yoon JH, Kim J, Kim KL, et al. Proteomic analysis of hypoxia-induced U373MG glioma secretome reveals novel hypoxia-dependent migration factors[J]. Proteomics, 2014, 14(12): 1494-502. DOI: 10.1002/pmic.v14.12. |
| [25] | Masoumi SH, Harisankar A, Gracias A, et al. Understanding cytoskeleton regulators in glioblastoma multiforme for therapy design[J]. Drug Des Devel Ther, 2016, 10: 2881-97. DOI: 10.2147/DDDT. |
| [26] | Bangert AH, Hacker SA, Cristofanon S, et al. Chemosensitization of glioblastoma cells by the histone deacetylase inhibitor MS275[J]. Anticancer Drugs, 2011, 22(6): 494-9. DOI: 10.1097/CAD.0b013e32834631e0. |
| [27] | Zhang QL, Liu X, Li X, et al. Antitumor activity of (2E, 5Z)-5-(2-hydroxybenzylidene) -2-((4-phenoxyphenyl) imino) thiazolidin-4-one, a novel microtubule-depolymerizing agent, in U87MG human glioblastoma cells and corresponding mouse xenograft model[J]. J Pharmacol Sci, 2013, 122(3): 223-31. DOI: 10.1254/jphs.13064FP. |
| [28] | Poon MW, Zhuang JT, Wong ST, et al. Co-expression of cytoskeletal protein adducin 3 and CD133 in neurospheres and a temozolomide-resistant subclone of glioblastoma[J]. Anticancer Res, 2015, 35(12): 6487-95. |
| [29] | Kodama AK, Karakesisoglou I, Wong E, et al. ACF7: an essential integrator of microtubule dynamics[J]. Cell, 2003, 115(3): 343-54. DOI: 10.1016/S0092-8674(03)00813-4. |
| [30] | Wu XK, Kodama A, Fuchs E. ACF7 regulates cytoskeletal-focal adhesion dynamics and migration and has ATPase activity[J]. Cell, 2008, 135(1): 137-48. DOI: 10.1016/j.cell.2008.07.045. |
| [31] | Wang HF, Feng W, Lu Y, et al. Expression of dynein, cytoplasmic 2, heavy chain 1 (DHC2) associated with glioblastoma cell resistance to temozolomide[J]. Sci Rep, 2016: 28948. |
| [32] | Lin CM, Chen HJ, Leung CL, et al. Microtubule actin crosslinking factor 1b: a novel plakin that localizes to the Golgi complex[J]. J Cell Sci, 2005, 118: 3727-38. DOI: 10.1242/jcs.02510. |
| [33] | Pawlik AA, A Klimaszewska-Wisniewska EA. Cytoskeletal reo-rganization and cell death in mitoxantrone-treated lung Cancer cells[J]. ActaHistochem, 2016, 118(8): 784-96. |
| [34] | Hasanpourghadi M, Karthikeyan C, Pandurangan AK, et al. Targeting of tubulin polymerization and induction of mitotic blockage by Methyl 2-(5-fluoro-2-hydroxyphenyl)-1H-benzo [d] imidazole-5-carboxylate (MBIC) in human cervical cancer HeLa cell[J]. J Exp Clin Cancer Res, 2016, 35: 58. DOI: 10.1186/s13046-016-0332-0. |
| [35] | Zaoui KB, Benseddik K, Daou P, et al. ErbB2 receptor controls microtubule capture by recruiting ACF7 to the plasma membrane of migrating cells[J]. Proc Natl Acad Sci USA, 2010, 107(43): 18517-22. DOI: 10.1073/pnas.1000975107. |
| [36] | Yucel G, Oro AE. Cell migration: GSK3 beta steers the cyto-skeleton's tip[J]. Cell, 2011, 144(3): 319-21. DOI: 10.1016/j.cell.2011.01.023. |
| [37] | Chen HJ, LinCM, Lin CS, et al. The role of microtubule actin cross-linking factor 1(MACF1) in the Wnt signaling pathway[J]. Genes Dev, 2006, 20(14): 1933-45. DOI: 10.1101/gad.1411206. |
| [38] | Kakinuma TI, Ichikawa H, Tsukada Y, et al. Interaction between p230 and MACF1 is associated with transport of a glycosyl phosphatidyl inositol-anchored protein from the Golgi to the cell periphery[J]. Exp Cell Res, 2004, 298(2): 388-98. DOI: 10.1016/j.yexcr.2004.04.047. |
| [39] | Lu YX, Xiao L, Liu Y, et al. MIR517C inhibits autophagy and the epithelial-to-mesenchymal(-like)transition phenotype in human glioblastoma through KPNA2-dependent disruption of TP53 nuclear translocation[J]. Autophagy, 2015, 11(12): 2213-32. DOI: 10.1080/15548627.2015.1108507. |
 2017, Vol. 37
2017, Vol. 37

