不孕不育严重危害人类生殖健康,流行病学研究显示世界上有15%的夫妇由于不孕不育而无法拥有自己的子女。其中男性因素约占50%,精子数量和质量的下降是导致男性不育的关键原因[1]。近20年来,人类精子数目每年以2%的速度下降,其原因与环境内分泌干扰物密切相关[2]。“白色污染源”是指邻苯二甲酸二(2-乙基己)酯(DEHP),为已经证实的环境内分泌干扰物,是迄今为止我国产耗量最大、应用最为广泛的通用型增塑剂,大量用于各种塑料产品,通过各种途径对环境造成严重的“白色”污染危害人类健康[3-4]。近年来,大量研究表明DEHP可以损伤男性生殖功能[5-6],然而,其具体机制尚不明确。
男性生殖功能的维持依赖于精子的大量生成,血睾屏障(BTB)在精子生成过程中起着至关重要的作用,既防止精子抗原外逸进入血液循环引起自身免疫反应,也防止有害物质进入曲细精管,干扰精子的发生,为精子生成创造特殊稳定的环境。血睾屏障是由睾丸支持细胞之间的紧密连接、缝隙连接、基底的细胞外质特化(粘附连接的一种)和桥粒构成[7]。如果这些连接蛋白表达异常,精原细胞将不能发生分化或减数分裂,并最终导致不育[8-9]。
研究表明DEHP进入机体后会导致细胞内活性氧簇(ROS)明显增加,使细胞或机体内的氧化压力增加,进而对核苷酸攻击,导致细胞坏死或者凋亡[10]。研究表明,细胞内ROS水平上调可激活MAPK信号通路[11],p38属于MAPK信号通路,它在睾丸支持细胞中的活性增加将破坏血睾屏障的完整性[12]。
因此,我们推测DEHP进入体内后,产生过量的ROS,激活p38 MAPK信号通路的活性,使紧密连接蛋白、缝隙连接蛋白和粘附连接蛋白的表达紊乱,从而损伤BTB的完整性,进而破坏生精微环境的稳定,生精细胞发育异常,精子生成数量减少和质量降低,并最终导致生殖功能损伤。
1 材料和方法 1.1 实验动物Sprague-Dawley大鼠由重庆医科大学实验动物中心提供,合格证号SYXK(渝)20040001。购买PND60的SD雄鼠,于重庆医科大学附属儿童医院动物中心SPF区继续饲养。动物饲养在持续保持12 h明暗周期,温度为24±1 ℃,湿度为(45±5)%的环境中。
1.2 DEHP暴露动物模型建立16只SD雄鼠(60日龄)随机分为2组,通过灌胃的方式分别给予玉米油或DEHP 750 mg/kg,1/d次,连续暴露30 d后处死,收集大鼠睾丸。左侧睾丸于-80 ℃保存以提取蛋白,右侧睾丸于多聚甲醛在4 ℃下固定以用作石蜡包埋切片。
1.3 睾丸组织HE染色睾丸组织用多聚甲醛在4 ℃下固定3 d后脱水、石蜡包埋。蜡块用轮转式切片机切成4 μm的组织片,随后在60 ℃烤箱中烘烤8 h以上。经二甲苯Ⅰ 30 min→二甲苯Ⅱ 30 min→无水乙醇5 min→95%乙醇5 min→85%乙醇5 min→75%乙醇5 min→50%乙醇5 min→自来水冲洗3 min→苏木素2 min→自来水冲洗1 min→盐酸酒精2 s→自来水冲洗2 min→饱和碳酸锂2 s→伊红3 s→50%乙醇1 min→75%乙醇1 min→85%乙醇1 min→95%乙醇1 min→无水乙醇3 min→无水乙醇3 min→二甲苯3 min→封片。光镜下观察组织形态。
1.4 血睾屏障完整性检测采用膜蛋白提取试剂盒(凯基,KGP350)提取睾丸组织膜蛋白,Western blot检测粘附连接蛋白N-cadherin(Invitrogen, 33-3900)、β-catenin(Abcam, ab32572)、紧密连接蛋白occludin(Invitrogen, 40-4700)和缝隙连接蛋白Cx43(Abcam, ab11370)的表达情况。使用ImageJ软件将以上指标的灰度值比去内参β-actin(中衫金桥,TA-09)的灰度值得到的比值再用统计软件进行统计。
1.5 睾丸支持细胞培养睾丸支持细胞系(TM4)于DMEM/F12(Hyclone, SH30023.01B)培养基中培养,培养基中添加3%胎牛血清(GIBCO)和100 mg/L青链霉素。支持细胞(Sertoli cell)置于5% CO2,37 ℃培养箱中培养。每24 h换液,当细胞铺满培养瓶底部的85%时传代。细胞分别用DMSO和DEHP处理,DEHP溶于DMSO中。
1.6 MTT取对数生长期的Sertoli细胞制成细胞悬液,接种于96孔板。分别用空白、DMSO以及DEHP、1.56、3.125、6.25、12.5、25、50、100、200 μmol/L处理,每组6个复孔,5000/孔,于24、48、72和96 h进行MTT检测细胞增殖指数。吸尽培养液后加入20 μL 5 mg/mL MTT+80 μL无血清培养液,继续培养4 h后吸尽反应液,加入100 μL DMSO后摇床溶解15 min,使用酶标仪492 nm波长测各孔A值,将各孔所测A值减去空白孔所测A值后的数据进行分析。
1.7 氧化应激水平和p38 MAPK活性测定RIPA裂解液(碧云天,P0013B)提取睾丸组织全蛋白,Western blot检测抗氧化应激蛋白Nrf2(Abcam, ab31163)和p-p38(CST, 9211)的表达情况,使用Image J软件将以上指标的灰度值比去内参β-actin(中衫金桥,TA-09)的灰度值得到的比值再用统计软件进行统计。Sertoli cell经DMSO和6.25、12.5、25及50 μmol/L DEHP处理24 h,随后用活性氧检测试剂盒(碧云天,S0033)检测Sertoli细胞中的活性氧生成水平。按照检测试剂盒说明书进行原位装载探针,在刺激细胞20~30 min后使用倒置荧光显微镜,488 nm激发波长,525 nm发射波长,进行观察,荧光越强,ROS生成越多。
1.8 统计学处理所有实验数据应用SPSS 19.0软件处理,所得数值以均数±标准差表示,两组样本比较采用独立样本t检验,多组样本比较则应用方差分析进行统计学处理,P < 0.05认为差异有统计学意义。
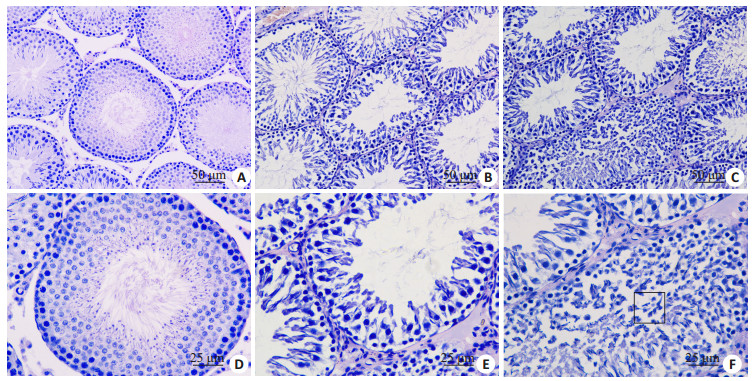
2 结果 2.1 睾丸组织形态学变化HE染色(图 1)发现DEHP暴露后,大鼠睾丸组织曲细精管中生精细胞数量明显减少,排列紊乱,官腔中央少见精子,且延长的精子细胞排列失去极性(如图 1F方框所示)。
|
图 1 DEHP暴露后PND90大鼠睾丸组织病理学改变 Figure 1 Histopathological changes of rat testis after 30 days of DEHP exposure. A, D: Oil control group; B, C, E and F: DEHP exposure group (A-C: Original magnification: ×200; D-F: ×400). |
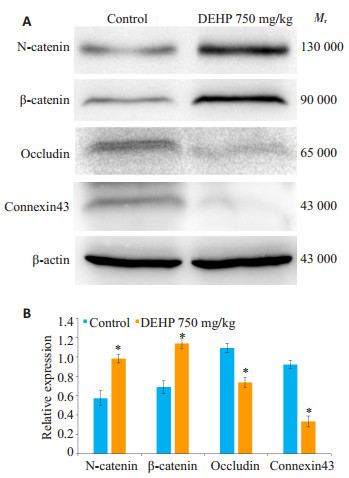
为了明确DEHP所导致的生精功能损伤归因于血睾屏障完整性被破坏,我们提取睾丸组织膜蛋白,通过Western blot检测了构成血睾屏障的4种主要连接蛋白的表达水平。如图 2所示,DEHP暴露后,粘附连接蛋白N-cadherin和β-catenin的表达明显增加,紧密连接蛋白occludin和缝隙连接蛋白connexin43的表达则显著减少(P < 0.05),表明DEHP暴露破坏了睾丸血睾屏障完整性。
|
图 2 DEHP暴露后血睾屏障连接蛋白的表达水平 Figure 2 Expression levels of BTB junction proteins after DEHP exposure. *P < 0.05 vs control. |
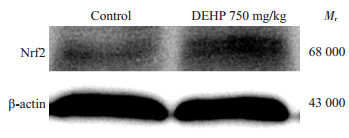
由于DEHP可以导致机体中氧化应激压力增加,我们推测血睾屏障完整性受损与氧化应激密切相关。因此,我们检测了睾丸组织中的氧化应激水平。与对照组(0.4615±0.0776)相比,DEHP暴露后睾丸组织中抗过氧化物生成蛋白Nrf2的表达水平明显上调(0.6983± 0.1093)(P < 0.05,图 3),间接说明DEHP导致睾丸组织过氧化物生成增加。
|
图 3 DEHP暴露后抗氧化应激蛋白的Nrf2表达水平 Figure 3 Expression level of anti-oxidative protein Nrf2 after DEHP exposure. |
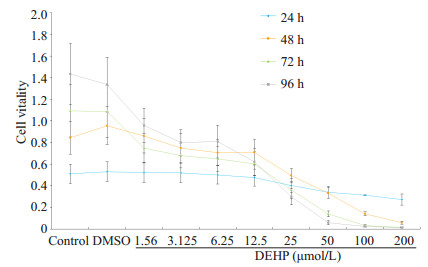
MTT实验发现,50 μmol/L DEHP处理24 h时对Sertoli细胞的活力有明显抑制作用,但并没有达到半数致死率。由于样本数量较小,方差不齐,故应用非参数检验进行统计分析,发现随着暴露时间的延长,细胞活力明显下降,DEHP的抑制作用呈现剂量和时间依赖性(图 4)。因此,在后续实验中,我们选择DEHP暴露时间为24 h,浓度为6.25、12.5、25和50 μmol/L。
|
图 4 DEHP对Sertoli细胞活力的影响 Figure 4 Effects of DEHP on vitality of Sertoli cells in vitro. |
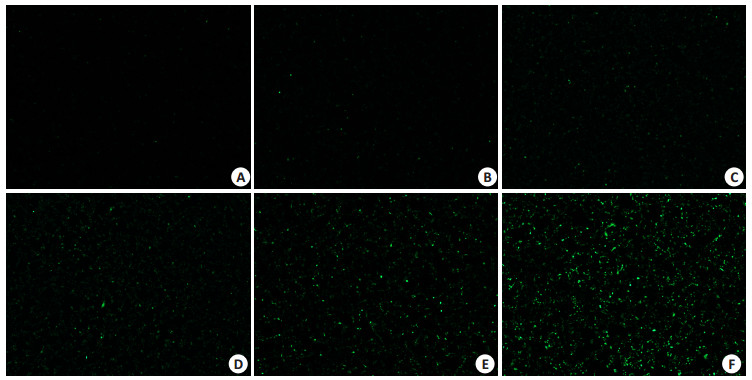
与对照组相比,DEHP暴露后,Sertoli细胞中ROS生成水平明显增加,且随着暴露浓度的升高而明显增多,呈现剂量依赖性(图 5)。
|
图 5 DEHP暴露后Sertoli细胞中ROS生产水平 Figure 5 ROS generation level in Sertoli cells after DEHP exposure (×40). A: blank control; B: DMSO control; C: 6.25 μmol/L DEHP; D: 12.5 μmol/L DEHP; E: 25 μmol/L DEHP; F: 50 μmol/L DEHP. |
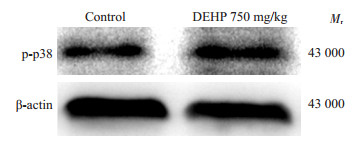
根据已有文献报导,ROS可激活MAPK信号通路。因此,我们检测了p-p38的表达水平。与对照组(0.6027 ± 0.0337)相比,DEHP暴露后睾丸组织中p-p38(1.0013 ± 0.0637)表达是明显上调的(P < 0.05,图 6)。
|
图 6 DEHP暴露后睾丸组织中p-p38表达水平 Figure 6 p-p38 expression in the testes of the rats after DEHP exposure. |
迄今为止,已有大量的研究表明,DEHP可以导致男性生精功能发生损伤,但具体的原因和机制尚未阐明。我们通过HE染色发现DEHP暴露后,曲细精管管腔中生精细胞数量明显减少,精子排列紊乱,头部不再朝向曲细精管管壁,极性消失。由于Sertoli细胞之间的连接所构成的血睾屏障能够有效阻挡有害物质进入曲细精管对生殖细胞造成损害,维持生精微环境的稳定,是环境毒物最主要的攻击目标[13-14]。因此,我们推测DEHP可能是通过破坏血睾屏障完整性进而损伤生精功能。
Western blot结果显示,构成BTB的紧密连接蛋白occludin和缝隙连接蛋白connexin43的表达是明显减少的,我们的结果与其他学者的发现是一致的。哺乳期DEHP暴露导致Wistar雄鼠睾丸中紧密连接蛋白ZO-1和occludin表达降低[15],DEHP的活性物质MEHP暴露于小鼠后导致小鼠睾丸组织中occludin表达下调[16]。然而,我们首次发现DEHP暴露后,睾丸组织中粘附连接蛋白N-cadherin和β-catenin的表达是显著增加的。有文献报导connexin43在Sertoli细胞中被敲除后将直接导致N-cadherin和β-catenin的表达异常升高,不能维持血睾屏障的完整性[17],且connexin43全敲后曲细精管中几乎没有生精细胞,造成雄鼠不育[18]。因此我们推测这可能是由于DEHP暴露后导致connexin43的表达降低,不能抑制粘附连接蛋白的过度表达,使其维持在正常表达范围内以保障血睾屏障完整性。这些结果均证实了DEHP所导致的生精功能损伤是源于血睾屏障完整性被破坏。
有研究表明DEHP是通过氧化应激机制导致睾丸功能损伤[19-21]。转录因子红细胞系-2p45相关因子2(Nrf2)在抗氧化过程中起到重要作用,能够启动多种抗氧化酶的活化[22],间接反映体内氧化应激水平。因此,我们分别检测了睾丸组织和Sertoli细胞中Nrf2和ROS的水平。结果显示DEHP暴露后,睾丸组织和Sertoli细胞中的过氧化物生成都是明显增加的。此外,MTT结果也发现随着DEHP暴露时间的延长和浓度的增加,Sertoli细胞的活力明显减弱。我们的研究结果直接证实DEHP是通过氧化应激损伤Sertoli细胞,进而破坏血睾屏障完整性。
有研究表明,细胞内的ROS增加可激活MAPK信号通路[11],而MAPK信号通路的活性增加将直接损伤血睾屏障的完整性[23-25]。p38 MAPK信号通路对细胞增殖、凋亡等起到重要调控作用,同时有学者发现TGF-β3可以通过激活p38信号通路破坏Sertoli细胞之间的紧密连接,证明p38 MAPK信号通路与血睾屏障完整性之间的联系[12]。结合本次研究结果,我们首次发现DEHP暴露导致p-p38表达增加,p38 MAPK信号通路活性增强。综上所述,DEHP通过氧化应激机制激活p38 MAPK信号通路,进而破坏血睾屏障完整性,并最终损伤生精功能。
| [1] | Kilchevsky A, Honig S. Male factor infertility in 2011: semen quality, sperm selection and hematospermia[J]. Nat Rev Urol, 2012, 9(2): 68-70. DOI: 10.1038/nrurol.2011.234. |
| [2] | Nordkap L, Joensen UN, Blomberg JM, et al. Regional differences and temporal trends in male reproductive health disorders: semen quality may be a sensitive marker of environmental exposures[J]. Mol Cell Endocrinol, 2012, 355(2): 221-30. DOI: 10.1016/j.mce.2011.05.048. |
| [3] | Casals-Casas C, Desvergne B. Endocrine disruptors: from endocrine to metabolic disruption[J]. Annu Rev Physiol, 2011, 73: 135-62. DOI: 10.1146/annurev-physiol-012110-142200. |
| [4] | De Coster S, van Larebeke N. Endocrine-disrupting chemicals: associated disorders and mechanisms of action[J]. J Environ Public Health, 2012, 2012: 713696. |
| [5] | Wang YX, You L, Zeng Q, et al. Phthalate exposure and human semen quality: Results from an infertility clinic in China[J]. Environ Res, 2015, 142: 1-9. DOI: 10.1016/j.envres.2015.06.010. |
| [6] | Abd-Ellah MF, Aly HA, Mokhlis HA, et al. Quercetin attenuates di-(2-ethylhexyl) phthalate-induced testicular toxicity in adult rats[J]. Hum Exp Toxicol, 2016, 35(3): 232-43. DOI: 10.1177/0960327115580602. |
| [7] | Gao Y, Mruk D, Chen H, et al. Regulation of the blood-testis barrier by a local axis in the testis: role of laminin a2 in the basement membrane[J]. FASEB J, 2017, 31(2): 584-97. DOI: 10.1096/fj.201600870R. |
| [8] | Mok KW, Mruk DD, Lee WM, et al. A study to assess the assembly of a functional blood-testis barrier in developing rat testes[J]. Spermatogenesis, 2011, 1(3): 270-80. DOI: 10.4161/spmg.1.3.17998. |
| [9] | Cheng CY, Mruk DD. The blood-testis barrier and its implications for male contraception[J]. Pharmacol Rev, 2012, 64(1): 16-64. DOI: 10.1124/pr.110.002790. |
| [10] | Tetz LM, Cheng AA, Korte CS, et al. Mono-2-ethylhexyl phthalate induces oxidative stress responses in human placental cells in vitro[J]. Toxicol Appl Pharmacol, 2013, 268(1): 47-54. DOI: 10.1016/j.taap.2013.01.020. |
| [11] | McCubrey JA, Lahair MM, Franklin RA. Reactive oxygen species-i nduced activation of the MAP kinase signaling pathways[J]. Antioxid Redox Signal, 2006, 8(9-10): 1775-89. DOI: 10.1089/ars.2006.8.1775. |
| [12] | Lui WY, Lee WM, Cheng CY. Transforming growth factor beta3 regulates the dynamics of Sertoli cell tight junctions via the p38 mitogen-activated protein kinase pathway[J]. Biol Reprod, 2003, 68(5): 1597-612. DOI: 10.1095/biolreprod.102.011387. |
| [13] | Xiao X, Mruk DD, Tang EI, et al. Environmental toxicants perturb human Sertoli cell adhesive function via changes in F-actin organization mediated by actin regulatory proteins[J]. Hum Reprod, 2014, 29(6): 1279-91. DOI: 10.1093/humrep/deu011. |
| [14] | Gao Y, Mruk DD, Cheng CY. Sertoli cells are the target of environmental toxicants in the testis -a mechanistic and therapeutic insight[J]. Expert Opin Ther Targets, 2015, 19(8): 1073-90. DOI: 10.1517/14728222.2015.1039513. |
| [15] | Sekaran S, Balaganapathy P, Parsanathan R, et al. Lactational exposure of phthalate causes long-term disruption in testicular architecture by altering tight junctional and apoptotic protein expression in Sertoli cells of first filial generation pubertal Wistar rats[J]. Hum Exp Toxicol, 2015, 34(6): 575-90. DOI: 10.1177/0960327114555926. |
| [16] | Yao PL, Lin YC, Richburg JH. Mono-(2-ethylhexyl) phthalate-induced disruption of junctional complexes in the seminiferous epithelium of the rodent testis is mediated by MMP2[J]. Biol Reprod, 2010, 82(3): 516-27. DOI: 10.1095/biolreprod.109.080374. |
| [17] | Carette D, Weider K, Gilleron J, et al. Major involvement of connexin 43 in seminiferous epithelial junction dynamics and male fertility[J]. Dev Biol, 2010, 346(1): 54-67. DOI: 10.1016/j.ydbio.2010.07.014. |
| [18] | Brehm R, Zeiler M, Ruttinger C, et al. A sertoli cell-specific knockout of connexin43 prevents initiation of spermatogenesis[J]. AmJPathol, 2007, 171(1): 19-31. |
| [19] | Zhang LD, Li HC, Chong T, et al. Prepubertal exposure to genistein alleviates di-(2-ethylhexyl) phthalate induced testicular oxidative stress in adult rats[J]. Biomed Res Int, 2014, 2014: 598630. |
| [20] | Erkekoglu P, Giray B, Rachidi W, et al. Effects of di (2-ethylhexyl) phthalate on testicular oxidant/antioxidant status in selenium-deficient and selenium-supplemented rats[J]. Environ Toxicol, 2014, 29(1): 98-107. DOI: 10.1002/tox.v29.1. |
| [21] | Erkekoglu P, Rachidi W, Yuzugullu OG, et al. Evaluation of cyto toxicity and oxidative DNA damaging effects of di (2-ethylhexyl)-phthalate (DEHP) and mono (2-ethylhexyl)-phthalate (MEHP) on MA-10 Leydig cells and protection by selenium[J]. Toxicol Appl Pharmacol, 2010, 248(1): 52-62. DOI: 10.1016/j.taap.2010.07.016. |
| [22] | Paul MK, Bisht B, Darmawan DO, et al. Dynamic changes in intracellular ROS levels regulate airway basal stem cell homeostasis through Nrf2-dependent Notch signaling[J]. Cell Stem Cell, 2014, 15(2): 199-214. DOI: 10.1016/j.stem.2014.05.009. |
| [23] | Transforming growth factor-p3 regulates cell junction restructuring via MAPK-mediated mRNA destabilization and Smad-dependent protein degradation of junctional adhesion molecule B (JAM-B)[J]. BiochimBiophysActa, 2015, 1849(6): 601-11. |
| [24] | Xia W, Mruk DD, Lee WM, Cheng CY. Differential interactions between transforming growth factor-beta3/TbetaR1, TAB1, and CD2AP disrupt blood-testis barrier and Sertoli-germ cell adhesion[J]. J Biol Chem, 2006, 281(24): 16799-813. DOI: 10.1074/jbc.M601618200. |
| [25] | Puri P, Walker WH. The tyrosine phosphatase SHP2 regulates Sertoli cell junction complexes[J]. Biol Reprod, 2013, 88(3): 59. |
 2017, Vol. 37
2017, Vol. 37

