髓样相关蛋白8(MRP8) 和髓样相关蛋白14 (MRP14),又名S100A8和S100A9,属于S100钙结合蛋白家族成员[1]。MRP8/MRP14生物学功能极其丰富,参与蛋白质磷酸化[1]、细胞骨架重塑[2]、细胞迁移[3]、调节钙离子稳态[4]、花生四烯酸代谢[5]、对中性粒细胞NADPH氧化酶的调控[6]等,其在炎症及其相关疾病中的作用最近才受到重视[7]。MRP8和MRP14参与诸多炎症相关疾病的发生发展,包括脓毒症[8-11]、肿瘤[1]以及自身免疫相关性疾病等[1, 12]。
MRP8/MRP14是新近鉴定的重要的内源性损伤相关模式分子(DAMPs)[7-8]。正常情况下,MRP8/MRP14组成型表达于中性粒细胞与单核细胞,在中性粒细胞中含量丰富,约占可溶性胞浆成分的50%[1]; 病理状态下,胞内MRP8/MRP14可通过坏死或活化细胞被动或主动释放到细胞外,作为重要的内源性DAMPs分子发挥免疫调节作用[17]。MRP8/MRP14起始并扩大炎症反应的作用已得到普遍认识,MRP8/MRP14通过诱导炎性细胞因子的释放以及炎症相关细胞的迁移、粘附等介导机体的炎症反应[3, 13]。目前有很多研究聚焦MRP8/ MRP14介导炎症反应的机制,研究表明MRP8/MRP14可通过促进促炎细胞因子的表达与释放,如TNF-α、IL-1b、IL-8等参与机体的炎症反应[1, 8, 14];MRP8/MRP14通过TLR4-TRIF-NF-kB/IRF3信号通路,诱导单核细胞IP-10的表达,进而介导CXCR3+林巴细胞的趋化,参与损伤介导的炎症反应[15]。而关于MRP8/MRP14对原代腹腔巨噬细胞的作用及其机制,尤其是MAPKs家族成员在其中的重要作用,相关研究较少。
基于此,本研究拟利用原代分离的小鼠腹腔巨噬细胞,筛选MRP8/MRP14诱导小鼠腹腔巨噬细胞细胞因子表达的情况,鉴定MRP蛋白诱导细胞因子表达的结构域,探讨p38丝裂原活化蛋白激酶(p38 MAPK)、c-Jun氨基末端激酶(JNK)以及细胞外调节蛋白激酶(ERK)信号通路在其中的作用,同时对MRP8/MRP14的作用受体进行了初步筛选。本研究对深人认识MRP8/MRP14介导机体炎症反应的机制有着重要意义。
1 材料和方法 1.1 动物和菌株SPF级BALB/c小鼠,雄性,6~8周龄,购自南方医科大学实验动物中心,E.coli DE3感受态细胞由本实验室保存。
1.2 主要试剂实验所需原核表达载体均由本室构建保存;DMEM培养基、胎牛血清(FBS, Gibco); 异丙基硫代-b-D-半乳糖苷(IPTG)、Ni2+-NTA-agarose(Merck); 小鼠细胞因子检测试剂盒(Millipore); 多粘菌素B (PMB)、各种信号通路抑制剂SB203580、SP600125、PD98059和U0126(Merck); 抗磷酸化或总的p38、JNK和ERK激酶抗体(CST); Toll样受体4 (TLR4) 抑制剂TAK242(APEXBIO),晚期糖基化终产物受体(RAGE)中和性抗体(R & D)。
1.3 主要方法 1.3.1 重组蛋白的制备MRP8、MRP14蛋白以及MRP14各个结构域蛋白包括:His-EF-hand1-EGFP、His-EF-hand2-EGFP、His-CT-EGFP及His-EF-hand1 + 2-EGFP均采用原核蛋白表达系统,相关的质粒载体转化E.coli DE3感受态,IPTG诱导表达蛋白,用Ni2+-NTA-agarose纯化,蛋白经DPBS透析及0.22 μm微孔滤膜过滤除菌。鲎试剂法(LAL)检测制备的重组蛋白内毒素含量低于0.25EU/mL。MRP8/MRP14异源二聚体的构建按照参考文献[5]方法进行,将MRP8与MRP14按等摩尔比混合,制成MRP8/MRP14异源二聚体重组蛋白。
1.3.2 小鼠腹腔巨噬细胞(PMs)的分离、培养8周C57BL/6小鼠乌拉坦(0.6 mL/100 g)腹腔注射麻醉后,置于解剖板上,用针头固定四肢,腹部去皮,沿着腹白线偏左或偏右向腹腔注射无菌的PBS缓冲液5 mL,轻柔小鼠腹部2~3 min,用注射器抽取腹腔液,重复3次,吸取液1000 r/min离心5 min, 弃上清。细胞重悬于含10%胎牛血清的DMEM培养液中,接种于96孔板或6孔板中,2 h后更换培养液,置于37 ℃、5% CO2培养箱培养过夜,次日用于实验研究。胎盘蓝染色鉴定细胞存活状况。
1.3.3 细胞培养上清细胞因子含量测定将分离的小鼠PMs按照1×104/孔的密度铺于96孔板中,培养24 h后,更换为无血清培养液,使用1.5 mg/mL MRP8/MRP14蛋白刺激细胞24 h,收集细胞上清液,12 000 r/min离心10 min, 弃杂质。对照组加人单纯培养液; 重组蛋白预先与多粘菌素B(PMB,20 mg/L)室温孵育30 min,用以去除重组蛋白脂多糖(LPS)的污染。每实验分组设置3个平行孔,每个独立实验重复3次。
肿瘤坏死因子-α(TNF-α)、干扰素诱导蛋白10 (IP-10)、白介素-2(IL-2)、IL-6、IL-5以及γ-干扰素(IFN-γ)细胞因子的表达采用Luminex xMAP液相芯片检测系统完成。具体操作步骤如下:首先取25 μL待测细胞培养上清液加人96孔过滤板中,加人25 μL偶联待检测目标抗体的球形基质(一抗),漩涡混匀,室温避光振摇2 h。利用磁力架除去反应孔中的液体,之后加人150 μL洗涤缓冲液,轻轻振摇后,除去液体,每孔加人25 μL生物素化的二抗(报告分子),室温避光振摇1.5 h; 每孔加人25 μL链霉亲和素偶联的藻红蛋白溶液,室温避光振摇0.5 h; 150 μL洗涤缓冲液洗涤2次,每孔加人150 μL检测缓冲液,室温避光振摇5 min; 最后在Luminex xMAP液相芯片检测系统上读取各孔荧光强度,并根据制作的标准曲线计算细胞因子浓度。
1.3.4 MRP14不同结构域诱导巨噬细胞细胞因子表达的效应小鼠PMs按照1×104/孔的密度铺于96孔板中,培养24 h后,更换培养液为无血清培养液,1.5 mg/mL重组的MRP14不同结构域融合蛋白(图 1) :MRP14-EGFP全长、EF-hand1-EGFP、EF-hand2-EGFP、CT-EGFP、EF-hand1+2-EGFP,以及单独EGFP蛋白刺激细胞,24 h收集培养上清,Luminex xMAP液相芯片系统检测TNF-α、IP-10和IL-6的表达。
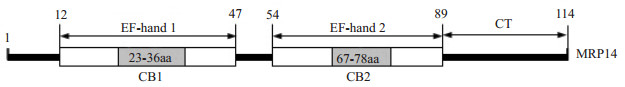
|
图 1 MRP14结构域示意图,EF-hand1,EF-hand2和CT末端结构域 Figure 1 Schematic diagram showing MRP14 protein structure, which contains EF-hand1, EF-hand2 and CT. |
小鼠PMs按照5×105/皿接种于60 mm细胞培养皿中,长至约90%融合。细胞用1.5 mg/mL MRP8/MRP14复合物刺激不同时间点:0、5、10、15、30、60和120 min。刺激结束后细胞用PBS洗涤1次,各加入150 μL细胞裂解液,冰上裂解20 min。利用细胞刮子刮取细胞裂解物,4 ℃、12 000 r/min离心10 min。收集上清,每组取15 μL样品进行SDS-PAGE。蛋白用半干转移法转印至PVDF膜,膜用5%脱脂奶粉室温封闭1 h,依次与1: 1000稀释的Ⅰ抗4 ℃孵育过夜,以及1: 2000稀释的HRP偶联的IgG室温孵育1 h后,利用KodakIS4000R图像工作站进行化学发光检测。
1.3.6 p38 MAPK、JNK和ERK抑制剂对MRP8/MRP14诱导细胞因子表达的影响小鼠PMs按照1×104/孔的密度铺于96孔板中,培养24 h后,更换培养液为无血清培养液,实验分为6组:对照组、MRP8/MRP14组、MRP8/MRP14 + SB203580(p38 MAPK抑制剂)组、MRP8/MRP14 + SP600125(JNK抑制剂)组、MRP8/ MRP14 + PD98059(MEK/ERK抑制剂)组、MRP8/ MRP14+U0126(MEK1/2抑制剂)组;细胞预先使用SB203580(20 mmol)、SP600125(20 mmol)、PD98059(30 mmol)和U0126(10 mmol)预处理1 h,之后用1.5 mg/mL MRP8/MRP14复合物刺激12 h,对照组加入单纯培养液,之后按照上述方法收集细胞上清,Luminex xMAP液相芯片系统检测TNF-α、IP-10和IL-6的表达。
1.3.7 TLR4和RAGE受体抑制剂对MRP8/MRP14诱导细胞因子表达的影响小鼠PMs按照1×104个/孔的密度铺于96孔板,培养12 h后加刺激。实验分为4组:对照组、MRP8/MRP14组、MRP8/MRP14+TAK242;MRP8/MRP14+RAGE中和性抗体。细胞预先使用TLR4受体抑制剂TAK242和RAGE neutralized Ab封闭1 h,之后用1.5 mg/mL MRP8/MRP14蛋白复合物刺激12 h,收集细胞上清,检测TNF-α、IP-10和IL-6的表达。
1.3.8 统计学方法采用SPSS 20.0统计软件进行分析,数据用均数±标准差表示。组间比较采用方差分析和t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 MRP8/MRP14诱导小鼠腹腔巨噬细胞细胞因子的表达1.5 mg/mL MRP8/MRP14蛋白复合物刺激腹腔巨噬细胞,24 h后收集细胞上清Luminex检测细胞因子表达,与对照组相比,MRP8/MRP14能显著诱导小鼠腹腔巨噬细胞TNF-α、IP-10和IL-6的表达(P < 0.01),蛋白表达水平分别从对照组的3.03±0.68 pg/mL、3.92±0.78 pg/mL和1.2 ± 0.3 pg/mL升高至297.68 ± 13.67 pg/mL、1484.97±206.54 pg/mL和7.57±1.86 pg/mL,升高约98.2、378.6和6.3倍;MRP8/MRP14对IL-2、IL-5和IFN-g的诱导表达作用则不明显(P > 0.05,图 2)。
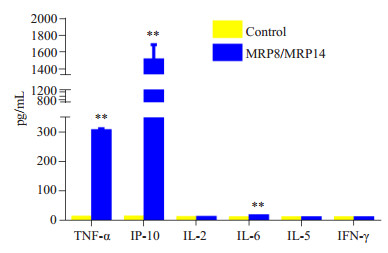
|
图 2 MRP8/MRP14诱导腹腔巨噬细胞细胞因子表达情况 Figure 2 Expression of cytokines induced by MRP8/MRP14 in peritoneal macrophages. **P < 0.01 vs control group. |
MRP14全长及不同结构域融合蛋白刺激细胞,24 h后收集细胞上清,检测TNF-α、IP-10和IL-6的表达。与对照组相比,MRP14全长、EF hand-1、EF hand-2及EF hand-1+2结构域融合蛋白均能够诱导TNF-α、IP-10和IL-6的表达(P < 0.01),而CT末端结构域则不具有诱导活性(P > 0.05,图 3)。
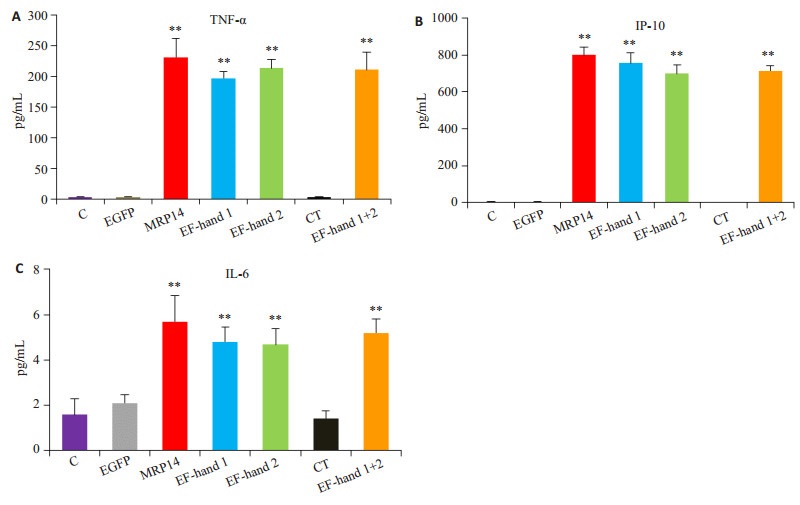
|
图 3 MRP14不同结构域EF-hand 1、EF-hand 2、CT和EF-hand1+2诱导腹腔巨噬细胞TNF-α、IP-10和IL-6表达情况 Figure 3 Expression of TNF-α, IP-10 and IL-6 induced by different domains of MRP14, including MRP14 full length, EF-hand 1, EF-hand 2, CT and EF-hand1+2 in peritoneal macrophages. A: TNF-α; B: IP-10; C: IL-6. **P < 0.01 vs control group. |
1.5 mg/mL MRP8/MRP14刺激细胞,不同时间点收集细胞裂解物,Western blot检测激酶磷酸化变化,MRP8/MRP14能够显著诱导p38 MAPK、JNK磷酸化变化(图 4A),MRP8/MRP14刺激细胞1 h后p38、JNK即发生明显磷酸化变化,持续至2 h,灰度值分析(图 4B)差异具有统计学意义(P < 0.01);同时ERK激酶在MRP8/MRP14刺激早期10 min出现一个高峰,之后下降,在1 h再次发生磷酸化变化,持续至2 h,呈现“双峰”,差异具有统计学意义(P < 0.01)。
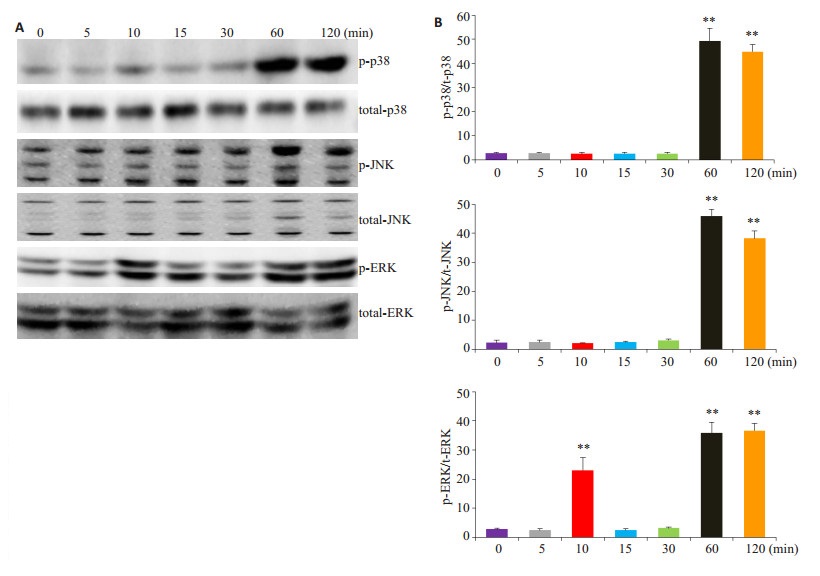
|
图 4 MRP8/MRP14诱导腹腔巨噬细胞p38 MAPK、JNK和ERK激酶的磷酸化变化 Figure 4 Phosphorylation of p38 MAPK, JNK and ERK in peritoneal macrophages induced by MRP8/MRP14. A: Western blotting for detecting phosphorylation of p38 MAPK, JNK and ERK; B: Gray values of p-p38, p-JNK, p-ERK determined by ImageJ software analysis and normalized with the gray value of total-p38, total-JNK and total-ERK, respectively. Data represent average from 3 independent tests. **P < 0.01 vs 0 min group. |
观察p38 MAPK、JNK和ERK激酶抑制剂对MRP8/MRP14诱导细胞因子表达的影响,与单纯MRP8/MRP14组相比,SB203580显著抑制了TNF-α(P < 0.01)、IP-10(P < 0.05)和IL-6(P < 0.05)的表达;SP600125显著抑制了TNF-α(P < 0.01)、IP-10(P < 0.05)的表达,对IL-6的表达则无影响(P > 0.05);ERK及其上游MEK1/2的抑制剂PD98059和U0126显著抑制IL-6的表达(P < 0.05),对TNF-α的表达无影响(P > 0.05),有趣的是ERK抑制剂反而增强了IP-10的表达(P < 0.05,图 5)
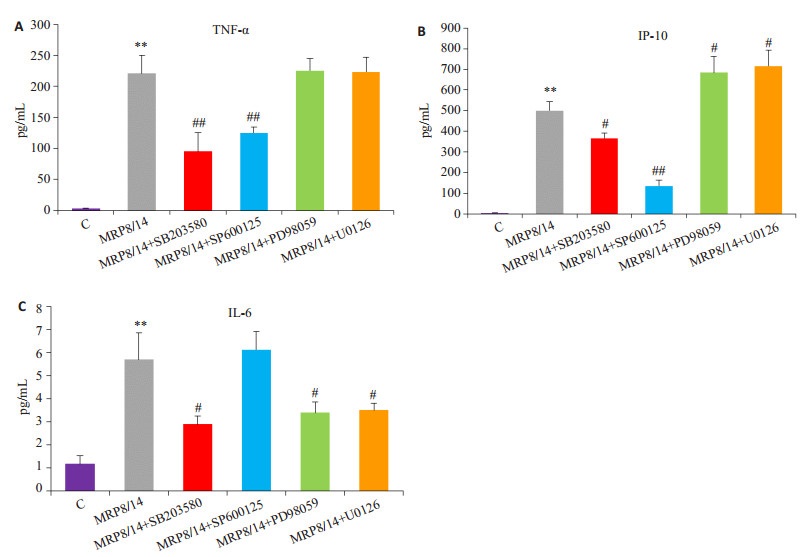
|
图 5 p38 MAPK、JNK和ERK激酶抑制剂对MRP8/MRP14诱导腹腔巨噬细胞TNF-α、IP-10和IL-6表达的影响 Figure 5 Effect of SB203580 (p38 MAPK inhibitor), SP600125 (JNK inhibitor) and PD98059, U0126 (ERK inhibitor) on TNF-α, IP-10 and IL-6 expression induced by MRP8/MRP14 in peritoneal macrophages. A: TNF-α; B: IP-10; C: IL-6. Data are from 3 independent tests, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs MRP8/MRP14 group. |
使用TLR4和RAGE受体拮抗剂预处理细胞鉴定MRP8/MRP14诱导细胞因子表达的受体,TLR4抑制剂TAK242显著抑制MRP8/MRP14诱导的TNF-α(P < 0.01)、IP-10(P < 0.01) 和IL-6(P < 0.05) 的表达,RAGE中和性抗体显著抑制IL-6(P < 0.05) 的表达(图 6)。
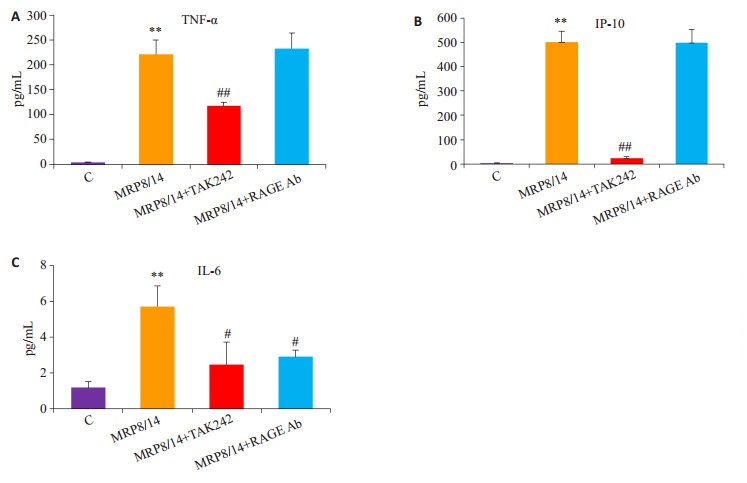
|
图 6 TLR4和RAGE受体拮抗剂对MRP8/MRP14诱导腹腔巨噬细胞TNF-α、IP-10和IL-6表达的影响 Figure 6 Effect of TLR4 and RAGE receptor antagonists on TNF-α, IP-10 and IL-6 expression induced by MRP8/ MRP14 in peritoneal macrophages. A: TNF-α; B: IP-10; C: IL-6. Data are from 3 independent tests, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs MRP8/14 group. |
巨噬细胞是参与机体天然免疫应答的重要细胞类型[16]。腹腔巨噬细胞是腹腔常驻巨噬细胞,是机体天然免疫系统的第一道防线[17]。本研究采用小鼠原代巨噬细胞,更接近体内真实情况,研究结果也更加准确。研究结果显示,MRP8/MRP14刺激小鼠腹腔巨噬细胞,能够显著诱导TNF-α、IP-10和IL-6的表达;同时MRP8/ MRP14能够诱导腹腔巨噬细胞p38 MAPK、JNK和ERK信号通路的活化; 进一步本研究使用通路特异性抑制剂从反面证实活化的信号通路与MRP8/MRP14诱导细胞因子表达的关系,结果提示TNF-α和IP-10的表达与p38 MAPK和JNK信号通路相关,而IL-6的表达则与p38 MAPK和ERK信号通路相关。
研究表明,细胞外MRP8/MRP14发挥功能主要依赖于与靶细胞表面特异性受体的结合。已报道MRP8/ MRP14的作用受体包括TLR4[8, 18]、RAGE[18-19]、CD36[20]等。本研究通过封闭细胞膜表面RAGE和TLR4受体,观察MRP8/MRP14诱导细胞因子表达情况,结果发现封闭TLR4受体,TNF-α、IP-10及IL-6的表达均受到显著抑制,而封闭RAGE受体,则只有IL-6的表达受到部分抑制,提示TNF-α、IP-10的表达仅与TLR4受体相关,而IL-6的表达则是由TLR4和RAGE受体共同介导的。MRP8和MRP14属于钙结合蛋白,他们结构的典型特征是二者都包含两个钙结合手型(EF-hand),即EF-hand 1和EF-hand 2, 而每一个EF-hand上存在一个钙结合位点(CB)[20]。MRP14则有一个较长的羧基末端。研究表明位于氨基末端的EF手型基序与钙离子结合力较强,与钙离子结合后,通过改变蛋白构象,从而暴露出与靶蛋白的结合位点,通过与靶蛋白作用而发挥生物学效应[21-23]。我们的研究结果显示,EF hand-1、EF hand-2及EF hand-1 +2结构域融合蛋白能够诱导TNF-α、P-10及IL-6的表达,这提示MRP蛋白以包含有Ca2+结合基序的结构域具有诱导细胞因子表达的生物学活性,MRP14对细胞因子表达的调控作用可能是Ca2+依赖性的,具体的机制我们需要采用钙离子螯合剂等其他方法进一步验证。
本研究采用的是细菌纯化的重组蛋白,关于原核蛋白LPS污染是大家比较争议的问题。因此我们设计了多方面实验来排除LPS的干扰:(1) 采用鲎试剂法检测重组蛋白中LPS含量,LPS < 0.25 EU/mL,基本可以忽略不计;(2) 多粘菌素B(PMB)除了作为革兰氏阴性菌感染治疗药物外[24],还可被用来清除各种试剂中的LPS,我们实验中使用20 mg/L PMB能够有效抑制100 ng/mL LPS的生物学活性,而这个LPS刺激浓度是蛋白中可能污染的LPS含量的上万倍,因此20 mg/L PMB能够充分有效的抑制重组蛋白中可能污染的LPS; (3) LPS热稳定性较高,在100 ℃下30 min仍可维持其活性,结果80 ℃加热30 min灭活了MRP8/MRP14重组蛋白的活性,而LPS则不受影响(实验数据未展示)。通过以上实验,我们可以排除融合蛋白LPS污染问题。
本研究筛选了MRP8/MRP14刺激腹腔巨噬细胞细胞因子表达谱,并探讨了p38 MAPK、JNK和ERK信号通路在其中的重要作用。本研究有助于我们深人认识MRP蛋白介导炎症反应的生物学机制。
| [1] | Ehrchen JM, Sunderkoetter C, Foell D, et al. The endogenous Toll-like receptor 4 agonist S100A8/S100A9 (calprotectin) as innate amplifier of infection, autoimmunity, and cancer[J]. J Leukoc Biol, 2009, 86(3): 557-66. DOI: 10.1189/jlb.1008647. |
| [2] | Vogl T, Ludwig S, Goebeler M, et al. MRP8 and MRP14 control microtubule reorganization during transendothelial migration of phagocytes[J]. Blood, 2004, 104(13): 4260-8. DOI: 10.1182/blood-2004-02-0446. |
| [3] | Pruenster M, Kurz AR, Chung K, et al. Extracellular MRP8/14 is a regulator of beta 2 integrin-dependent neutrophil slow rolling and adhesion[J]. Nat Commun, 2015, 6: 6915. DOI: 10.1038/ncomms7915. |
| [4] | Dale CS, Altier C, Cenac N, et al. Analgesic properties of S100A9 C-terminal domain: a mechanism dependent on Calcium Channel inhibition[J]. Fundam Clin Pharmacol, 2009, 23(4): 427-38. DOI: 10.1111/fcp.2009.23.issue-4. |
| [5] | Kerkhoff C, Klempt M, Kaever V, et al. The two calcium-binding proteins, S100A8 and S100A9, are involved in the metabolism of arachidonic acid in human neutrophils[J]. J Biol Chem, 1999, 274(46): 32672-9. DOI: 10.1074/jbc.274.46.32672. |
| [6] | Kerkhoff C, Nacken W, Benedyk M, et al. The arachidonic acid-binding protein S100A8/A9 promotes NADPH oxidase activation by interaction with p67phox and Rac-2[J]. FASEB J, 2005, 19(3): 467-9. |
| [7] | Foell D, Wittkowski H, Vogl T, et al. S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules[J]. J Leukoc Biol, 2007, 81(1): 28-37. |
| [8] | Vogl T, Tenbrock K, Ludwig S, et al. Mrp8 and Mrp14 are endogenous activators of Toll-like receptor 4, promoting lethal, endotoxin-induced shock[J]. Nat Med, 2007, 13(9): 1042-9. DOI: 10.1038/nm1638. |
| [9] | Gao S, Yang Y, Fu Y, et al. Diagnostic and prognostic value of myeloid-related protein complex 8/14 for sepsis[J]. Am J Emerg Med, 2015, 33(9): 1278-82. DOI: 10.1016/j.ajem.2015.06.025. |
| [10] | Ulas T, Pirr S, Fehlhaber B, et al. S100-alarmin-induced innate immune programming protects newborn infants from sepsis[J]. Nat Immunol, 2017, 18(6): 622-32. DOI: 10.1038/ni.3745. |
| [11] | Heinemann AS, Pirr S, Fehlhaber B, et al. In neonates S100A8/ S100A9 alarmins prevent the expansion of a specific inflammatory monocyte population promoting septic shock[J]. FASEB J, 2017, 31(3): 1153-64. DOI: 10.1096/fj.201601083R. |
| [12] | Perera C, Mcneil HP, Geczy CL. S100 calgranulins in inflammatory arthritis[J]. Immunol Cell Biol, 2010, 88(1): 41-9. DOI: 10.1038/icb.2009.88. |
| [13] | Nicaise C, Weichselbaum L, Schandene L, et al. Phagocyte-specific S100A8/A9 is upregulated in primary Sjogren's syndrome and triggers the secretion of pro-inflammatory cytokines in vitro[J]. Clin Exp Rheumatol, 2016, 35(1): 129-36. |
| [14] | Nishikawa Y, Kajiura Y, Lew JH, et al. Calprotectin induces IL-6 and MCP-1 production via Toll-Like receptor 4 signaling in human gingival fibroblasts[J]. J Cell Physiol, 2017, 232(7): 1862-71. DOI: 10.1002/jcp.v232.7. |
| [15] | Wang J, Vodovotz Y, Fan LY, et al. Injury-induced MRP8/MRP14 stimulates IP-10/CXCL10 in monocytes/macrophages[J]. FASEB J, 2015, 29(1): 250-62. DOI: 10.1096/fj.14-255992. |
| [16] | Decano JL, Mattson PC, Aikawa M. Macrophages in vascular inflammation: origins and functions[J]. Curr Atheroscler Rep, 2016, 18(6): 34. DOI: 10.1007/s11883-016-0585-2. |
| [17] | Fieren MW. The local inflammatory responses to infection of the peritoneal cavity in humans: their regulation by cytokines, macrophages, and other leukocytes[J]. Mediators Inflamm, 2012, 2012: 976241. |
| [18] | Ma L, Sun P, Zhang JC, et al. Proinflammatory effects of S100A8/ A9 via TLR4 and RAGE signaling pathways in BV-2 microglial cells[J]. Int J Mol Med, 2017, 40(1): 31-8. DOI: 10.3892/ijmm.2017.2987. |
| [19] | Hermani A, De Servi B, Medunjanin S, et al. S100A8 and S100A9 activate MAP kinase and NF-kappaB signaling pathways and trigger translocation of RAGE in human prostate cancer cells[J]. Exp Cell Res, 2006, 312(2): 184-97. DOI: 10.1016/j.yexcr.2005.10.013. |
| [20] | Wang YM, Fang C, Gan HY, et al. Platelet-derived S100 family member myeloidrelated protein-14 regulates thrombosis[J]. J Clin Invest, 2014, 124(5): 2160-71. DOI: 10.1172/JCI70966. |
| [21] | Itou H, Yao M, Fujita I, et al. The crystal structure of human MRP14 (S100A9), a Ca2+-dependent regulator protein in inflamm atory process[J]. J Mol Biol, 2002, 316(2): 265-76. DOI: 10.1006/jmbi.2001.5340. |
| [22] | Leukert N, Vogl T, Strupat K, et al. Calcium-dependent tetramer formation of S100A8 and S100A9 is essential for biological activity[J]. J Mol Biol, 2006, 359(4): 961-72. DOI: 10.1016/j.jmb.2006.04.009. |
| [23] | Stephan JR, Nolan EM. Calcium-induced tetramerization and zinc chelation shield human calprotectin from degradation by host and bacterial extracellular proteases[J]. Chem Sci, 2016, 7(3): 1962-75. DOI: 10.1039/C5SC03287C. |
| [24] | Jorge P, Perez-Perez M, Perez Rodriguez G, et al. A network perspective on antimicrobial peptide combination therapies: the potential of colistin, polymyxin B and nisin[J]. Int J Antimicrob Agents, 2017, 49(6): 668-76. DOI: 10.1016/j.ijantimicag.2017.02.012. |
 2017, Vol. 37
2017, Vol. 37

