2. 河北工程大学附属医院预防保健科,河北 邯郸 056002;
3. 浙江加州国际纳米技术研究院,浙江 杭州 310058;
4. 西安交通大学第一附属医院泌尿外科,陕西 西安 710061;
5. 西安交通大学基础医学院病原生物学与免疫学系,陕西 西安 710061;
6. 中国人民解放军第四军医 大学实验动物中心,陕西 西安 710032;
7. 中国军事医学科学院输血研究所,北京 100850
2. Department of Prevention and Healthcare, Affiliated Hospital of Hebei University of Engineering, Handan 056002, China;
3. Zhejiang-California International Nano Systems Institute, Hangzhou 310058, China;
4. Department of Urology, First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710061, China;
5. Department of Pathogenic Microbiology and Immunology, School of Basic Medical Sciences, Xi'an Jiaotong University Health Science Center, Xi'an 710061, China;
6. Laboratory Animal Center, Fourth Military Medical University, Xi'an 710032, China;
7. Institute of Blood Transfusion Medicine, Academy of Military Medical Sciences, Beijing 100850, China
恶性黑素瘤(MM)是常见的人类肿瘤之一。在美国,每年MM新发病例数约占所有肿瘤的4%~6% [1]。MM具有高度恶性、易侵袭转移的特点,目前尚无理想的治疗手段[2-3]。因此,针对MM,研究探索新的有效的治疗方法及策略具有重要的意义。近年来,基因治疗相关研究取得了许多进展。RNA干扰(RNAi)技术可特异沉默过表达基因使其成为肿瘤基因治疗的探索方向[4-5],也为MM的治疗探索带来了新的希望。但如何在体内靶向输送核酸药物是制约其向临床应用发展的瓶颈[6-7]。
目前已有研究证实,单链抗体-鱼精蛋白融合蛋白载体介导的siRNA靶向输送系统可有效将靶基因siRNA输送至特定肿瘤细胞,相对高效地沉默特定基因,抑制肿瘤细胞恶性进展,是潜在的肿瘤治疗新策略[8-10]。而针对MM,抗恶性黑素瘤单链抗体-鱼精蛋白融合蛋白的表达载体的相关研究尚未见报道。本项研究成功构建抗MM单链抗体-鱼精蛋白融合蛋白的表达载体(Anti-MM scFv-tP)并验证其表达效率及功能,现报告如下。
1 材料和方法 1.1 主要试剂PGEX4T-1质粒由中国军事医学科学院王字玲教授惠赠; PMD19-T载体试剂盒、高保真DNA聚合酶、限制性内切酶、T4 DNA连接酶均购自TaKaRa公司; 感受态大肠杆菌E.coli Top10由本实验室保存; 胶回收试剂盒和质粒提取试剂盒购自OMEGA公司。
1.2 通过PCR方法将Anti-MM scFv与鱼精蛋白片段tP进行连接根据基因质粒载体GST-scFv (构建于pGEX4T-1质粒),设计如下PCR引物:
正向引物ahm-s: CATATGCAGGTGCAGCTGTT GGATTCTGGGGCA
反向引物ahm-a: CTCGAGGCTACGACGACGA CGACGACGGCTACGCTGACGCTGACGATAATAA CGGCTACGGCTCTGGCTACGACGTTTGATCTC CAGCTTGGTCCC
所设计的反向引物中包含Truncted human protamine fragment(tP)序列:
5'-CGTAGCCAGAGCCGTAGCCGTTATTATCGTCAGCGTCAGCGTAGCCGTCGTCGTCGTCGTCGTAGC-3'
分别加人ddH2O 20 μL、2X Reaction Mix 25 μL、ahm-s (10 mol/L) 2 μL、ahm-a (10 μmol/L) 2 μL、Golden DNA Polymerase 0.5 μL、Template(pGEX4T1-scFv,0.5 μg/μL)0.5 μL,并按照94 ℃ 30 s,50 ℃ 30 s, 72 ℃ 60 s; 30个循环进行PCR扩增反应,将PCR产物进行1%的琼脂糖凝胶电泳。
1.3 融合蛋白基因载体的设计、构建与亚克隆采用TaKaRa pMD19-T载体试剂盒将PCR后获得的融合蛋白扩增产物进行T载体构建,取纯化后的PCR片段4 μL,分别加人试剂盒Solution Ⅰ 5 μL、pMD19-T Vector (50 ng/μL) 1 μL、T4 DNA Ligase (TaKaRa, 350 U/μL),在16 ℃下连接过夜,第2天转化感受态大肠杆菌E.coli Top10, 并涂布平板,于37 ℃培养过夜,待菌落生长后,挑取单菌落,37 ℃下于LB培养基中培养,提取培养菌质粒,根据基因载体构建所设计的酶切位点,加人Nde Ⅰ、XhoⅠ限制性内切酶进行双酶切鉴定。
1.4 可溶性融合蛋白表达载体的构建将原始Anti-MM scFv表达载体作为参考,GST融合的anti-MM scFv在以往其他研究小组试验中可以获得可溶性表达,因此我们仍采用此表达系统构建Anti-MM scFv-tP融合蛋白的表达系统。将构建好的T载体质粒与表达质粒载体pGEX-4T-1采用EcoRI及XhoⅠ进行双酶切,酶切结束后分别切胶回收基因克隆片段及酶切后的载体片段部分。将回收后的scFv-tP基因片段及pGEX-4T-1载体片段进行连接,在16 ℃下连接过夜,第2天转化感受态大肠杆菌E.coli Top10,并涂布平板,于37 ℃培养过夜,待菌落生长后,挑取单菌落,37 ℃下于LB培养基中培养,提取培养菌质粒,根据基因载体构建所设计的酶切位点,加人Nde Ⅰ、XhoⅠ限制性内切酶进行双酶切鉴定。
1.5 Anti-MM scFv-tP融合蛋白的表达将转染GST-scFv-tp表达载体的E.coli BL21菌株划线在含有氨苄青霉素(50 μg/mL)固体LB培养基,37 ℃培养过夜。挑取单菌落接至LB.液体培养基(50 μg/mL氨苄青霉素),37 ℃,250 r/min,培养过夜。活化后的菌液按1%接种量接至100 mL LB液体培养基(50 μg/mL氨苄青霉素),37 ℃,250 r/min, 培养至菌液A600=0.6, 加人IPTG至终浓度为0.8 mmol/L,继续诱导培养4 h。诱导完成后的菌液经离心处理,转速8000 r/min, 时间5 min; 射卓上清,沉淀用等体积只的1XSDS-PAGE loading buffer溶液重新悬浮,沸水浴5 min后经10 000 r/min, 5 min离心,上清进行12% SDS-PAGE电泳。电压140 V,时间40 min。电泳结束后,使用考马斯亮蓝G250染色1 h, 然后使用脱色液(10%乙醇,5%乙酸)脱色并查看蛋白条带。
1.6 Anti-MM scFv-tP融合蛋白的纯化将在菌液破碎上清中的可溶性融合GST表达的scFv-tP蛋白进行亲和纯化,采用GSH亲和介质直接将蛋白容易上样,之后以PBS冲洗介质,此时,GST-scFv-tP融合蛋白结合于GSH亲和介质上,在其他杂蛋白被冲洗掉。加人一定单位量的凝血酶室温下进行酶切,4 h左右,PBS冲洗介质,并收集洗脱下的蛋白溶液,采用超滤管进行浓缩。将浓缩后的蛋白溶液通过苯甲脒柱去除凝血酶,收集洗脱后的蛋白,再进行超滤浓缩。
1.7 凝胶阻滞电泳迁移率变动分析EMSA采用凝胶阻滞电泳迁移率变动分析EMSA技术检测Anti-MM scFv-tP与siRNA的结合活性。由于tP片段带正电荷可以携载一定量带负电荷的核酸,因而在进行凝胶电泳时会呈现迁移率下降的条带,携载不同量的核酸表现出不同的迁移条带,而携载的核酸越多蛋白的迁移条带越慢。用biotin标记siRNA并与融合蛋白分别以3:1、6:1、9:1比例混合,经电泳后转膜采用avidin标记的HRP进行化学发光曝光。
1.8 细胞及细胞培养MM细胞系LiBr细胞由第四军医大学高田文教授惠赠。LiBr细胞用含10%胎牛血清(Invitrogen)的DMEM(Invitrogen)培养液,置于37 ℃、5% CO2的培养箱中恒温恒湿培养,取对数生长期的细胞进行实验。
1.9 流式细胞术和免疫荧光将LiBr细胞词养在12孔板中,设计3个孔细胞为不染色对照,另外3个进行细胞染色。待细胞贴壁长满,选择3孔分别加人FITC标记的scFv-tP蛋白对细胞进行免疫染色,染色30~60 min。然后分别将细胞吹打下来,并用PBS各离心洗涤3次,流式细胞仪检测FITC荧光。
进一步采用激光共聚焦对融合蛋白结合LiBr细胞特异性抗原进行观察。采用TRITC标记scFv-tP融合蛋白,溶解TRITC在DMSO中配置为1 mg/mL浓度。边轻微振荡边慢慢加人35 μL TRITC到1 mL 6 mg/mL的scFv-tP溶液中,并立即混匀。避光室温孵育2h。透析除去未反应的TRITC。制备LiBr细胞爬片,六孔板中各放置盖玻片,在37 ℃ CO2细胞培养箱中培养待细胞贴满50%左右。PBS冲洗玻片3遍后用4%多聚甲醛溶液浸泡10 min固定细胞。PBS继续反复冲洗3遍。用5%BSA溶液于4 ℃下过夜封闭固定后的玻片。采用1%的BSA溶液1: 1000稀释标记后的scFv-tP-TRITC。于4 ℃下scFv-tP-TRITC溶液与细胞玻片共孵育过夜。PBS溶液反复冲洗数次。采用1:1000稀释DAPI染料,并于37 ℃下孵育玻片30 min对细胞进行复染。之后采用PBS缓冲液反复冲洗数次,进行激光共聚焦进行检测。
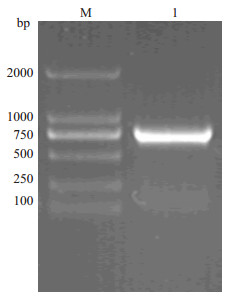
2 结果 2.1 通过PCR方法将Anti-MM scFv与鱼精蛋白片段tP进行连接结果显示,807 bp处清晰可见的明亮条带,与融合蛋白理论分子相符合,因此初步确定扩增获得抗黑色素瘤单链抗体scFv-tP基因序列(图 1)。
|
图 1 设计引物将Anti-MM scFv与鱼精蛋白片段tP进行连接 Figure 1 Agarose gel electrophoresis of the recombinant Anti-MM scFv-tp gene sequence M: Marker; 1: Anti-MM scFv-tp. |
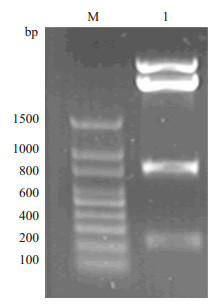
结果显示,双酶切后在807 bp处有一条明亮条带,与分子理论值及PCR基因扩增结果相符,因此初步认定anti-MM scFv-tP基因克隆载体构建成功(图 2); 同时将构建好的载体交予测序公司进行测序鉴定并经过序列比对,与理论序列完全符合,分析表明,Anti-MM scFv-tP基因构建基本顺利完成。
|
图 2 Anti-MM scFv-tP融合蛋白构建至pMD19-T载体后进行酶切电泳鉴定 Figure 2 Restriction enzyme analysis of the recombinant plasmid pMD19-T-Anti-MM scFv-tP by agarose gel electrophoresis. M: Marker; 1: Anti-MM scFv-tP. |
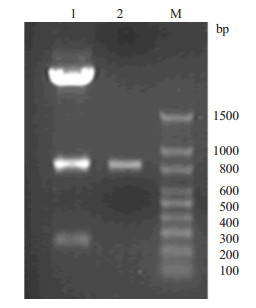
结果显示双酶切后在807 bp处有一条明亮条带(泳道1),与分子理论值及PCR基因扩增结果相符(泳道2),因此初步认定Anti-MM scFv-tP表达载体构建成功,同时将构建好的载体交予测序公司进行测序鉴定并经过序列比对,与理论序列完全符合。分析表明,Anti-MM scFv-tP基因成功构建至表达载体pGEX4T-1中。
2.4 Anti-MM scFv-tP融合蛋白的表达结果显示,诱导后的泳道在52 000处有明显诱导表达条带出现,从相对分子质量上符合GST融合表达的scFv-tP蛋白,分析表明,scFv-tP GST融合蛋白已成功表达(图 4)。
|
图 3 可溶性scFv-tP融合表达载体构建的酶切验证 Figure 3 Restriction enzyme analysis of the GSTfusion protein expression vector by agarose gel electrophoresis. 1: Anti-MM scFv-tP expression vector; 2: Positive control; M: Marker. |

|
图 4 GST融合的scFv-tP蛋白的诱导表达 Figure 4 Polyacrylamide gel electrophoresis for verifying the expression of GST-fusion scFv-tP protein. |
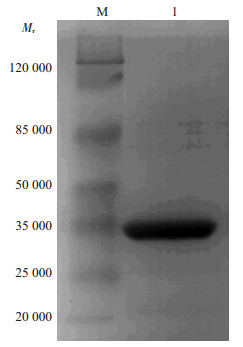
结果显示,经两步亲和纯化后获得较纯的scFv-tP蛋白(图 5)。
|
图 5 经酶切纯化后的scFv-tP蛋白 Figure 5 Polyacrylamide gel electrophoresis for verifying the expression of highly purified GST-fusion scFv-tP protein. M: Marker; 1: purified scFv-tp. |
采用凝胶阻滞电泳迁移率变动分析EMSA技术检测Anti-MM scFv-tP与siRNA的结合活性。结果显示,泳道1、2、3表现出一定的位置差异,相对而言泳道1条带迁移较泳道2快,说明1:3结合形成的分子复合体较1:6小,因此电泳中呈现出迁移率差异,而1:6与1:9无差异。分析表明,Anti-MM scFv-tP与siRNA以1:6混合时蛋白与核酸结合已达到饱和状态,分子复合体分子量已基本一致,同时本实验证明所表达的Anti-MM scFv-tP蛋白与siRNA有明显的结合与携载能力(图 6)。
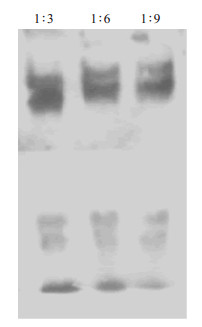
|
图 6 EMSA分析Anti-MM scFv-tP携载siRNA的能力 Figure 6 The anti-MM scFv-tP fusion protein retained siRNA binding ability. |
用荧光分子将scFv-tP蛋白进行标记后与LiBr细胞株进行细胞表面抗原结合活性验证,分别采用流式细胞术检测和共聚焦显微镜观察蛋白与细胞的结合情况,以证明Anti-MM scFv-tP可以有效与LiBr细胞表面特异性抗原进行结合。结果显示(图 7),A-1、A-2、A-3为对照组,B-1、B-2、B-3为标记组,可以看出细胞有明显FITC荧光信号。分析表明,scFv-tP蛋白与LiBr细胞可特异性结合。图 8示,除DAPI所染细胞核为蓝色外,LiBr细胞表面为一圈清晰的红色荧光,通过100倍放大可以清晰看到,TRITC所发射红色荧光结合在细胞膜表面,同时可以看出,细胞膜其他部位仍有较为密集的点状红色荧光分布。通过共聚焦显微镜可以看到清晰的scFv-tP-TRITC结合至细胞膜表面,从而在细胞膜表面有一圈清晰的红色荧光出现,由于共聚焦显微镜为分层扫描模式,因而同时在细胞膜的其他部位仍可以看到蛋白与膜表面特异性受体的结合状态。分析表明,Anti-MM scFv-tP可以有效与LiBr细胞表面特异性抗原进行结合。
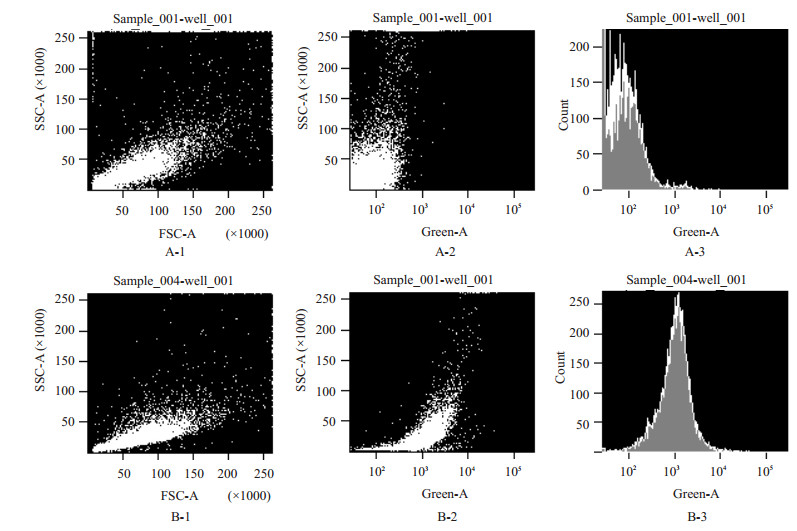
|
图 7 FITC标记scFv-tP与LiBr细胞共孵育后进行流式检测 Figure 7 Flow cytometry analysis showing the fusion protein could bind to LiBr cell specifically. A-1、A-2、A-3: control; B-1、B-2、B-3: FITC-labeled scFv-tP. |
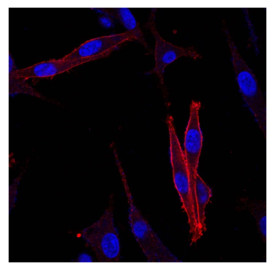
|
图 8 TRITC标记的scFv-tP融合蛋白与LiBr细胞特异性结合的共聚焦观察 Figure 8 Confocal microscopy showing tight and specific binding of the fusion protein to cell membrane (Original magnification: ×100). |
采用不同浓度FITC标记的siRNA与scFv-tP进行混合,分别与LiBr细胞及DU145细胞进行混合孵育。结果如图 9示,由于恶性黑色素瘤LiBr细胞表面具有scFv-tP所特异性识别的抗原,因而在单链抗体结合在细胞表面后,肿瘤细胞对蛋白具有较强的内吞作用,在较高浓度孵育后,细胞对携载siRNA的单链抗体及siRNA表现出较强的内化活性,一方面说明单链抗体与细胞膜表面蛋白的特异性结合,另一方面表现出恶性黑色素瘤细胞对于结合分子的较强内吞作用。
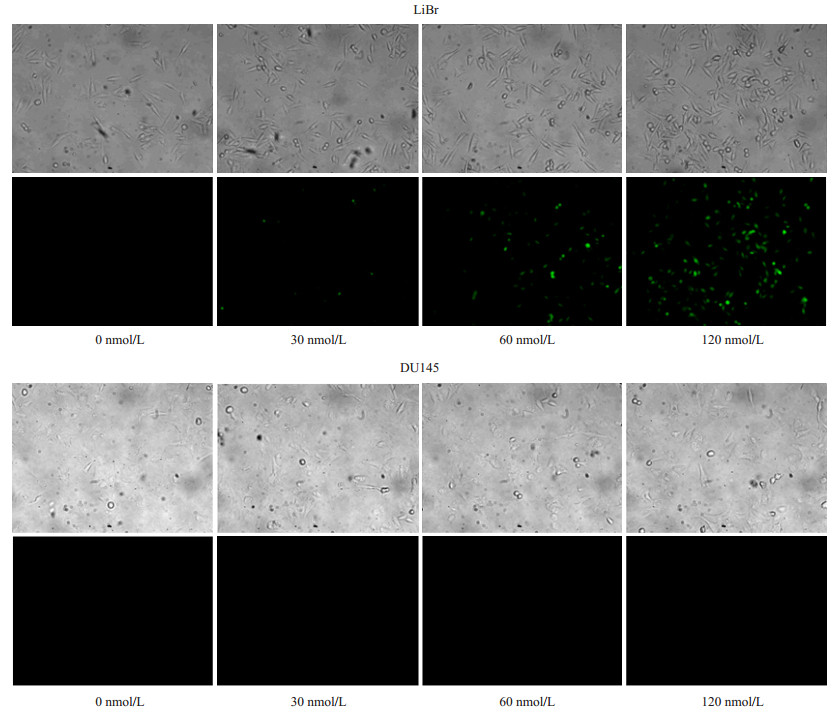
|
图 9 scFv-tP携载不同浓度FITC-siRNA LiBr细胞内化活性的验证 Figure 9 Efficient uptake of scFv-tP-FITC-siRNA in the MM LiBr cells. |
目前,肿瘤基因治疗的策略之一是特异、高效地敲低与肿瘤生长和转移相关的过表达基因。采用RNAi技术沉默肿瘤细胞中异常过表达的基因从而抑制肿瘤细胞恶性进展已成为肿瘤基因治疗的重要策略[5-6, 11-13]。然而,siRNA的体内靶向输送是制约采用RNAi方法的基因治疗向临床应用迈进的主要障碍[14-15]。为突破这个瓶颈,研究人员设计了多种靶向输送siRNA的策略16-19。其中,具有抗原识别导向能力的单链抗体和具有核酸结合能力的鱼精蛋白的单链抗体融合蛋白具有良好的靶向输送能力,成为siRNA体内粑向输送载体的探索方向之一[18, 20-21]。而针对MM,抗恶性黑素瘤单链抗体-鱼精蛋白融合蛋白的表达载体的相关研究尚未见报道。
神经节苷脂在MM细胞表面大量表达而在绝大多数正常组织不表达,是MM —个较为理想的抗原表位[22-23],根据其糖基结合唾液酸分子数目及部位的不同分类为GD和GM等[24]。以往研究显示,针对神经节苷脂抗原表位的抗MM单克隆抗体显示出良好的靶向特异性[25-26]。因此我们选择以神经节苷脂作为靶点构建抗恶性黑素瘤单链抗体-鱼精蛋白融合蛋白的siRNA靶向输送载体。
鱼精蛋白是一种带正电荷的碱性蛋白,可与带负电荷的核酸分子紧密结合,具有很强的核酸结合能力。本研究通过PCR方法将鱼精蛋白截短片段序列与抗黑色素瘤细胞表面抗原单链抗体基因相连接,成功设计并构建了抗恶性黑素瘤单链抗体-鱼精蛋白片段GST融合蛋白的表达载体(Anti-MM scFv-tP); 并实现了在大肠杆菌中该融合蛋白的可溶性表达,经酶切等一系列纯化后,获得了较纯的scFv-tP蛋白。接下来通过凝胶阻滞电泳迁移率变动分析EMSA技术检测验证该纯化的Anti-MM scFv-tP蛋白与siRNA有明显的结合与携载能力; 流式细胞术检测和共聚焦显微观察也证明荧光分子标记的scFv-tP蛋白可以有效与LiBr细胞表面特异性抗原进行结合; 进一步采用不同浓度FITC标记的siRNA与scFv-tP进行混合,分别与LiBr细胞及DU145细胞进行混合孵育,显示该Anti-MM scFv-tP蛋白对LiBr细胞有较强的内化活性,充分证明Anti-MM scFv-tP蛋白可靶向识别结合并进人LiBr细胞。这些结果为后续进一步应用该单链抗体融合蛋白进行MM的基因治疗探索研究提供了有效的实验室依据。但是仍有一些问题有待解决,如该单链抗体融合蛋白沉默靶向基因的最佳效应浓度和作用时间等,都需要进行进一步的研究验证。
综上所述,本研究构建的抗恶性黑色素瘤单链抗体-鱼精蛋白融合蛋白表达载体可稳定表达具有siRNA结合携载能力和LiBr细胞靶向识别结合能力的Anti-MM scFv-tP蛋白,为后续进一步研究该单链抗体融合蛋白靶向载体携载siRNA在体内外抑制恶性黑色素瘤恶丨生进展,最终用于恶性黑色素瘤治疗策略奠定了理论及实验室基础。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA CancerJClin, 2017, 67(1): 7-30. DOI: 10.3322/caac.21387. |
| [2] | Wick MR, Gru AA. Metastatic melanoma: Pathologic characterization, current treatment, and complications of therapy[J]. Semin Diagn Pathol, 2016, 33(4): 204-18. DOI: 10.1053/j.semdp.2016.04.005. |
| [3] | Tang T, Eldabaje R, Yang L. Current status of biological therapies for the treatment of metastatic melanoma[J]. Anticancer Res, 2016, 36(7): 3229-41. |
| [4] | Heo JR, Kim NH, Cho J, et al. Current treatments for advanced melanoma and introduction of a promising novel gene therapy for melanoma (Review)[J]. Oncol Rep, 2016, 36(4): 1779-86. DOI: 10.3892/or.2016.5032. |
| [5] | de Fougerolles A, Vornlocher HP, Maraganore J, et al. Interfering with disease: a progress report on siRNA-based therapeutics[J]. Nat Rev Drug Discov, 2007, 6(6): 443-53. DOI: 10.1038/nrd2310. |
| [6] | Deng Y, Wang CC, Choy KW, et al. Therapeutic potentials of gene silencing by RNA interference: principles, challenges, and new strategies[J]. Gene, 2014, 538(2): 217-27. DOI: 10.1016/j.gene.2013.12.019. |
| [7] | Xin Y, Huang M, Guo WW, et al. Nano-based delivery of RNAi in cancertherapy[J]. Mol Cancer, 2017, 16(1): 134. DOI: 10.1186/s12943-017-0683-y. |
| [8] | Li X, Stuckert P, Bosch I, et al. Single-chain antibody-mediated gene delivery into ErbB2-positive human breast cancer cells[J]. Cancer Gene Ther, 2001, 8(8): 555-65. DOI: 10.1038/sj.cgt.7700337. |
| [9] | Dou S, Yao YD, Yang XZ, et al. Anti-Her2 single-chain antibody mediated DNMTs-siRNA delivery for targeted breast cancer therapy[J]. J Control Release, 2012, 161(3): 875-83. DOI: 10.1016/j.jconrel.2012.05.015. |
| [10] | Khan I, Zakaria MK, Kumar M, et al. A novel placental like alkaline phosphatase promoter driven transcriptional silencing combined with single chain variable fragment antibody based virosomal delivery for neoplastic cell targeting[J]. J Transl Med, 2015, 13: 254. DOI: 10.1186/s12967-015-0602-1. |
| [11] | Carthew RW, Sontheimer EJ. Origins and Mechanisms of miRNAs and siRNAs[J]. Cell, 2009, 136(4): 642-55. DOI: 10.1016/j.cell.2009.01.035. |
| [12] | Rietwyk S, Peer D. Next-generation lipids in RNA interference therapeutics[J]. ACSNano, 2017, 11(8): 7572-86. |
| [13] | Jose A, Labala S, Ninave KM, et al. Effective akin xancer treatment by topical co-delivery of curcumin and STAT3 siRNA using cationic liposomes[J]. AAPS PharmSciTech, 2017. DOI: 10.1208/s12249-017-0833-y.[Epubaheadofprint]. |
| [14] | Tatiparti K, Sau S, Kashaw SK, et al. siRNA delivery strategies: A comprehensive review of recent developments[J]. Nanomaterials (Basel), 2017, 7(4): E77. DOI: 10.3390/nano7040077. |
| [15] | Mishra DK, Balekar N, Mishra PK. Nanoengineered strategies for siRNA delivery: from target assessment to cancer therapeutic efficacy[J]. Drug Deliv Transl Res, 2017, 7(2): 346-58. DOI: 10.1007/s13346-016-0352-5. |
| [16] | Landen CJ, Chavez-Reyes A, Bucana C, et al. Therapeutic EphA2 gene targeting in vivo using neutral liposomal small interfering RNAdelivery[J]. Cancer Res, 2005, 65(15): 6910-18. DOI: 10.1158/0008-5472.CAN-05-0530. |
| [17] | Wang X, Skelley L, Cade R, et al. AAV delivery of mineralo-corticoid receptor shRNA prevents progression of cold-induced hypertension and attenuates renal damage[J]. Gene Ther, 2006, 13(14): 1097-103. DOI: 10.1038/sj.gt.3302768. |
| [18] | Guruprasath P, Kim J, Gunassekaran GR, et al. Interleukin-4 receptor-targeted delivery of Bcl-xL siRNA sensitizes tumors to chemotherapy and inhibits tumor growth[J]. Biomaterials, 2017, 142: 101-11. DOI: 10.1016/j.biomaterials.2017.07.024. |
| [19] | Sezlev BD, Rodriguez-Cabello JC, Uludag H, et al. Construction of a PLGA based, targeted siRNA delivery system for treatment of osteoporosis[J]. J Biomater Sci Polym Ed, 2017, 28(16): 1859-73. DOI: 10.1080/09205063.2017.1354675. |
| [20] | Baumer N, Berdel WE, Baumer S. Immunoprotein-mediated siRNA delivery[J]. MolPharm, 2017, 14(5): 1339-51. |
| [21] | Su Y, Yu L, Liu N, et al. PSMA specific single chain antibody-mediated targeted knockdown of Notch1 inhibits human prostate cancer cell proliferation and tumor growth[J]. Cancer Lett, 2013, 338(2): 282-91. DOI: 10.1016/j.canlet.2013.05.035. |
| [22] | Chapman PB, Wu D, Ragupathi G, et al. Sequential immunization of melanoma patients with GD3 ganglioside vaccine and antiidiotypic monoclonal antibody that mimics GD3 ganglioside[J]. Clin Cancer Res, 2004, 10(14): 4717-23. DOI: 10.1158/1078-0432.CCR-04-0345. |
| [23] | Ohkawa Y, Miyazaki S, Hamamura K, et al. Ganglioside GD3 enhances adhesion signals and augments malignant properties of melanoma cells by recruiting integrins to glycolipid-enriched microdomains[J]. J Biol Chem, 2010, 285(35): 27213-23. DOI: 10.1074/jbc.M109.087791. |
| [24] | Schnaar RL. Gangliosides of the Vertebrate Nervous System[J]. J Mol Biol, 2016, 428(16): 3325-36. DOI: 10.1016/j.jmb.2016.05.020. |
| [25] | Moutel S, Birkle S, Laurence V, et al. Generation and characterization of a mouse single-chain antibody fragment specific for disialoganglioside (GD2)[J]. Hybridoma, 1997, 16(4): 335-46. DOI: 10.1089/hyb.1997.16.335. |
| [26] | Prapa M, Caldrer S, Spano C, et al. A novel anti-GD2/4-1BB chimeric antigen receptor triggers neuroblastoma cell killing[J]. Oncotarget, 2015, 6(28): 24884-94. DOI: 10.18632/oncotarget.v6i28. |
 2017, Vol. 37
2017, Vol. 37

