2. 广州医科大学附属第二医院, 血液实验室, 广东 广州 510260
2. Hematology Laboratory, Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260
Bcr/Abl激酶抑制剂伊马替尼在慢性粒细胞白血病(CML)的治疗上取得较好的效果[1-2],但部分患者存在对伊马替尼原发或继发耐药现象,机制包括依赖或者不依赖Bcr/Abl [3-4]。随后研发的第2代及第3代Bcr/Abl激酶抑制剂如尼罗替尼、普纳替尼等也不能完全解决这个问题[1-2, 5],有必要探索新的治疗方法。研究发现多种肿瘤的发病与泛素依赖途径的失调有关[6-7],蛋白酶体抑制剂硼替佐米可以通过对泛素化通路的阻断,诱导多种肿瘤细胞凋亡[8],有研究表明[9]硼替佐米能够抑制对伊马替尼敏感或耐药的Bcr/Abl阳性细胞的生长并诱导这些细胞凋亡,有希望为耐伊马替尼CML提供新的治疗途径。目前已有一些这方面的研究[9-10],但对硼替佐米诱导CML细胞凋亡的机理未完全明了[11]。我们希望通过比较硼替佐米单独或联合伊马替尼对伊马替尼耐药的CML细胞株K562(K562R)的杀伤作用,探索其作用机制,为难治性耐药CML的治疗提供依据。
1 材料和方法 1.1 材料K562细胞株为本实验室保存,培养于含10%胎牛血清的RPMI 1640培养液,每2~3 d换液,细胞铺满瓶底时传代。胎牛血清(Gibco),CCK-8试剂盒(DOJINDO),Annexin V-FITC/PI试剂盒(Sigma),Mcl-1, Bcr/Abl,Bcl-2抗体(Cell Signaling);酶标仪(TECAN INFINITEM200),流式细胞仪(BECKMAN NAVIOS)。硼替佐米为西安杨森公司产品,用生理盐水配成l mg/mL;伊马替尼为瑞士诺华公司产品,以二甲基亚砜(DMSO)溶解成10 mmol/L;两药均-20 ℃冻存,临用前用培养液稀释至相应浓度。
1.2 方法 1.2.1 K562R细胞系的建立取对数生长期的K562细胞,接种于培养瓶中,参照文献[12]用浓度梯增法建立耐伊马替尼K562细胞系:伊马替尼以初始浓度0.01 μmol/L与K562细胞共培养,并以0.01~0.04 μmol/L浓度递增,观察细胞生长情况,当加入一定浓度药物后细胞的形态和生长不受影响时即为耐药,伊马替尼浓度逐步梯增至2 μmol/L,并使K562细胞稳定存活,建立耐伊马替尼K562细胞系。
1.2.2 CCK-8法检测细胞增殖抑制取对数生长期细胞接种于96孔板,每孔2×104个细胞。设空白组(仅加培养液)、对照组(不加药物)和各不同浓度的药物处理组,每组设3个复孔,每孔容积100 μL。分别培养24 h和/或48 h,在终止培养前2~4 h,每孔加CCK-8 10 μL。用酶标仪读取490 nm处吸光度值(A值)。按下列公式计算细胞活力,细胞活力=(药物处理组A值-空白组A值)/(对照组A值-空白组A值)×100%。实验重复3次。计算半数抑制浓度(IC50)值。
1.2.3 细胞凋亡分析凋亡实验分为3组:(1)对照组(不加药物);(2)硼替佐米单独作用组:0、12.5、25、50、100 nmol/L硼替佐米单独作用K562R细胞48 h;(3)硼替佐米与伊马替尼联合作用组:以0、12.5、25、50、100 nmol/L硼替佐米联合2 μmol/L伊马替尼作用K562R细胞48 h。流式细胞术检测Annexin V阳性细胞:将以上方法处理后的K562R细胞收集、洗涤,根据Annexin V-FITC/PI试剂盒操作说明,加入Annexin V-FITC及碘化丙醇(PI),避光室温孵育15 min,流式细胞仪定量分析。判断标准:在双变量流式细胞仪的散点图上,左下象限显示正常细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞,取右上象限和右下象限的总和(即Annexin V阳性细胞群)计为凋亡细胞[13]。
1.2.4 Western blotting检测Mcl-1、Bcl-2、Bcr/Abl表达细胞密度调整至2×105/mL,以0、25、50、100 nmol/L硼替佐米作用K562R细胞48 h后收集细胞,加入RIPA裂解细胞,超声破碎,离心取上清。用BAC蛋白定量试剂盒,在酶标仪562 nmol/L波长定量蛋白浓度。待测蛋白与5×上样缓冲液混合后,100 ℃加热5 min使蛋白变性。上样后100~130 V恒压电泳约90 min,200 mA恒流转膜约180 min。取出NC膜,5%牛奶摇床室温封闭1 h,加入Mcl-1、Bcl-2、Bcr/Abl等一抗室温摇床孵育2 h或4 ℃过夜,PBST洗3次,二抗室温摇床孵育1.5 h,曝光。
1.3 统计学分析用SPSS19.0软件进行统计分析,同一时间点两组间比较采用t检验,多重两两比较采用非参数检验,P<0.05为有统计学意义。
2 结果 2.1 K562R细胞的判定不同浓度的伊马替尼(0.25~32 μmol/L)分别与K562和K562R细胞作用48 h后,CCK-8法检测到各浓度伊马替尼对K562细胞均有杀伤作用,随着伊马替尼浓度增加,K562细胞的活性明显降低;CCK-8法检测到伊马替尼在0.25~2 μmol/L浓度时,K562R的细胞活性仍可达90%,形态无明显变化,当伊马替尼浓度>4 μmol/L后,细胞活性才明显降低。伊马替尼对K562R细胞的杀伤作用明显弱于K562细胞。用PRISM软件计算,伊马替尼作用K562R细胞和K562细胞48 h后的IC50分别为7.457(95可信区间6.338~8.774)μmol/L及0.2342(95可信区间0.1175~0.4668)μmol/L,耐药倍数为31.8倍,说明该细胞株为耐药细胞株。
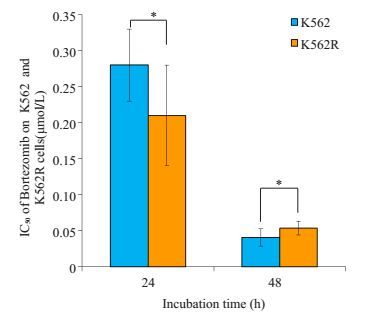
2.2 硼替佐米对K562和K562R细胞的增殖抑制作用不同浓度硼替佐米(12.5 nmol/L~3.2 μmol/L)分别作用K562和K562R细胞24、48 h后,CCK-8法测得各浓度的硼替佐米对两种细胞均有增殖抑制作用,与药物浓度成正比(P<0.05)。硼替佐米作用48 h后两种细胞的活性明显小于作用24 h细胞活性,即增殖抑制作用与作用时间成正比(P<0.05)。硼替佐米作用K562和K562R细胞24 h后,IC50值分别为0.28±0.05 μmol/L、0.21±0.07 μmol/L;硼替佐米作用K562和K562R细胞48 h后的IC50值分别为40.75±12.13 nmol/L、53.75±9.45 nmol/L,比较两组间细胞增殖抑制作用无统计学意义(P>0.05),表明硼替佐米和伊马替尼对K562R细胞无交叉耐药性(图 1)。
|
图 1 硼替佐米对K562和K562R细胞的增殖抑制作用 Figure 1 Effects of bortezomib on proliferation of K562 cells and K562R cells. *P < 0.05 |
用0~100 nmol/L硼替佐米单独或联合2 μmol/L伊马替尼处理K562R细胞48 h后,流式细胞仪测定凋亡细胞的百分数。结果显示,对照组细胞培养48 h后未见明显凋亡,而硼替佐米单独作用组可使K562R细胞凋亡且呈浓度依赖,100 nmol/L硼替佐米作用48 h后凋亡率可达60%。硼替佐米与伊马替尼联合作用后凋亡率升高更明显,100 nmol/L硼替佐米联合2 μmol/L伊马替尼作用48 h后凋亡率达90%以上,联合作用组与单独作用组间差别有显著统计学意义(P<0.05)。
2.4 Western blotting检测Bcr/Abl、Mcl-1、Bcl-2表达用不同浓度硼替佐米作用K562R细胞48 h后,Western blotting检测Mcl-1、Bcl-2、Bcr/Abl表达。随着硼替佐米药物浓度升高,K562R细胞的Mcl-1蛋白水平表达下调并诱导Mcl-1的切割,Bcr/Abl蛋白逐渐被抑制,Bcl-2的表达无变化。
3 讨论对Bcr/Abl激酶抑制剂伊马替尼耐药的CML治疗是目前的难题。开发新的药物,克服Bcr/Abl激酶抑制剂耐药是中外学者面临的共同挑战[4, 14]。本研究成功建立K562R细胞系,为伊马替尼耐药作用及机制研究奠定基础。
硼替佐米是一种新型蛋白酶体抑制剂,对多种白血病细胞株均有诱导凋亡的作用,并且能增强常规化疗药物的细胞毒作用[15-16]。目前关于蛋白酶体抑制剂治疗伊马替尼耐药CML的报道不多。Gatto等[9]发现硼替佐米能够抑制对伊马替尼敏感或耐药的Bcr/Abl阳性细胞生长,并诱导这些细胞凋亡。研究表明,硼替佐米单独或联合伊马替尼对伊马替尼耐药细胞株K562/G01具有增殖抑制和诱导凋亡作用[10, 17]。我们实验结果显示硼替佐米对K562细胞及K562R细胞均有杀伤作用,且随着作用浓度、时间的增加而增强;硼替佐米和伊马替尼对K562R细胞无交叉耐药性,与Gatto S等的结果一致。
Dai等[18]发现亚毒性浓度的硼替佐米和周期依赖蛋白激酶抑制剂Flavopiridol联合作用于CML细胞K562和LAMA84,可诱导凋亡。单独使用硼替佐米或Flavopirido,只有很微小的细胞毒作用,24 h细胞凋亡率小于25%;而联合使用两种药物,24 h细胞凋亡率达到了50%,在培养48 h后,几乎所有的细胞都凋亡。本研究结果显示硼替佐米可使K562R细胞凋亡且呈浓度依赖;硼替佐米与伊马替尼联合作用后K562R细胞凋亡率明显升高。证实硼替佐米对K562R细胞株不仅有增殖抑制,而且有诱导凋亡的作用;硼替佐米与伊马替尼联合使用尚具有协同作用,能够克服K562R对伊马替尼耐药性。
目前硼替佐米诱导伊马替尼耐药细胞凋亡的机理尚未完全明了。Bcr/Abl是CML致病的关键,Bcr/Abl蛋白的过表达在CML的发病中起重要作用[19];在伊马替尼耐药细胞中,Bcr/Abl表达明显升高[20]。所以药物疗效很大程度上取决于Bcr/Abl蛋白被抑制的程度。Dai [18]研究发现硼替佐米诱导K562细胞凋亡途径有两种,一种依赖Bcr/Abl;另一种不依赖Bcr/Abl,包括抑制NF-κB与DNA结合活性、促进SEK1/MKK4等多种蛋白激酶的磷酸化等。我们研究发现,硼替佐米作用于K562R细胞48 h后,Bcr/Abl蛋白水平下降,提示硼替佐米可通过抑制Bcr/Abl表达的途径,达到诱导K562R细胞凋亡的目的。
Mcl-1是一种抗凋亡蛋白,可以保护肿瘤细胞免受自发和化疗诱导的凋亡[21];Mcl-1半衰期短,对肿瘤细胞内外环境因素的变化能做出快速反应[22]。Mcl-1存在Asp127、Asp157两个剪切位点,其中Asp127位点剪切后产生的28 000片段可引起细胞凋亡[23]。硼替佐米可诱导耐伊马替尼细胞凋亡,但Bcr/Abl、Mcl-1表达等机制尚未有研究[16-17]。有学者发现在硼替佐米诱导的神经胶质瘤细胞凋亡中,Mcl-1切割或下调起着重要作用[24-25]。研究发现硼替佐米和干扰素对神经胶质瘤细胞的增殖抑制作用是通过细胞凋亡途径,而细胞凋亡则是通过增加NOXA表达和Mcl-1切割的途径诱导的[24]。Mcl-1在凋亡中起关键作用,Mcl-1下调可增强硼替佐米诱导神经胶质瘤细胞凋亡的敏感性[25]。我们的实验发现,使用25~100 nmol/L硼替佐米处理K562R细胞48 h后,Mcl-1的水平下调,并被切割为42 000和28 000片段。
综上所述,本研究证实硼替佐米能够有效诱导K562R细胞凋亡;与伊马替尼联合使用,对K562R的凋亡诱导效果显著增强。本研究亦发现硼替佐米除了通过下调Bcr/Abl的表达诱导凋亡外,尚可能通过抗凋亡蛋白Mcl-1参与诱导凋亡,包括Mcl-1的水平下调以及Mcl-1的切割。该研究为临床拓展硼替佐米治疗伊马替尼耐药的CML提供新的理论依据,蛋白酶抑制剂可能对CML具有新的治疗潜力。而关于该药物在伊马替尼耐药CML中的临床应用以及确切的作用机制,尚有待于深入的体内外研究。
| [1] | Eskazan AE, Ozmen D. Tyrosine kinase inhibitor (TKI) therapy for newly-diagnosed patients with chronic myeloid leukemia: focusing on TKI discontinuation due to adverse events -is better always good[J]. Expert Rev Hematol, 2017, 10(7): 583-6. DOI: 10.1080/17474086.2017.1339599. |
| [2] | Radich JP, Mauro MJ. Tyrosine kinase inhibitor treatment for newly diagnosed chronic myeloid leukemia[J]. Hematol Oncol Clin North Am, 2017, 31(4): 577-87. DOI: 10.1016/j.hoc.2017.04.006. |
| [3] | Okumu DO, East MP, Levine M, et al. BIRC6 mediates imatinib resistance independently of Mcl-1[J]. PLoS One, 2017, 12(5): e0177871. DOI: 10.1371/journal.pone.0177871. |
| [4] | Patel AB, O'hare T, Deininger MW. Mechanisms of resistance to ABL kinase inhibition in chronic myeloid leukemia and the development of next generation ABL kinase inhibitors[J]. Hematol Oncol Clin North Am, 2017, 31(4): 589-612. DOI: 10.1016/j.hoc.2017.04.007. |
| [5] | Ferri C, Bianchini M, Bengio R, et al. Expression of LYN and PTEN genes in chronic myeloid leukemia and their importance in therapeutic strategy[J]. Blood Cells Mol Dis, 2014, 52(2/3): 121-5. |
| [6] | Bassermann F, Eichner R, Pagano M. The ubiquitin proteasome system -implications for cell cycle control and the targeted treatment of cancer[J]. Biochim Biophys Acta, 2014, 1843(1): 150-62. DOI: 10.1016/j.bbamcr.2013.02.028. |
| [7] | Bedford L, Lowe J, Dick LR, et al. Ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets[J]. Nat Rev Drug Discov, 2011, 10(1): 29-46. DOI: 10.1038/nrd3321. |
| [8] | Adams J. Proteasome inhibition in cancer: development of PS-341[J]. Semin Oncol, 2001, 28(6): 613-9. DOI: 10.1016/S0093-7754(01)90034-X. |
| [9] | Gatto S, Scappini B, Pham L, et al. The proteasome inhibitor PS-341 inhibits growth and induces apoptosis in Bcr/Abl-positive cell lines sensitive and resistant to imatinib mesylate[J]. Haematologica, 2003, 88(8): 853-63. |
| [10] | 周英, 马梁明, 李晓宇, 等. 硼替佐米对伊马替尼耐药细胞株K562/G01药物敏感性的影响[J]. 中华血液学杂志, 2011, 32(6): 392-5. |
| [11] | Iskandarani A, Bhat AA, Siveen KS, et al. Bortezomib-mediated downregulation of S-phase kinase protein-2 (SKP2) causes apoptotic cell death in chronic myelogenous leukemia cells[J]. J Transl Med, 2016, 14(5): 69. |
| [12] | 冯帆, 张琼, 刘洪英, 等. 酪氨酸激酶抑制剂伊马替尼耐药K562细胞系的建立及其耐药特征[J]. 中国药理学与毒理学杂志, 2012, 26(4): 563-9. |
| [13] | Hussain AR, Al-Jomah NA, Siraj AK, et al. Sanguinarinedependent induction of apoptosis in primary effusion lymphoma cells[J]. Cancer Res, 2007, 67(8): 3888-97. DOI: 10.1158/0008-5472.CAN-06-3764. |
| [14] | Pasic I, Lipton JH. Current approach to the treatment of chronic myeloid leukaemia[J]. Leuk Res, 2017, 55(4): 65-78. |
| [15] | Yanamandra N, Colaco NM, Parquet NA, et al. Tipifarnib and bortezomib are synergistic and overcome cell adhesion-mediated drug resistance in multiple myeloma and acute myeloid leukemia[J]. Clin Cancer Res, 2006, 12(2): 591-9. DOI: 10.1158/1078-0432.CCR-05-1792. |
| [16] | Du X, Tong J, Lu H, et al. Combination of bortezomib and daunorubicin in the induction of apoptosis in T-cell acute lymphoblastic leukemia[J]. Mol Med Rep, 2017, 16(1): 101-8. |
| [17] | 周英, 马梁明, 牛燕燕, 等. 硼替佐米对伊马替尼耐药细胞株K562/G01增殖抑制和诱导凋亡作用的研究[J]. 白血病·淋巴瘤, 2010, 19(6): 357-9. |
| [18] | Dai Y, Rahmani M, Pei XY, et al. Bortezomib and flavopiridol interact synergistically to induce apoptosis in chronic myeloid leukemia cells resistant to imatinib mesylate through both Bcr/ Abl-dependent and -independent mechanisms[J]. Blood, 2004, 104(2): 509-18. DOI: 10.1182/blood-2003-12-4121. |
| [19] | Jilani I, Kantarjian H, Gorre M, et al. Phosphorylation levels of BCR-ABL, CrkL, AKT and STAT5 in imatinib-resistant chronic myeloid leukemia cells implicate alternative pathway usage as a survival strategy[J]. Leuk Res, 2008, 32(4): 643-9. DOI: 10.1016/j.leukres.2007.08.009. |
| [20] | Deininger M, Buchdunger E, Druker BJ. The development of imatinib as a therapeutic agent for chronic myeloid leukemia[J]. Blood, 2005, 105(7): 2640-53. DOI: 10.1182/blood-2004-08-3097. |
| [21] | Wu Y, Chen C, Sun X, et al. Cyclin-dependent kinase 7/9 inhibitor SNS-032 abrogates FIP1-like-1 platelet-derived growth factor receptor α and bcr-abl oncogene addiction in malignant hematologic cells[J]. Clin Cancer Res, 2012, 18(7): 1966-78. DOI: 10.1158/1078-0432.CCR-11-1971. |
| [22] | Chen R, Wierda WG, Chubb S, et al. Mechanism of action of SNS-032, a novel cyclin-dependent kinase inhibitor, in chronic lymphocytic leukemia[J]. Blood, 2009, 113(19): 4637-45. DOI: 10.1182/blood-2008-12-190256. |
| [23] | Weinstein IB. Cancer. Addiction to oncogenes--the Achilles heal of cancer[J]. Science, 2002, 297(5578): 63-4. DOI: 10.1126/science.1073096. |
| [24] | Wang R, Davidoff AM, Pfeffer LM. Bortezomib sensitizes human glioblastoma cells to induction of apoptosis by type Ⅰ interferons through NOXA expression and Mcl-1 cleavage[J]. Biochem Biophys Res Commun, 2016, 478(1): 128-34. DOI: 10.1016/j.bbrc.2016.07.080. |
| [25] | Zhang Y, Zhu X, Hou K, et al. Mcl-1 downregulation sensitizes glioma to bortezomib-induced apoptosis[J]. Oncol Rep, 2015, 33(5): 2277-84. |
 2017, Vol. 37
2017, Vol. 37
