失眠是临床上常见的睡眠障碍类型。中国6城市普通人群失眠状况调查结果显示成年人在过去1年中失眠患病率为57%,症状持续1年或以上占53%,约39%的患者日常功能受到影响[1]。长期失眠不仅会损害个人的认知功能,导致生活质量和学习工作效率的下降[2],也给家庭及社会带来沉重的负担[3]。另有研究发现,失眠是高血压、卒中、心血管疾病、焦虑抑郁等疾患的高危因素[4-6]。目前镇静催眠药仍是治疗失眠的主要手段,虽然起效快,作用机理明确,但服药过程中常出现记忆力下降、头昏等不良反应,且长期服药易产生戒断反应、耐受性及依赖性。如长期服用佐匹克隆会出现记忆损害及失眠、焦虑等戒断症状[7]。因此,研究更有效的治疗药物是十分必要的。
中医药治疗失眠有很长的历史,张仲景《金匮要略》中“虚劳,虚烦不得眠,酸枣仁汤主之。”是对失眠治疗方药的较早论述,酸枣仁、茯苓等药物也广泛应用于后世治疗失眠的方剂中。佛手宁神方由佛手、百合、酸枣仁、茯苓、莲子配伍而成,在临床应用中,能明显改善失眠患者的睡眠质量,但其机制尚不清楚。本研究拟采用阈下和阈剂量戊巴比妥钠致小鼠睡眠实验,评价佛手宁神方促眠作用;并通过检测对氯苯丙氨酸(PCPA)失眠模型大鼠海马5-HT含量及5-HT1AR蛋白和mRNA的表达水平,探讨佛手宁神方改善睡眠可能的作用机制。
1 材料和方法 1.1 动物雄性SPF级昆明小鼠170只,体质量18~22 g;雄性SPF级SD大鼠48只,体质量160~200 g,由南方医科大学实验动物中心提供,许可证号:SCXK(粤)2011-0015。饲养环境温度为23 ℃~25 ℃,自由饮水和进食,适应性喂养1周后开始实验。
1.2 试剂与仪器佛手、百合、酸枣仁、茯苓、莲子(均购于康美大药房)。佛手宁神方药液制备:佛手40 g,百合30 g,酸枣仁25 g,茯苓15 g,莲子10 g,加入8倍水,煎煮2次,每次60 min,合并两次药液,浓缩至2.4 g/mL冷藏备用。对氯苯丙氨酸(sigma);戊巴比妥钠(默克);艾司唑仑(华中药业);5-羟色胺受体1A抗体(abcam);大鼠5-羟色胺酶联免疫吸附测定试剂盒(伊莱瑞特);RNA提取试剂盒(全式金);逆转录试剂盒、实时荧光定量PCR试剂盒(Takara);行为学硬件配套系统及Panlab SMART 3.0行为学视频采集与分析系统(瑞沃德);Multiskan FC型全波段酶标仪(Thermo);N-1001DW型旋转蒸发仪(EYELA);HC-3018R高速冷冻离心机(中科中佳);MX3005P荧光定量PCR仪(Stratagene)。
1.3 方法 1.3.1 对阈下剂量戊巴比妥钠致小鼠睡眠的影响85只昆明小鼠随机分为5组,分别为空白组,艾司唑仑组,佛手宁神方低、中、高剂量组,每组17只。佛手宁神方低、中、高剂量组分别给予佛手宁神方12,24,48 g/(kg · d)灌胃,每天2次;艾司唑仑组给予艾司唑仑0.4 mg/(kg· d)灌胃,每天1次;空白组给予等体积蒸馏水灌胃。连续灌胃给药1周。末次灌胃30 min后(艾司唑仑组灌胃20 min后),各组小鼠腹腔注射戊巴比妥钠35 mg/kg,以翻正反射消失1 min以上为入睡标准,记录20 min内各组小鼠入睡只数。
1.3.2 对阈剂量戊巴比妥钠致小鼠睡眠的影响85只昆明小鼠,分组及给药同1.3.1项。末次灌胃30 min后(艾司唑仑组灌胃20 min后),各组小鼠腹腔注射戊巴比妥钠55 mg/kg,以翻正反射消失1 min以上为入睡标准,记录各组小鼠睡眠潜伏期和睡眠持续时间。
1.3.3 对PCPA失眠模型大鼠的影响 1.3.3.1 动物模型制作及给药48只SD大鼠随机分为空白组,模型组,艾司唑仑组,佛手宁神方低、中、高剂量组,每组8只。参照文献[8],于每日8:00~9:00腹腔注射PCPA 350 mg/kg,连续3 d。第1次注射PCPA 28~32 h后,观察大鼠行为,出现昼夜节律消失,白天活动不停,与空白组有明显不同,表明模型复制成功;空白组给予等体积生理盐水腹腔注射。各组于实验第4天开始干预治疗,佛手宁神方低、中、高剂量组分别给予佛手宁神方6,12,24 g/(kg·d)灌胃,每天2次;艾司唑仑组给予艾司唑仑0.2 mg/(kg·d)灌胃,每天1次;空白组、模型组给予等体积蒸馏水灌胃。连续灌胃给药1周。
1.3.3.2 旷场实验各组大鼠末次灌胃30 min后,在安静、光强度温和条件下进行旷场实验。大鼠旷场箱高30 cm,长宽均为80 cm,底面和侧壁为灰色。测试时,将大鼠置于箱底中心,观察5 min内运动总路程及站立次数(两前脚腾空或攀附箱壁)。每次实验前用75%乙醇及清水清洗旷场箱内壁及底面。
1.3.3.3 标本采集与储存各组大鼠进行旷场实验后,用戊巴比妥钠麻醉,立即取脑,冰袋上迅速分离海马,一部分立即放入液氮冻存,再放入-80 ℃低温冰箱保存,一部分放入带RNA保护液的EP管中,放入-80 ℃低温冰箱保存。每组取完整大脑半球放入4%多聚甲醛固定,制备厚度为4 μm的石蜡切片。
1.3.3.4 ELISA法检测大鼠海马5-HT含量称取各组大鼠海马,加入适量预冷生理盐水,在冰浴条件下超声粉碎,于4 ℃ 5000×g下离心10 min,取上清,严格按照5-羟色胺酶联免疫吸附测定试剂盒说明书步骤检测5-HT含量。
1.3.3.5 免疫组化法检测大鼠海马5-HT1AR蛋白的表达将石蜡切片65 ℃烘烤30 min脱蜡,浸入枸橼酸缓冲液中加热进行抗原修复,PBS缓冲液洗涤(3次,每次5 min,下同),3%过氧化氢避光孵育10 min,PBS缓冲液洗涤,5% BSA于室温封闭15 min,滴加一抗于4 ℃孵育过夜,PBS缓冲液洗涤,滴加二抗于37 ℃孵育1 h,PBS缓冲液洗涤后加DAB显色液显色,苏木素复染,脱水,透明后封片拍摄。每张切片随机选取3个高倍视野观察,运用Image pro-plus图像分析软件,测量阳性细胞的平均光密度值。
1.3.3.6 实时荧光定量PCR检测大鼠海马5-HT1AR mRNA的表达按照Trizol试剂盒说明书提取各组大鼠海马总RNA;按照Takara反转录试剂盒和qPCR试剂盒说明书分别进行反转录和qPCR反应;5-HT1A上游引物:5'-GTGGTCCTTGCTGATGGTG-3';5-HT1A下游引物:5'-ATCTCGCTCACTTGGCTCAT-3';GAPDH上游引物:5'-GACATGCCGCCTGGAGAAAC-3';GAPDH下游引物:5'-AGCCCAGGATGCCCTTTAGT-3';反应条件为:95 ℃预变性30 s;95 ℃变性15 s,60 ℃退火延伸20 s,扩增40个循环。采用相对定量法(2-△△ct)进行统计分析。
1.3.4 统计学分析所得数据采用均数±标准差表示,用SPSS13.0软件进行统计学分析。多组间比较采用单因素方差分析,两两比较采用LSD检验;方差不齐时,采用Welch检验,两两比较采用Tambane's T2检验;计数资料采用Fisher精确概率法分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 佛手宁神方对阈下剂量戊巴比妥钠致小鼠睡眠的影响与空白组相比,艾司唑仑组和佛手宁神方高剂量组能增加阈下剂量戊巴比妥钠致小鼠入睡只数,差异有统计学意义(P<0.05)。佛手宁神方不同给药组间随给药剂量增加,小鼠入睡只数增加,呈现剂量依赖关系(表 1)。
| 表 1 佛手宁神方对阈下剂量戊巴比妥钠致小鼠睡眠的影响 Table 1 Effect of FSNSD on sleep onset induced by a subthreshold dose of sodium pentobarbital in mice(n=17) |
与空白组比较,艾司唑仑组和佛手宁神方中、高剂量组能缩短阈剂量戊巴比妥钠致小鼠睡眠潜伏期(P<0.05),明显延长睡眠持续时间(P<0.01)。佛手宁神方高剂量组不如艾司唑仑组,有统计学差异(P<0.01)。佛手宁神方不同给药组间随给药剂量增加,小鼠睡眠潜伏期缩短,睡眠持续时间延长,呈现剂量依赖关系(表 2)。
| 表 2 佛手宁神方对阈剂量戊巴比妥钠致小鼠睡眠潜伏期和睡眠持续时间的影响 Table 2 Effect of FSNSD on sleep latency and sleeping time in mice treated with a threshold dose of sodium pentobarbital(n=17) |
与空白组比较,模型组运动总路程明显增长(P<0.05);站立次数有增多趋势,但差异无统计学意义(P>0.05)。与模型组比较,艾司唑仑组和佛手宁神方中、高剂量组运动总路程减少(P<0.05)。艾司唑仑组站立次数较模型组减少(P<0.01)。佛手宁神方中、高剂量组站立次数较模型组有减少趋势,但差异无统计学意义(P>0.05,表 3)。
| 表 3 各组大鼠旷场实验结果的比较 Table 3 Comparison of total distance and rearing numbers of SD rats in open field test(n=8) |
与空白组比较,模型组海马5-HT含量减少(P<0.01);艾司唑仑组和佛手宁神方高剂量组海马5-HT含量较模型组上升(P<0.05)。艾司唑仑组和佛手宁神方高剂量组海马5-HT含量差异无统计学意义(P>0.05,表 4)。
| 表 4 各组大鼠海马5-HT含量的比较 Table 4 Content of 5-HT in the hippocampus of SD rats in different groups(n=8) |
与空白组相比,模型组5-HT1AR蛋白在海马CA1区表达明显减少(P<0.01);艾司唑仑组和佛手宁神方中、高剂量组5-HT1AR蛋白表达较模型组明显增加(P<0.01,图 1)。
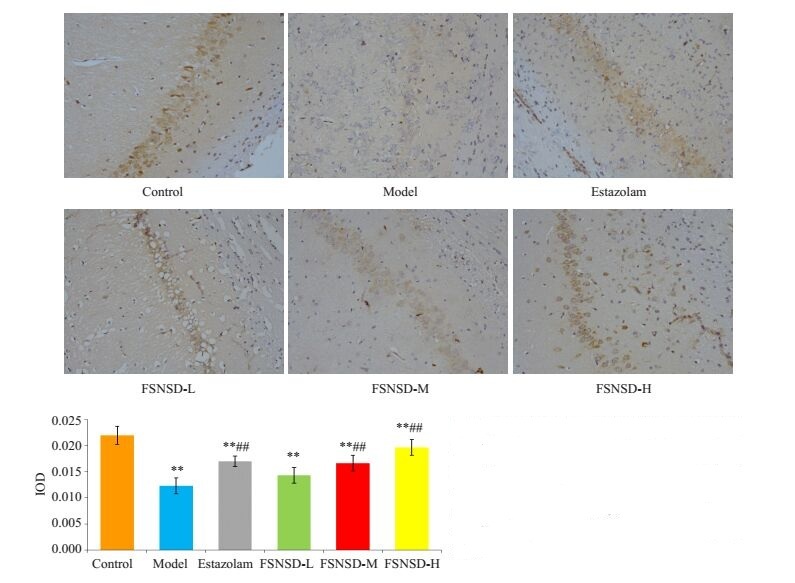
|
图 1 各组大鼠5-HT1AR蛋白在海马CA1区表达的比较 Figure 1 Expression of 5-HT1AR protein in the CA1 region of rats in different groups (Immunohistochemistry, original magnification: × 200). **P < 0.01 vs control group; ##P < 0.01 vs model group. |
与空白组相比,模型组海马5-HT1AR mRNA表达水平下降(P<0.01);艾司唑仑组和佛手宁神方中、高剂量组海马5-HT1AR mRNA表达水平较模型组上升(P<0.05)。佛手宁神方高剂量组5-HT1AR mRNA表达量与艾司唑仑组相当(P>0.05,图 2)。
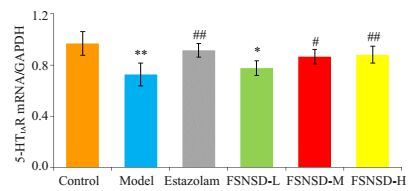
|
图 2 各组大鼠海马5-HT1AR mRNA表达的比较 Figure 2 Expression of 5-HT1AR mRNA in the hippocampus of rats in different groups. *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group. |
失眠属于中医“不寐”范畴,虽属心神疾病,但与肝密切相关。随着生活节奏的加快,生活、工作压力日益加大,导致人们承受的精神心理压力也增加,情志因素成为失眠重要的诱发因素[9]。张庆祥等[10]研究门诊失眠患者的中医证型分布情况,发现肝郁证的失眠患者高达57.35%,其中有81.20%的肝郁证失眠者因负性情志因素而致失眠。中医认为肝主疏泄,具有舒达气机、调畅情志的功能;而情志是神的重要组成部分,心神往往易受情志因素的影响。因此,失眠当重视从肝心论治。佛手宁神方是以此理论为指导而创立的,方中重用佛手,疏肝解郁,使肝气得以条达;百合安心、养五脏;酸枣仁宁心安神,养血补肝;茯苓、莲子为健脾之常品,且能安神。诸药配伍,一则疏肝以调气血,气血运行通畅,心神得以安宁;二则健脾使气血生化有源,气血充足,肝得以柔养,心神有所舍。全方药少力专,共凑疏肝健脾、养心安神之效。现代药理研究表明,百合皂苷能调节抑郁症模型大鼠脑内单胺类神经递质的紊乱状态,提高5-HT的含量[11];酸枣仁主要有效成分酸枣仁皂苷A能减少小鼠自发活动,具有良好的镇静催眠作用[12]。
戊巴比妥钠为一种中枢神经抑制药,小剂量可引起镇静作用,中剂量可缩短睡眠潜伏期和延长睡眠时间。本课题组以小鼠入睡只数、睡眠潜伏期和睡眠持续时间为观察指标进行研究,发现与空白组相比,佛手宁神方高剂量组不仅能增加阈下剂量戊巴比妥钠致小鼠入睡只数,还能缩短阈剂量戊巴比妥钠致小鼠睡眠潜伏期,明显延长睡眠时间。证实佛手宁神方有良好的促睡眠作用,且呈现一定的量效关系。旷场实验是检测动物在新异环境中探索行为、认知能力及兴奋程度的经典行为实验。该实验结果显示,与模型组比较,佛手宁神方中、高剂量组失眠大鼠运动总路程减少;站立次数也有减少的趋势,但差异无统计学意义。进一步说明佛手宁神方可以降低失眠大鼠兴奋性,具有良好的镇静作用。
睡眠-觉醒节律的变化是脑内各个中枢系统相互协调的结果。而这些调节系统是通过释放各种神经递质来发挥具体的作用。故正常的睡眠有赖于体内神经递质的平衡。已证实5-HT参与了睡眠-觉醒节律的调节,是脑内关键的促眠因子[13]。临床研究发现失眠患者血浆中5-HT水平较健康人群显著下降[14]。5-HT的合成需要色氨酸羟化酶(TPH)的参与,而PCPA是TPH的抑制剂。PCPA选择性与TPH结合,阻断脑内5-HT的合成,使脑内5-HT含量下降,从而造成动物完全性失眠;而注射5-HT的前体物质5-羟色胺酸后,动物睡眠恢复正常[15]。5-HT需要通过介导特异性受体亚型才能发挥相应的药理作用[16-18]。目前已经知道的5-HT受体有5-HT1-7R七大类,其中5-HT1AR与睡眠的关系最为密切。5-HT1AR主要分布在动物的大脑皮层、海马、杏仁核和下丘脑。研究表明,小剂量5-HT1AR激动药皮下注射可以延长动物非快速眼动睡眠时间,而小剂量中缝背核给药则可以延长快速眼动睡眠时间[19]。实验有报道PCPA失眠大鼠模型不仅存在脑内5-HT含量的降低,而且5-HT1AR的表达也存在异常[13]。本研究结果显示与空白组相比,模型组海马5-HT含量较空白组减少,同时伴有5-HT1AR蛋白和mRNA表达的下调,与文献报道的一致[20]。表明腹腔注射PCPA后,大鼠出现失眠与5-HT能神经元系统紊乱有关。而与模型组比较,佛手宁神方能提高海马5-HT的含量,上调海马5-HT1AR蛋白和mRNA的表达水平,从而起到治疗失眠的作用。这可能是佛手宁神方治疗失眠的机制之一。然而中药复方成分复杂,在治疗上往往具有多靶点、多途径调节的特点,佛手宁神方的作用机理还有待进一步研究。
| [1] | 黄宏星. 中国6城市普通人群失眠状况及京沪穗医师对抑郁伴失眠患者的认知及处理状况调查[J]. 中国医药导刊, 2006, 8(2): 100. |
| [2] | Roth T, Drake C. Evolution of insomnia: current status and future direction[J]. Sleep Med, 2004, 5(Suppl 1): S23-30. |
| [3] | Rosekind MR, Gregory KB. Insomnia risks and costs: health, safety, and quality of Life[J]. Am J Manag Care, 2010, 16(8): 617-26. |
| [4] | Ge B, Guo X. Short and long sleep durations are both associated with increased risk of stroke: a meta-analysis of observational studies[J]. Int J Stroke, 2015, 10(2): 177-84. DOI: 10.1111/ijs.12398. |
| [5] | Li M, Zhang XW, Hou WS, et al. Insomnia and risk of cardiovascular disease: a meta-analysis of cohort studies[J]. Int J Cardiol, 2014, 176(3): 1044-7. DOI: 10.1016/j.ijcard.2014.07.284. |
| [6] | Troxel WM, Buysse DJ, Matthews KA, et al. Sleep symptoms predict the development of the metabolic syndrome[J]. Sleep, 2010, 33(12): 1633-40. DOI: 10.1093/sleep/33.12.1633. |
| [7] | 孙振晓, 孙宇新, 于相芬. 佐匹克隆的不良反应认识进展[J]. 中国执业药师, 2016, 13(1): 33-7. |
| [8] | 王慧, 罗坤, 赵云华. 酸枣仁汤对失眠大鼠中脑中缝背核Bcl-2及脑源性神经营养因子mRNA的影响[J]. 时珍国医国药, 2013, 24(8): 1898-900. |
| [9] | 许红. 失眠症1018例相关因素调查分析--附553例疗效观察[J]. 辽宁中医杂志, 2005, 32(2): 114-5. |
| [10] | 刘罗冀, 张虹, 丰芬, 等. 从肝论治失眠研究进展[J]. 中医学报, 2015, 30(1): 114-6. |
| [11] | 高淑怡, 李卫民, 帅颖, 等. 药用植物百合甾体皂苷研究进展[J]. 中国实验方剂学杂志, 2012, 18(16): 337-43. |
| [12] | Wang XX, Ma GI, Xie JB, et al. Influence of JuA in evoking communication changes between the small intestines and brain tissues of rats and the GABAA and GABAB receptor transcription levels of hippocampal neurons[J]. J Ethnopharmacol, 2015, 159(2015): 215-23. |
| [13] | 罗本华, 陈周婧, 王燕, 等. 3种针法对PCPA诱导的失眠大鼠海马5-HT_(1A), 5-HT_(2A)蛋白表达的影响[J]. 华中科技大学学报:医学版, 2016, 45(6): 670-3. |
| [14] | 史敏, 杨东东, 赵欢. 糖郁疏治疗痰热扰心证型失眠100例临床研究[J]. 中成药, 2014, 36(7): 1386-9. |
| [15] | 赵忠新. 临床睡眠障碍学[M]. 上海: 第二军医大学出版社, 2003: 39-40. |
| [16] | Derry C, Benjamin C, Bladin P, et al. Increased serotonin receptor availability in human sleep: evidence from an [18F]MPPF PET study in narcolepsy[J]. Neuroimage, 2006, 30(2): 341-8. DOI: 10.1016/j.neuroimage.2005.09.052. |
| [17] | Biard K, Douglass AB, De Koninck J. The effects of galantamine and buspirone on sleep structure: Implications for understanding sleep abnormalities in major depression[J]. J Psychopharmacol, 2015, 29(10): 1106-11. DOI: 10.1177/0269881115598413. |
| [18] | Zhang YH, Fang LH. Antagonism of morphine-induced antinociception by tetrandrine is dependent on serotonergic mechanisms[J]. Life Sci, 2001, 69(12): 1429-39. DOI: 10.1016/S0024-3205(01)01230-9. |
| [19] | Monti JM, Jantos H, Monti D. Increased REM sleep after intradorsal raphe nucleus injection of flesinoxan or 8-OHDPAT: prevention with WAY 100635[J]. Eur Neuropsychopharmacol, 2002, 12(1): 47-55. DOI: 10.1016/S0924-977X(01)00133-X. |
| [20] | Zheng Y, Wu J, Feng X, et al. In silico Analysis and Experimental Validation of Lignan Extracts from Kadsura longipedunculata for Potential 5-HT1AR Agonists[J]. PLoS One, 2015, 10(6): e0130055. DOI: 10.1371/journal.pone.0130055. |
 2017, Vol. 37
2017, Vol. 37

