2. 中山大学附属第一医院器官移植科, 广东 广州 510080
2. Department of Organ Transplantation, First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China
多瘤病毒家族成员BK病毒(BKV)广泛存在于正常人群中,初次感染多发生于儿童期;感染后,BKV并未整合入人类基因,机体处于潜伏感染状态,泌尿系统尤其是肾小管和尿路上皮是常见的感染部位[1-2]。对于免疫抑制的人群,BKV能被重新激活而再次引发机体感染[3]。BKV感染是肾移植术后常见的并发症,文献报道移植术后发生BKV相关性肾病(BKVN)比例达到10%,是造成移植肾失功的主要原因[4]。国内近年逐渐重视BKV感染,研究多集中在BKV血、尿症的诊断方法及BKVN的治疗,对早期BKV复制的干预及时机鲜有报道。早期BKV复制即可引起BKV尿症,但临床症状不明显,且血肌酐一般在正常水平,因此对早期BKV复制进行干预的意义在于及时阻止BKV继续复制,延缓BKV尿症、血症出现的发生,有利于稳定移植肾功能,改善移植肾长期存活。而目前对肾移植术后BKV感染及其导致的BKVN缺乏特异性的治疗手段,肾移植术后常规监测受者尿液和血液中BK病毒DNA载量是预防BKVN的重要手段,早期发现并采取干预措施对移植肾的预后起着积极的作用[5]。另一方面,BKV复制是一个持续发展的过程,即使是早期干预,也可能因为受者出现排斥征象而无法达到满意的免疫抑制程度,难以有效阻止BKV继续复制,病情可能仍有不同程度的进展。因此,探讨肾移植术后BKV复制早期干预的时机和转归对于移植肾改善治疗的有重要意义。本文回顾性分析2012年4月~2015年4月在南方医科大学南方医院行BK病毒载量监测的肾移植受者临床资料,以探讨肾移植术后BKV复制早期干预的时机和转归,现报告如下。
1 资料和方法 1.1 研究对象本文研究对象为2012年4月~2015年4月在南方医科大学南方医院行BK病毒载量检测结果为阳性的肾移植受者,包括:尿BK病毒阳性(连续2次尿液BKV载量为1.0×104~1.0×107/mL)、BKV尿症(连续2次尿液BKV载量>1.0×107/mL);BKV血症(连续2次血浆BKV载量≥1.0×104/mL)[6]。以上3种类型分别记为A、B、C组,各组患者无交叉,符合两组入选标准时,纳入后一组。另一方面,选取同期接受肾移植、年龄相近(△≤5岁)且尿液BKV载量始终<1.0×104 copy/mL的移植受者,记为D组,作为对照组。所有肾移植受者术后常规血糖、血压控制良好。
1.2 估算肾小球滤过率(eGFR)eGFR由简化的改良肾小球滤过率估算公式计算[7]:eGFR=175 ×血肌酐-1.234 ×年龄-0.179 × 0.79(若女性)。eGFR≥60 mL/(min·1.73 m2),视为eGFR基线水平;eGFR<60 mL/(min·1.73 m2),视为eGFR减退;eGFR<15 mL/(min·1.73 m2),视为肾功能丢失[8]。
1.3 免疫抑制方案免疫诱导方案:所有受者在术后第1~3天应用抗胸腺球蛋白,术前评估为高风险的受者(群体反应性抗体阳性,女性多次妊娠史,再次移植,心脏死亡供者肾移植等)在术前2 h及术后第4天加用抗CD25单克隆抗体2剂诱导。甲基强的松龙术后3 d连续以0.5、0.25、0.25 g静脉给药,后改为甲泼尼龙20 mg/d口服给药,1月内逐渐减量至8 mg/d维持。术后均给予钙调磷酸酶抑制剂(CNI)类药物为主的三联免疫抑制方案:[FK506或环孢素(CsA)]+霉酚酸酯(MMF)或麦考酚钠肠溶片(EC-MPS)+强的松(Pred),FK506以0.15~0.3 mg/kg、2次/d,CsA以4~5 mg/kg、2次/d起始给药,根据血药浓度调整药物剂量。术后前3个月,FK506和CsA的血药靶浓度分别为8~9 ng/mL、280~300 ng/mL。MMF以0.5 g、2次/d,EC-MPS以0.36 g、2次/d剂量给药并维持。
1.4 尿液BKV阳性、BKV尿症、BKV血症的处理方法尿液BKV阳性时以免疫抑制剂适度减量为主要的干预手段:FK506逐渐减量至血药浓度7 ng/mL或CsA逐渐减量至血药浓度220~240 ng/mL;BKV尿症时,FK506逐渐减量至血药浓度5 ng/mL或CsA逐渐减量为血药浓度150~180 ng/mL;BKV血症时,除免疫抑制剂减量外,FK506换用为CsA并维持CsA血药浓度至150 ng/mL,MMF或EC-MPS换用为布累迪宁50~100 mg、1次/d,静注免疫球蛋白,加用来氟米特等。
1.5 统计学方法采用SPSS22.0统计软件进行数据分析。统计结果中符合正态分布的计量资料以均数±标准差表示;非正态分布的计量资料以中位数(最大值-最小值)表示。单个样本干预前后的比较采用配对t检验,独立样本间的比较采用独立t检验,率的比较采用非参数检验。P<0.05表示差异具有统计学意义。
2 结果 2.1 研究对象情况回顾临床资料,最终纳入本研究的BK病毒阳性的肾移植受者共54例:A、B、C组各22(40.74%)、24(44.44%),8(14.82%)例;其中,B组有3例是从尿BKV阳性进展而来,C组有2例直接从尿BKV阳性、1例从BKV尿症进展而来;另一方面,同期肾移植受者即对照组47例。入组对象人口学资料总结如表 1,各组与对照组D组的统计学比较中,除A组性别分布有差异外,其余指标比较均无统计学差异,各组具有可比性。
| 表 1 移植受者一般资料 Table 1 Clinical characteristics of the included recipients |
54例受者在肾移植术后首次出现尿BKV阳性、BKV尿症、BKV血症的时间分布如图 1,提示:出现尿BKV阳性、BKV尿症和BKV血症的中位时间分别是移植术后3(1~14)月、6(1~18)月和7(3~12)月。
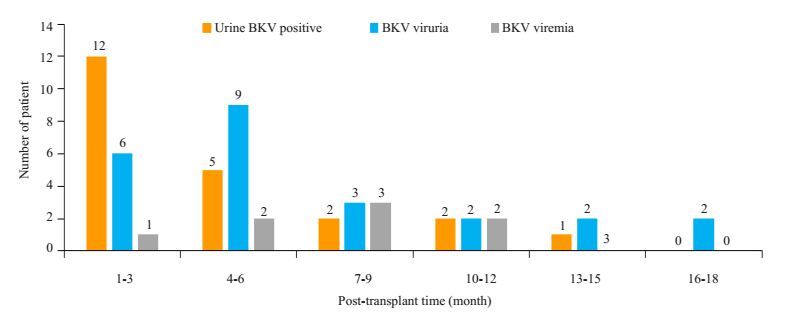
|
图 1 BKV复制程度-时间分布图 Figure 1 Time interval from transplant to occurrence of urine BKV positivity, BKV viruria and BKV viremia |
根据A、B、C组在确诊尿液BKV阳性、BKV尿症、BKV血症和末次随访时的尿液及血浆BKV载量,取其以底数为10的对数,进行干预前后BKV定量的配对t检验。如表 2所示,干预后A、B、C组的尿液BKV载量及C组血浆BKV载量均降低。
| 表 2 干预前后BKV数量 Table 2 BKV viral load in the recipients before and after intervention (after logarithmic conversion) |
所有受者规律随访,中位随访时间15.3(3.2~34.5)个月。在诊断时,A、B、C组的平均eGFR与D组比较均无统计学差异(P=0.073,0.058,0.115)。截止至末次随访,A、B组的平均eGFR与D组比较无统计学差异(P=0.233,0.122),C组的平均eGFR明显劣于D组(P=0.001)。各组的eGFR变化趋势如图 2所示,干预后A组以及D组在随访期间eGFR稳定,略呈上升状态;干预后B组eGFR稳定,但呈略下降状态;干预后C组eGFR仍明显减退。
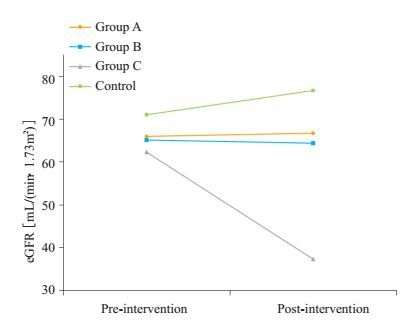
|
图 2 各组干预前后eGFR变化趋势图 Figure 2 Changes of eGFR after intervention in groups A, B, C and the control group. |
A组22例转归:11例(50%)eGFR维持稳定;6例(27.27%)eGFR好转;1例(4.55%)在减少FK506剂量后出现急性排斥(AR),抗排斥反应治疗后加用来氟米特,eGFR好转但仍低于基线水平;4例(18.18%)eGFR减退。
B组24例转归:11例(45.83%)eGFR维持稳定;8例(33.34%)eGFR好转;3例(12.49%)eGFR减退;1例(4.17%)肾失功;1例(4.17%)在减少FK506剂量2个月后出现AR,抗排斥反应治疗后增加FK506的剂量,加用来氟米特,eGFR减退。
C组8例转归:(1)4例(50%)除减少FK506的剂量外,同时减少MMF或EC-MPS的剂量,2例(50%)eGFR稳定,2例(50%)移植肾失功。(2)1例(12.5%)以CsA替换FK506,eGFR稳定。(3)1例(12.5%)减少FK506剂量2个月后出现AR,抗排斥反应治疗后,调整免疫抑制方案为FK506+布累迪宁,eGFR稳定。(4)1例(12.5%)以CsA替换FK506,静脉注射免疫球蛋白,eGFR减退。(5)1例(12.5%)同样以CsA替换FK506,静脉注射免疫球蛋白,但在调整药物1个月后出现AR,抗排斥反应治疗后,调整免疫抑制方案为FK506+布累迪宁,eGFR减退。
D组47例受者,截止至末次随访,42例(89.36%)eGFR稳定或好转,3例(6.39%)eGFR减退,2例(4.25%)移植肾失功。
3 讨论 3.1 流行病学BK病毒是乳头状多瘤空泡病毒科多瘤病毒家族的一种亚型,1971年从肾移植受者尿液中分离得到,并以该病人名字的首字母而命名[9]。BKV在人群中普遍感染,成人BKV血清阳性率高达80%~90% [10]。由于人体免疫功能正常,大部分人终生都不会出现明显的BKV感染症状或体征,BKV可以一直潜伏在泌尿系统上皮细胞中[11]。当机体免疫力低下或服用免疫抑制剂时,BKV可能会激活复制。早期可引起BKV尿症,但临床症状不明显,血肌酐一般在正常水平。中期BKV复制到一定的数量,侵入血液,则发展为BKV血症。晚期出现不同程度的移植肾功能减退,引起急性肾小管上皮细胞坏死和出血性膀胱炎,进展为BKV相关性肾病,伴随发热、蛋白尿、尿路狭窄等症状[12-13],BKVN导致移植肾失功率高达20% [14-15]。国内文献报道肾移植术后BKV尿症、BKV血症和BKVN的发生率分别是45.6%、22.2%和5.6% [16];国外也有流行病学研究调查估计肾移植术后16周、23周、28周,BK尿症、BK血症或BKVN发病率分别为30%、13%和8% [17-18]。本研究肾移植受者中BKV尿症及BKV血症发生率分别是12.90%、3.23%。与之相比,BKV尿症、血症的发生率均有一定程度的降低,这可能与我中心在BKV复制早期即开始干预有关。
3.2 BKV复制程度的进展据国外的文献报道,肾移植术后BKV尿症主要发生在术后的1~3月,从尿症进展至血症及移植肾损伤有4~12周的窗口期[19]。国内黄刚等的报道BKV尿症、血症分别发生在术后2月、3月[16]。本中心的研究提示BKV尿症、血症分别发生在术后6月、7月。相对国内外的文献报道,本中心肾移植受者BKV尿症、BKV血症出现的时间相对晚一些。我们认为,BKV在大部分人群中普遍存在,是人体的一种“常居”病毒,病毒激活、复制的时机与病情进展的速度都取决于宿主的免疫抑制状态。移植术后早期,免疫抑制程度控制得不至于太低,或及时发现、早期干预,可能会使BKV尿症、血症出现的时间会相对晚一些。BKV复制是一个持续发展的过程,即使是早期干预,也可能因为受者出现排斥征象而无法达到满意的免疫抑制程度,难以有效阻止BKV继续复制,病情可能仍有不同程度的进展。如本研究在尿BKV阳性即开始干预,但仍有3例进展为BKV尿症、1例直接进展为BKV血症;BKV尿症诊断后进一步干预,仍有1例进展为BKV血症。因此,在抗排斥与抗感染之间的平衡掌握与精准治疗,仍然是移植医生所面临的一个重要课题。
3.3 BKV复制的早期干预2013年版《实体器官移植感染疾病诊疗指南》指出:若出现持续的血浆BKV载量≥1.0×104拷贝/mL时,才建议降低免疫抑制强度[6]。2009年版《KDIGO临床实践指南》指出:当血浆BKV载量持续≥1.0×107拷贝/mL时,建议减少免疫抑制剂的剂量[20]。我们认为,干预时机应当较之提早。本研究中,BKV血症组经干预后,平均eGFR继续下降,改善并不明显,移植效果明显劣于对照组。而尿BKV阳性组和BKV尿症组经干预后,平均eGFR维持稳定,与对照组无差异。3组eGFR变化趋势中(如图 2所示),尿BKV阳性组平均eGFR稳定,略呈上升状态,移植效果最好。因此,为了改善移植肾长期存活,我们建议:(1)肾移植受者BKV早期复制,当尿液BKV阳性时,即开始干预,进行适度的免疫抑制剂减量。干预的手段并非固定,因人而异,原则是免疫抑制程度的降低。(2)当尿液BKV阳性时,FK506或CsA逐渐减少至血药浓度7 ng/mL、220~240 ng/mL;当进展至BKV尿症时,FK506或CsA逐渐减少至血药浓度5 ng/mL、150~180 ng/mL,合并血症则考虑以CsA替换FK506、MMF或EC-MPS换用为布累迪宁、加用来氟米特,病情严重者静注免疫球蛋白等。(3)免疫抑制程度降低时,要尽量在抗排斥和抗感染之间维持平衡,同时参考移植肾功能及移植肾超声检查,因此建议医师根据患者的具体情况,进行个体化治疗。(4)BKV在人群中普遍易感,是人体的“常居”病毒,对于移植受者,在移植肾功能稳定的前提下,体内BKV载量保持在1.0×104~1.0×107拷贝/mL之间仍然是一个相对安全、稳定的范围,因此干预与治疗的目的并非是完全清除病毒,而是以维持稳定的移植肾功能为目的,可以与病毒“和睦”共存。(5)术后在监测患者移植肾功能的同时,要始终重视监测尿液和血浆BKV载量,以便早期诊断,及时干预。当然,本研究为单中心回顾性研究,得出的结论还需要大样本的研究证实。
| [1] | Mitterhofer AP, Tinti F, Pietropaolo V, et al. Role of BK virus infection in end-stage renal disease patients waiting for kidney transplantation--viral replication dynamics from pre-to posttransplant[J]. Clin Transpl, 2014, 28(3): 299-306. DOI: 10.1111/ctr.2014.28.issue-3. |
| [2] | Jamboti JS. BK virus nephropathy in renal transplant recipients[J]. Nephrology (Carlton), 2016, 21(8): 647-54. DOI: 10.1111/nep.2016.21.issue-8. |
| [3] | Kenan DJ, Mieczkowski PA, Latulippe E, et al. BK polyomavirus genomic integration and large T antigen expression: evolving paradigms in human oncogenesis[J]. Am J Transplant, 2017, 17(6): 1674-80. DOI: 10.1111/ajt.2017.17.issue-6. |
| [4] | Elfadawy N, Flechner SM, Liu X, et al. The impact of surveillance and rapid reduction in immunosuppression to control BK virusrelated graft injury in kidney transplantation[J]. Transpl Int, 2013, 26(8): 822-32. DOI: 10.1111/tri.2013.26.issue-8. |
| [5] | 明英姿, 魏伟, 刘洪, 等. 肾移植与BK病毒感染[J]. 器官移植, 2016, 7(6): 427-32. |
| [6] | Hirsch HH, Randhawa P, AST Infect Dis Community Practice. BK polyomavirus in solid organ transplantation[J]. Am J Transplant, 2013, 13(4, SI): 179-88. |
| [7] | Ma YC, Zuo L, Chen JH, et al. Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J]. J Am Soc Nephrol, 2006, 17(10): 2937-44. DOI: 10.1681/ASN.2006040368. |
| [8] | Stevens PE, Levin A, Kidney Disease: improving global outcomes chronic kidney disease guideline development work group members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline[J]. Ann Intern Med, 2013, 158(11): 825-30. DOI: 10.7326/0003-4819-158-11-201306040-00007. |
| [9] | Hendrix KM. BK virus in recipients of kidney transplants[J]. Nephrol Nurs J, 2015, 41(6): 593-601. |
| [10] | Nankivell BJ, Renthawa J, Sharma RN, et al. BK virus nephropathy: histological evolution by sequential pathology[J]. Am J Transplant, 2017, 17(8): 2065-77. DOI: 10.1111/ajt.2017.17.issue-8. |
| [11] | Funahashi Y, Kato M, Fujita T, et al. Prevalence of polyomavirus positivity in urine after renal transplantation[J]. Transplant Proc, 2014, 46(2): 564-6. DOI: 10.1016/j.transproceed.2013.09.053. |
| [12] | Johnston O, Jaswal D, Gill JS, et al. Treatment of polyomavirus infection in kidney transplant recipients: a systematic review[J]. Transplantation, 2010, 89(9): 1057-70. DOI: 10.1097/TP.0b013e3181d0e15e. |
| [13] | Funahashi Y, Kato M, Fujita T, et al. Correlation between urine and serum BK virus levels after renal transplantation[J]. Transplant Proc, 2014, 46(2): 567-9. DOI: 10.1016/j.transproceed.2013.11.154. |
| [14] | Cannon RM, Ouseph R, Jones CM, et al. BK viral disease in renal transplantation[J]. Curr Opin Organ Transplant, 2011, 16(6): 576-9. DOI: 10.1097/MOT.0b013e32834cd666. |
| [15] | Dogan SE, Celebi ZK, Akturk S, et al. Prevalence and risk factors of BK viremia in patients with kidney transplantation: a SingleCenter experience from Turkey[J]. Transplant Proc, 2017, 49(3): 532-6. DOI: 10.1016/j.transproceed.2017.01.009. |
| [16] | Huang G, Chen LZ, Qiu J, et al. Prospective study of polyomavirus BK replication and nephropathy in renal transplant recipients in China: a single-center analysis of incidence, reduction in immunosuppression and clinical course[J]. Clin Transplant, 2010, 24(5): 599-609. DOI: 10.1111/ctr.2010.24.issue-5. |
| [17] | Theodoropoulos N, Wang E, Penugonda S, et al. BK virus replication and nephropathy after alemtuzumab-induced kidney transplantation[J]. Am J Transplant, 2013, 13(1): 197-206. DOI: 10.1111/j.1600-6143.2012.04314.x. |
| [18] | Hirsch HH, Knowles W, Dickenmann M, et al. Prospective study of polyomavirus type BK replication and nephropathy in renaltransplant recipients[J]. N Engl J Med, 2002, 347(7): 488-96. DOI: 10.1056/NEJMoa020439. |
| [19] | Thamboo TP, Jeffery KJ, Friend PJ, et al. Urine cytology screening for polyoma virus infection following renal transplantation: the Oxford experience[J]. J Clin Pathol, 2007, 60(8): 927-30. |
| [20] | Bia M, Adey DB, Bloom RD, et al. KDIGO clinical practice guideline for the care of kidney transplant recipients[J]. Am J Transplant, 2009, 9(Suppl 3): S1-155. |
 2017, Vol. 37
2017, Vol. 37

