2. 南方医科大学口腔医院//广东省口腔医院, 牙体牙髓科,广东 广州 510280
2. Department of Endodontics, Guangdong Provincial Stomatological Hospital/Stomatological Hospital of Southern Medical University, Guangzhou 510280, China
巨噬细胞炎症蛋白-1β(MIP-1β)是CC类趋化因子家族的成员,对淋巴细胞和单核巨噬细胞具有特异性趋化吸引作用[1]。其受体CCR5(CC亚族趋化因子受体5)是G蛋白偶联的趋化因子受体,主要表达在Th1淋巴细胞、巨噬细胞等炎症细胞表面[2]。在炎症中MIP-1β与CCR5的结合主要起到招募及细胞迁移的作用,是影响白细胞趋化作用的重要调节者[3]。研究表明,在许多恶性肿瘤如肺癌、乳腺癌、肾癌等当中,都存在着宿主免疫细胞的浸润,而许多肿瘤细胞均能分泌趋化因子,这些趋化因子和不同细胞的特异性受体结合,在肿瘤的生长发育和转移分化的过程中发挥着重要作用[4-6]。本课题组发现,在体外实验中人舌鳞癌细胞能够自分泌MIP-1β,并且舌鳞癌细胞和正常口腔黏膜上皮相比较,MIP-1β呈现高水平表达。但舌鳞癌肿瘤细胞是否能够表达MIP-1β的特异性受体CCR5,是否能够通过自分泌的方式影响肿瘤细胞增殖、凋亡等生物学行为未见报道。本实验通过研究CCR5在不同人舌鳞癌细胞株的表达情况,及MIP-1β对人舌鳞状细胞癌细胞株CAL-27细胞增殖和凋亡的影响,初步探讨MIP-1β在舌鳞癌发生发展过程中的作用。
1 材料和方法 1.1 主要仪器和材料IB高速低温离心机(Eppendorf);AS图像分析系统(Kontron elekronik);激光共聚焦显微镜(Olympus);倒置相差显微镜(Olympus);垂直电泳仪和电泳装置(Bio-Rad);流式细胞仪(BD FACSAri);全自动酶标仪(Bio-rad);核酸蛋白分子仪(Beckman);胰蛋白酶(Sigma);RPMI 1640培养基、DMEM培养基、DMEM/F12培养基(Gibco);胎牛血清(Hyclone);一抗兔抗人CCR5抗原多克隆抗体(博奥森,北京);二抗羊抗兔-Cy3(R & D);重组人MIP-1β(PeproTech);CCK-8(同仁);人舌鳞癌细胞株Tca-8113(武汉大学中国典型培养物保藏中心购买)、UM-1(中山大学第一附属医院惠赠)、CAL-27(上海交通大学附属第九人民医院惠赠)。
1.2 细胞培养在37 ℃、95%湿度、5% CO2条件下,以含10%胎牛血清的DMEM、DMEM/F12、RPMI 1640培养基分别培养CAL-27、UM-1、Tca-8113,待细胞长满培养瓶(25 cm2)底部70%~80%时,用0.25%的胰酶进行消化并传代,倒置显微镜下对细胞的形态进行观察,取对数生长期的细胞用于进一步的实验。
1.3 Western blotting检测CCR5的表达分别提取CAL-27、UM-1、Tca-8113细胞的总蛋白,考马斯亮蓝G-250法进行3种细胞的蛋白定量,各取40 μg蛋白用来进行12% SDS-PAGE凝胶电泳分析,待凝胶电泳结束后,将转移蛋白至PVDF膜上,以5%脱脂奶粉于室温下封闭2 h后,加入1:1000稀释的兔抗人CCR5一抗,在4 ℃条件下过夜,用TBST洗膜,之后加入1:5000稀释的羊抗兔IgG(辣根过氧化物酶/碱性磷酸酶标记),在室温条件下孵育1 h,用TBST洗膜,最后用DAB(AP)进行显色。
1.4 免疫荧光染色检测CCR5的表达及定位制备3种细胞的细胞爬片,用多聚甲醛进行固定,之后滴加封闭液,并滴加适当稀释过的一抗CCR5(1: 100),同时用PBS替代一抗作为阴性对照。在4 ℃条件下过夜,并用PBS进行洗涤,之后滴加相应的二抗羊抗兔-Cy3,在37 ℃条件下30 min后,用PBS进行洗涤,之后滴加4,6-联脒-2-苯基吲哚(DAPI)染色液进行复染,再用PBS进行洗涤,之后风干,再用抗荧光衰减封片剂进行封片,在激光共聚焦显微镜(CLSM)下进行观察。采用免疫荧光染色定量方法对所有间接荧光染色进行分析,操作人员在CLSM下逐一对切片进行单盲读片,之后再将读片所得的图像进行采集并输入计算机,对每张切片进行随机选择,选取3个代表视野,对选取的每个视野分别采集Cy3标记CCR5蛋白荧光图像、DAPI标记的核荧光图像及前两者的重叠图像各1幅。
1.5 CCK-8法测定CAL-27细胞的增殖取对数生长期的人舌鳞癌细胞CAL-27,用0.25%胰酶进行消化,之后用含10%胎牛血清的DMEM培养液对细胞进行重悬,将细胞密度调整至3.5×104/mL,之后将其接种到96孔板当中,每孔接种的细胞悬液为100 µL,过夜;次日,更换为无血清DMEM培养液进行细胞培养;24 h之后再次更换为含0.5%胎牛血清的DMEM培养液进行细胞培养。根据MIP-1β的浓度,将细胞设置成为3个实验组(10、20、40 ng/mL)和1个对照组(PBS),每组设置3个复孔,将不同浓度的细胞因子加入到前述各个分组当中。另外,实验设置空白对照组,即与实验孔平行处不加细胞,只加相同体积的培养液。各实验组和对照组在MIP-1β作用12、24、48 h后,各孔均加入CCK-8溶液10 µL,继续孵育3 h,之后再用全自动酶标仪测定吸光度,实验以空白对照孔进行调零,选择波长为450 nm。
1.6 Annexin V/PI双染流式细胞仪检测CAL-27细胞的凋亡取处于对数生长期的人舌鳞癌细胞CAL-27细胞,用0.25%胰酶进行消化,调整细胞密度为1×105/mL,将其接种于培养瓶中,之后用含10%胎牛血清的DMEM培养液进行培养,过夜;次日,更换为无血清DMEM培养液进行培养;24 h后,再次更换为含0.5%胎牛血清的DMEM培养液。根据MIP-1β的浓度,将细胞随机分为3个实验组(10、20、40 ng/mL)和一个阴性对照组(PBS),同时,每组设置3个复瓶,加入IP-10,待24 h后,收集上述4组细胞,根据Annexin V/PI试剂盒的操作说明,通过流式细胞仪对CAL-27的凋亡进行检测。
1.7 数据处理及统计学分析采用SPSS 16.0软件进行统计学分析,分别采用析因分析和单因素方差分析,方差齐性检验显示方差齐性,组间两两比较采用LSD检验,P<0.05为差异具有统计学意义。
2 结果 2.1 Western blotting分析结果人舌鳞癌细胞株CAL-27、UM-1、Tca-8113中均存在CCR5的表达,在相对分子质量为40 524处均可见蛋白表达条带(图 1)。
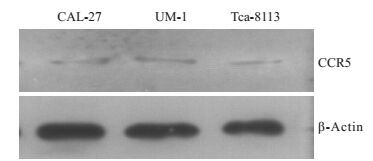
|
图 1 CCR5在不同人舌鳞癌细胞株的表达 Figure 1 Expression of CCR5 in different tongue squamous cell lines |
免疫荧光细胞染色分析进一步证实人舌鳞癌细胞株CAL-27、UM-1、Tca-8113的胞膜及胞质内中均存在CCR5的表达(图 2)。
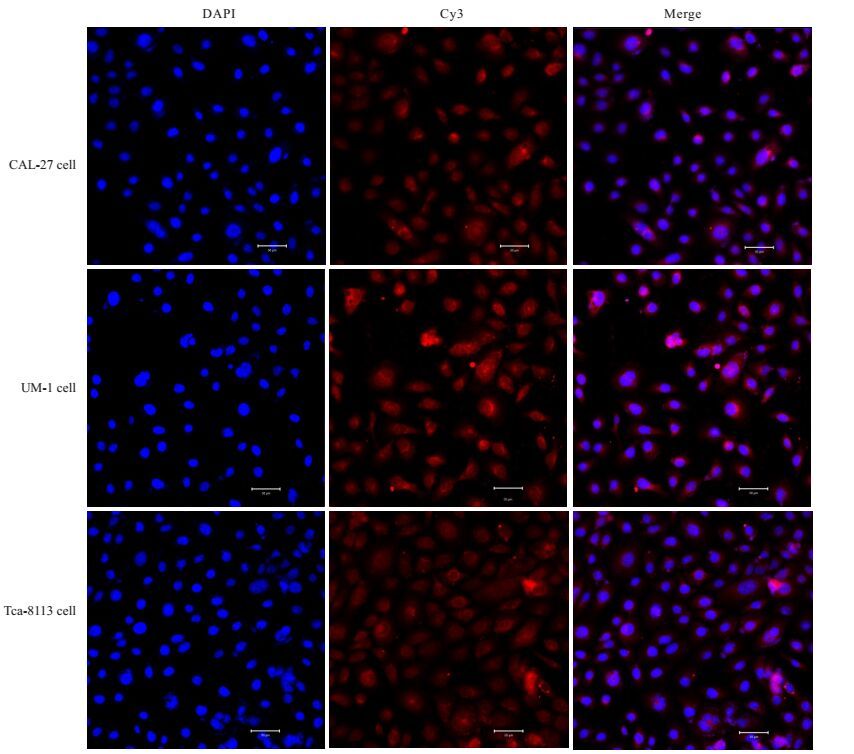
|
图 2 激光共聚焦显微镜观察CCR5在3种不同人舌鳞癌细胞株的表达 Figure 2 Expression of CCR5 in 3 different human tongue squamous cell line observed by laser confocal microscopy (Fluorescent dye, original magnification: ×400) |
结果如图 3,析因分析显示:MIP-1β的浓度对CAL-27细胞增殖有影响(F=23.476,P=0.000),MIP-1β的处理时间对CAL-27细胞增殖也有影响(F=192.365,P=0.000),但时间和浓度之间无交互作用(F=1.761,P=0.150);进一步的单因素方差分析显示:12、24 h时,不同浓度的MIP-1β对CAL-27细胞均有促进增殖的作用(P<0.05);48 h时,10 ng/mL、20 ng/mL的MIP-1β对CAL-27细胞有促进增殖的作用(P<0.05),但40 ng/mLMIP-1β对CAL-27细胞无促进增殖作用(P>0.05)。当MIP-1β的刺激浓度为40 ng/mL时,随着作用时间的延长,其促增殖的作用在减弱,在48 h对细胞增殖已无促进作用。
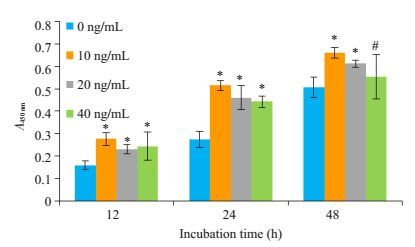
|
图 3 MIP-1β在不同时间点对CAL-27细胞增殖的影响 Figure 3 Effects of MIP-1β on CAL-27 cell proliferation at different time points (*P < 0.05 vs 0 ng/mL, #P>0.05 vs 0 ng/mL) |
和对照组相比,在24 h时,只有40 ng/mL的MIP-1β对CAL-27细胞的凋亡有促进作用(P<0.05,表 1),10 ng/mL、20 ng/mL的MIP-1β对CAL-27细胞的凋亡无显著影响(P>0.05,图 4)。
| 表 1 不同浓度的MIP-1β组CAL-27细胞的凋亡率 Table 1 Apoptosis rate of the CAL-27 cells exposed to different concentrations of MIP-1β (Mean±SD) |
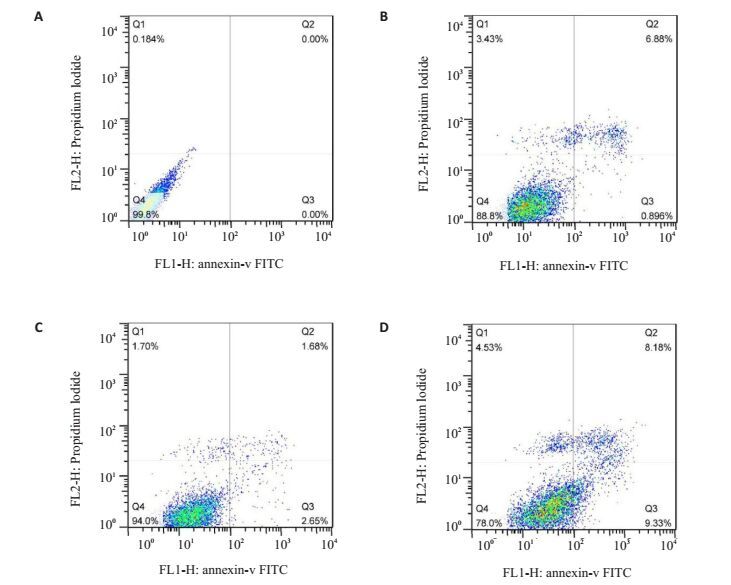
|
图 4 流式分析4种不同浓度的MIP-1β对CAL-27细胞凋亡的影响 Figure 4 Flow cytometry analysis of apoptosis of CAL-27 cells treated with different concentrations of MIP-1β. A: 0 ng/mL; B: 10 ng/mL; C: 20 ng/mL; D: 40 ng/mL. |
巨噬细胞炎症蛋白-1β(MIP-1β)为CC亚族细胞趋化因子之一,在其结构中有2个相邻的半胱氨酸残基,基因定位于人第17号染色体[7]。MIP-1β的受体CCR5定位与5号染色体上,是一类表达于不同类型细胞(单核细胞、记忆T淋巴细胞、嗜碱性粒细胞等)上的含有7个跨膜区的G蛋白偶联受体,其天然配体有CCL-3(MIP-1a)、CCL-4(MIP-1β)、CCL-5(RANTES),配体与CCR5结合后,受体变构并与G蛋白结合激活信号转导通路,发挥相应的生物学作用,使各种炎性细胞尤其是单核细胞向病变部位聚集[8-12]。
在肿瘤微环境中常常存在着慢性炎症, 大量的生长因子、趋化因子和蛋白水解酶所产生的免疫炎性反应有利于肿瘤的增殖、侵袭、粘附、血管生成以及对放、化疗的抵抗,促使恶性肿瘤产生和发展。在肿瘤组织中,浸润的淋巴细胞类型往往决定了肿瘤免疫的方向,而不同类型淋巴细胞的浸润是有特异性趋化因子的表达决定的。大量研究表明MIP-1β/CCR5轴不仅能够通过炎症反应来影响肿瘤的发生和发展,而且还可以通过与肿瘤相关基因的相互作用来调控肿瘤的发生、增殖和转移等过程[13-17]。
在食管癌组织中,MIP-1β的表达量和细胞毒性T淋巴细胞(CTLs)(标记CD8+和Granzyme B)的浸润成显著相关性,CCR5主要表达在CD8+T淋巴细胞,且发现肿瘤组织中高表达MIP-1β的患者预示着较高生存率[18]。人结直肠癌浸润的Treg细胞中发现CCR5高表达,并且有较强的增殖和激活能力[19]。MIP-1a/CCR5轴能够调节瘤内白细胞和纤维细胞浸润,并且诱导巨噬细胞分泌基质金属蛋白酶9(MMP-9),诱导纤维细胞分泌生长因子(HGF),促进肿瘤的生长和转移,促进血管生成,在小鼠肾癌细胞肺转移进程中[20]。IL-1beta诱导肝细胞表达MIP-1β,后者趋化募集炎症细胞,为肝炎的发生甚至是肝癌的转化提供炎症微环境[21]。Manes等[22]认为能通过百日咳杆菌毒素、JAK-2和p38丝裂原激活的蛋白激酶途径调控p53基因在乳腺癌中的转录。但在口腔癌中,关于MIP-1β/CCR5轴的相关研究较少。本课题组前期应用蛋白质芯片技术在舌鳞癌细胞株中发现,肿瘤细胞能够高表达MIP-1β(和正常口腔黏膜上皮相比较)。而这种高表达的MIP-1β能否通过MIP-1β/CCR5轴对肿瘤细胞的增殖、凋亡等生物学行为发生影响是本研究的目的。
本研究分别采用蛋白印迹法和免疫荧光染色对3种不同的舌鳞癌细胞株(CAL-27、UM-1、Tca-8113)的MIP-1β的相应受体CCR5的表达进行检测,发现在3种人舌鳞癌细胞株中CCR5均有表达。通过免疫荧光染色可以清楚地观察到CCR5在细胞膜上有染色,但在细胞质内也有不同程度的染色。这说明CCR5不仅存在于细胞膜上,还存在于胞质内,这也为体外研究MIP-1β/CCR5轴对舌鳞癌细胞增殖和凋亡作用的研究奠定基础。但有研究发现,细胞质内CCR5在内质网合成并自身聚合形成同源寡聚体[23],或与其他趋化因子受体聚合形成异源二聚体发挥生物学效应[24-25]。就本研究中细胞质内的CCR5的存在形式及生物学活性还需要进一步深入研究。
本实验在研究MIP-lβ对CAL-27细胞增殖影响时发现:当MIP-1β的刺激浓度相对较低(10 ng/mL、20 ng/mL)时,只有促进增殖的作用;当MIP-1β的刺激浓度相对较高(40 ng/mL)时,不但对肿瘤细胞有促进增殖的作用还促进其凋亡。剌激的早期以促增殖作用为主,但随着作用时间的延长,促增殖的作用在减弱,在48 h时,已无促进作用。这种促增殖作用的减弱可能是由于MIP-lβ的促凋亡作用逐渐发挥所引起的。但由于本实验只是检测了一个时间点(24 h时)肿瘤细胞的凋亡情况,不能反映出细胞凋亡情况随时间的变化,尚需以后进一步研究。
关于MIP-lβ对肿瘤细胞增殖和凋亡方面的研究尚未见文献报道,Ramesh等[26]在研究CCR5介导的胞内信号转导通路时发现,MIP-lβ的刺激使转染CCR5的细胞胞内蛋白质络氨酸磷酸酶SHP1和SHP2磷酸化水平增强。而SHP1在信号转导中起负性调节作用,抑制细胞的生长与增殖;SHP2可激活Ras-Raf-ERK通路,在信号转导过程中对细胞增殖起正向调节作用[27]。这给本实验研究带来了新的提示:MIP-1β对CAL-27细胞增殖和凋亡作用可能受SHP1和SHP2之间平衡的偏移的影响,但具体机制仍需进一步实验证实。
综上可以看出,MIP-1β/CCR5轴对人舌鳞癌细胞有着相互独立的作用:在体外实验中它既能促进肿瘤细胞增殖,促进肿瘤的进展,又能促进肿瘤细胞凋亡,抑制肿瘤的发展。在生物科学技术迅猛发展的当下,如何在增强趋化因子介导的抗肿瘤免疫应答的前提下,抑制趋化因子引起的肿瘤细胞增殖已成为肿瘤生物治疗的新的思路。
| [1] | Zlotnik A, Yoshie O. The chemokine superfamily revisited[J]. Immunity, 2012, 36(5): 705-16. DOI: 10.1016/j.immuni.2012.05.008. |
| [2] | Alkhatib G. The biology of CCR5 and CXCR4[J]. Curr Opin HIV AIDS, 2009, 4(2): 96-103. DOI: 10.1097/COH.0b013e328324bbec. |
| [3] | Louboutin JP, Strayer DS. Relationship between the chemokine receptor CCR5 and microglia in neurological disorders: Consequences of targeting CCR5 on neuroinflammation, neuronal death and regeneration in a model of epilepsy[J]. CNS Neurol Disord Drug Targets, 2013, 12(6): 815-29. DOI: 10.2174/18715273113126660173. |
| [4] | Rodriguez-Lara V, Ignacio GS, Cerbón Cervantes MA. Estrogen induces CXCR4 overexpression and CXCR4/CXL12 pathway activation in lung adenocarcinoma cells in vitro[J]. Endocr Res, 2017, 20: 1-13. |
| [5] | Celik B, Yalcin AD, Genc GE, et al. CXCL8, IL-1β and sCD200 are pro-inflammatory cytokines and their levels increase in the circulation of breast carcinoma patients[J]. Biomed rep, 2016, 5(2): 259-63. |
| [6] | Yamashita S, Sakurai R, Hishiki K, et al. Effects of dietary plant-origin glucosylceramide on colon cytokine contents in DMH-treated mice[J]. J Oleo Sci, 2017, 66(2): 157-60. DOI: 10.5650/jos.ess16169. |
| [7] | 贾凤云. 巨噬细胞炎症蛋白1β(MIP-1β)和单核细胞趋化蛋白1 (MCP-1) 在类风湿关节炎血清中的检测及意义[D]. 苏州大学, 2011. |
| [8] | 邱为龙, 熊思东. CCR5的结构和功能:近两年的研究进展[J]. 国外医学:分子生物学分册, 1999, 21(1): 31-5. |
| [9] | Little EC, Kubic JD, Salgia R, et al. Canonical and alternative transcript expression of PAX6 and CXCR4 in pancreatic cancer[J]. Oncol Lett, 2017, 13(6): 4027-34. |
| [10] | Saxami G, Karapetsas A, Chondrou P, et al. Potentially probiotic Lactobacillus strains with anti-proliferative activity induce cytokine/ chemokine production and neutrophil recruitment in mice[J]. Benef Microbes, 2017, 16: 1-10. |
| [11] | 卢玮, 高玉华, 王珍子, 等. 安络化纤丸对肝纤维化大鼠转化生长因子β1及相应信号通路的影响[J]. 中华肝脏病杂志, 2017, 25(4): 257-62. |
| [12] | Feng C, He J, Zhang Y, et al. Collagen-derived N-acetylated proline-glycine-proline upregulates the expression of proinflammatory cytokines and extracellular matrix proteases in nucleus pulposus cells via the NF-κB and MAPK signaling pathways[J]. Int J Mol Med, 2017, 40(1): 164-74. |
| [13] | Nguyen-Hoai T, Pham-Duc M, Gries M, et al. CCL4 as an adjuvant for DNA vaccination in a Her2/neu mouse tumor model[J]. Cancer Gene Ther, 2016, 23(6): 162-7. DOI: 10.1038/cgt.2016.9. |
| [14] | Jiang J, Wang M, Liang B, et al. In vivo effects of methamphetamine on HIV-1 replication: A population-based study[J]. Drug Alcohol Depend, 2016, 159: 246-54. DOI: 10.1016/j.drugalcdep.2015.12.027. |
| [15] | Mencarelli A, Graziosi L, Renga B, et al. CCR5 antagonism by maraviroc reduces the potential for gastric cancer cell dissemination[J]. Transl Oncol, 2013, 6(6): 784-93. DOI: 10.1593/tlo.13499. |
| [16] | Sanchooli J, Sanadgol N, Kazemi Arababadi M, et al. CCR5 plays important roles in hepatitis B infection[J]. Viral Immunol, 2014, 27(1): 2-6. DOI: 10.1089/vim.2013.0067. |
| [17] | Vega JA, Villegas-Ospina S, Aguilar-Jiménez W, et al. Haplotypes in CCR5-CCR2, CCL3 and CCL5 are associated with natural resistance to HIV-1 infection in a Colombian cohort[J]. Biomedica, 2017, 37(2): 267-73. |
| [18] | Liu JY, Li F, Wang LP, et al. CTL-vs Treg lymphocyte-attracting chemokines, CCL4 and CCL20, are strong reciprocal predictive markers for survival of patients with oesophageal squamous cell carcinoma[J]. Br J Cancer, 2015, 113(5): 747-55. DOI: 10.1038/bjc.2015.290. |
| [19] | Ward ST, Li KK, Hepburn E, et al. The effects of CCR5 inhibition on regulatory T-cell recruitment to colorectal cancer[J]. Br J Cancer, 2015, 112(2): 319-28. DOI: 10.1038/bjc.2014.572. |
| [20] | Wu Y, Li YY, Matsushima K, et al. CCL3-CCR5 axis regulates intratumoral accumulation of leukocytes and fibroblasts and promotes angiogenesis in murine lung metastasis process[J]. J Immunol, 2008, 181(9): 6384-93. DOI: 10.4049/jimmunol.181.9.6384. |
| [21] | Zhang T, Guo CJ, Li Y, et al. Interleukin-1beta induces macrophage inflammatory protein-1beta expression in human hepatocytes[J]. Cell Immunol, 2003, 226(1): 45-53. DOI: 10.1016/j.cellimm.2003.10.005. |
| [22] | Mañes S, Mira E, Colomer R, et al. CCR5 expression influences the progression of human breast cancer in a p53-dependent manner[J]. J Exp Med, 2003, 198(9): 1381-9. DOI: 10.1084/jem.20030580. |
| [23] | Issafras H, Angers S, Bulenger S, et al. Constitutive agonistindependent CCR5 oligomerization and antibody-mediated clustering occurring at physiological levels of receptors[J]. J Biol Chem, 2002, 277(38): 34666-73. DOI: 10.1074/jbc.M202386200. |
| [24] | El-Asmar L, Springael JY, Ballet S, et al. Evidence for negative binding cooperativity within CCR5-CCR2b heterodimers[J]. Mol Pharmacol, 2005, 67(2): 460-9. |
| [25] | Isik N, Hereld D, Jin T. Fluorescence resonance energy transfer imaging reveals that chemokine-binding modulates heterodimers of CXCR4 and CCR5 receptors[J]. PLoS One, 2008, 3(10): e3424. DOI: 10.1371/journal.pone.0003424. |
| [26] | Ganju RK, Brubaker SA, Chernock RD, et al. Beta-chemokine receptor CCR5 signals through SHP1, SHP2, and Syk[J]. J Biol Chem, 2000, 275(23): 17263-8. DOI: 10.1074/jbc.M000689200. |
| [27] | Chong ZZ, Maiese K. The Src homology 2 domain tyrosine phosphatases SHP-1 and SHP-2: diversified control of cell growth, inflammation, and injury[J]. Histol Histopathol, 2007, 22(11): 1251-67. |
 2017, Vol. 37
2017, Vol. 37

