前列腺癌是威胁老年男性生命健康的最常见恶性肿瘤之一,近年来我国的前列腺癌发病率呈现逐年上升的趋势[1]。外周带是前列腺癌的好发部位,70%~75%发生于外周带[2]。前列腺多参数磁共振成象(mp-MRI)是目前公认的诊断前列腺癌最好的影像检测方式,可用于前列腺癌的检测、定位、局部分期、危险度分层,并可用于引导穿刺活检和治疗指导等[3-5]。2015年发布的前列腺影像报告与数据系统第2版(PI-RADS v2)在mp-MRI的基础上可为外周带的前列腺癌诊断提供半定量化的标准[6]。但由于外周带亦是前列腺炎的好发部位,因此鉴别诊断外周带的前列腺癌与前列腺炎一直都是影像诊断的难点[7-8]。临床常用前列腺特异性抗原(PSA)作为前列腺癌的检测与筛查手段,其获取容易、方法简单,但其不足在于无法确定病变的位置[9]。本研究旨在建立联合PI-RADS v2评分与PSA的Logistic预测模型,对比单独使用PI-RADS v2评分对外周带前列腺癌的诊断能力,以评价其对外周带前列腺癌的诊断能力,指导选择合适的患者行前列腺穿刺,在提高前列腺穿刺诊断率的同时避免浪费医疗资源。
1 资料和方法 1.1 一般资料收集2014年12月~2016年8因PSA升高( > 4 ng/mL)于本院行MRI检查的250例患者。病理结果均经穿刺活检及手术病理证实,穿刺方式为B超引导下经直肠前列腺穿刺活检,采用标准13针法,对影像发现异常的区域再穿1~3针。手术方式为经尿道前列腺电切术。病例排除标准:患者在行磁共振检查前接受过治疗,如激素治疗、放疗等;活检与其后的MRI检查间隔小于6周;病人存在极值变量(PSA > 50 ng/nL)或为前列腺癌其他病理类型;图像质量不佳,影响分析评价。最后本研究共纳入178例患者,前列腺癌组69例,非前列腺癌组(前列腺炎及良性前列腺增生)109例,从2组中各随机抽出一半病例分入建模组,其余分入验证组。
1.2 MRI检查方法使用3.0T磁共振(Philips,Achieva)扫描装置,以体线圈为射频发射线圈,以腹部相控阵线圈为接收线圈。检查前患者适量饮水防止过度充盈引起波动伪影及检查时间过长致患者无法耐受检查。盆腔置于线圈内,中心对准耻骨联合上缘,横断面扫描包括前列腺及精囊腺。横轴位T2WI采用自旋回波序列,TR2900 ms,TE90 ms,回波链长度13,层厚4 mm,层间隔0.4 mm,FOV 260 mm×260 mm,NSA4,层数28,扫描时间4 min 47 s。DWI采用单次激发自旋平面回波序列(singleshotecho-planar, EPI),同时选用扩散加权系数(b值)为0、1000 mm2,TR2000 ms,TE67 ms,层厚3.5 mm,层间隔0.35 mm,FOV 240 mm×240 mm,NSA4,层数28,扫描时间6 min 44 s。DCE采用Medrad高压注射器经肘静脉以2.5 mL/s给予钆喷酸葡胺水平位e-THRIVE序列扫描,TR3.3 ms,TE1.6 ms,层厚4.0 mm,层数80层,FOV 260 mm×260 mm,连续扫描18期,单期扫描时间15 s,共约5 min。
1.3 PSA及PSAD测量在行经直肠指诊、前列腺按摩、导尿等检查前抽取静脉血,tPSA及fPSA通过常规方法确定,并计算f/t PSA比值。前列腺全腺与移行带的横径、前后径、纵径通过观察MRI横断面、矢状面及冠状面测量获得,前列腺体积(cm3)=横径(cm)×前后径(cm)×纵径(cm)×0.52,计算前列腺总体积(PV),移行带体积(TZV),外周带体积(PZV)=PV-TZV,前列腺特异性抗原密度(PSAD)= tPSA/PV,前列腺外周特异性抗原密度(PZ-PSAD)= tPSA/PZV。
1.4 PI-RADS v2评分由2名影像医生在不知晓病理结果和PSA的情况下分析MRI图像,意见不同时经协商解决达成一致。外周带病灶以DWI及ADC评分为主。当DWI及ADC评分为1、2、4、5时,该得分即为最终评分。只当DWI评分为3分时,DCE作为补充序列影响最终评分结果:DCE表现为阳性时,最终评分由3分升高至4分;DCE表现阴性时,最终评维持3分。DWI评分标准:1分:在ADC图和高b值图像上无异常;2分:ADC图模糊低信号;3分:在ADC图局灶性轻或中度低信号,且高b值DWI等信号或轻度高信号;4分:ADC图明显局灶性低信号,高b值DWI显著高信号,且最大层面径线 < 1.5 cm;5分:表现同4分,但最大层面径线≥1.5 cm,或有明确向前列腺外延伸或侵犯。DCE评分标准:阳性:局限性强化,且早于或与临近前列腺组织呈同步强化,且于T2WI或DWI上相应区域有可以发现;阴性:无早期强化;或弥漫性强化,但在T2WI或DWI上未见相应局灶性病灶。
1.5 数据分析采用SPSS21.0软件进行统计学分析。首先使用t检验对前列腺癌与非前列腺癌组PSA、f/tPSA、PSAD、PZ-PSAD及PI-RADS V2评分进行比较,P < 0.05有统计学差异。将有上述统计学差异的指标纳入并进行下一步研究,对照病理结果,建立PSA、f/tPSA、PSAD、PZ-PSAD建立受试者工作特征曲线(ROC),计算曲线下面积(AUC)。以前列腺穿刺活检或术后病理结果作为因变量,分为非前列腺癌组与前列腺癌组(Y=0,1),以上述有统计学差异的指标为自变量进行Binary Logistic多因素方差分析,建立Logistic回归预测模型。回归模型包括4种模式:A、PI-RADS v2 + tPSA;B、PI-RADS v2 + f/tPSA;C、PI-RADS v2 + PSAD;D、PI-RADS v2+PZ-PSAD。P=1/{1+exp(-logit P)},用验证组病例数据代入回归方程产生的P预测概率作为新变量和PI-RADS v2评分,对照病理结果建立ROC并计算其AUC,采用Z检验比较曲线下面积的差异,以P < 0.05有统计学差异,以最大Youden为标准确定其界值,分析灵敏度、特异度、准确度等。
2 结果 2.1 建模组两组各指标统计结果建模组前列腺癌组的tPSA、f/tPSA、PSAD、PZ-PSAD、PI-RADS v2评分分别为:21.46±11.57 ng/mL、0.10±0.08、0.29±0.18 ng/mL· cm3、0.62±0.36 ng/mL· cm3、4.09±0.75;非前列腺癌组分别为8.77±2.82 ng/mL、0.17±0.09、0.10±0.06 ng/mL · cm3、0.17±0.11 ng/mL · cm3、2.91±0.85,两者差异均有统计学意义t=-7.77、4.70、-7.45、-8.68、-6.43,P < 0.01。
2.2 Logistic回归方程将上诉有统计学差异的指标纳入参考变量,前列腺癌的Logistic回归预测模型建立如下:
A:Logit P=-6.825+1.024PI-RADS v2+ 0.223tPSA(χ2=55.551,P < 0.01)
B:Logit P=-4.354+1.586PI-RADS v2-12.7841f/ tPSA(χ2=47.487,P < 0.01)
C:Logit P=-8.993+1.630PI-RADS v2+ 17.091PSAD(χ2=66.661,P < 0.01)
D:Logit P=-9.434+1.596PI-RADS v2+ 10.494PZ-PSAD(χ2=75.734,P < 0.01)
2.3 验证组两组各指标统计结果前列腺癌组和非前列腺癌组的tPSA、f/t PSA、PSAD、PZ-PSAD、PI-RADS v2评分差异均有统计学意义(t=-7.89、4.61、-7.34、-8.62、-6.52,P < 0.01)。tPSA、f/tPSA、PSAD、PZ-PSAD四者诊断外周带前列腺癌的ROC曲线下面积分别为0.862、0.770、0.881、0.914(图 1)。
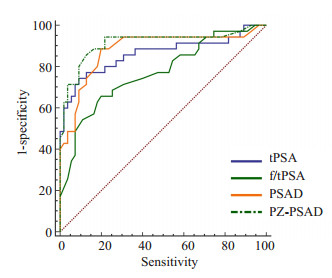
|
图 1 4种PSA指标诊断外周带PCa的ROC曲线 Figure 1 ROC curve of peripheral zone PCa diagnosis using 4 PSA indexes. |
将验证组数据带入Logistic回归预测模型,得到预测概率后建立ROC曲线。回归预测模型A、B、C、D的AUC分别为0.908、0.891、0.944、0.961,均高于PI-RADS V2评分的AUC(0.828),4种回归模型的AUC与PI-RADS V2的AUC差异均具有统计学意义(Z=2.44、2.68、3.11、3.41,P < 0.05)(图 2),五者诊断效能见表 1,说明PI-RADS v2评分与PSA结合的Logistic回归预测模型对外周带前列腺癌的诊断准确性较高,具有临床诊断意义,而且相对于单独使用PI-RADS V2诊断,联合诊断提高了诊断效能,并以D回归预测模型为最佳。当模型A、B、C、D预测概率分别取0.51、0.55、0.36、0.35为界值时,A、B、C、D模型达到其最佳灵敏度与特异度(表 1);PI-RADS v2评分≥4分为诊断界值时其灵敏度及特异度为82.86%与76.36%。可观察到9例原先在PI-RADS v2评分≥4分而被诊断为前列腺癌的患者因参考了PZ-PSAD,被诊断为非前列腺癌,并与病理相符(图 3、4)。
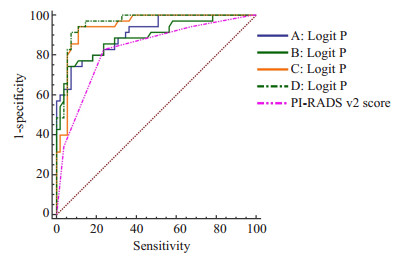
|
图 2 4种回归模型、PI-RADS v2诊断外周带的ROC曲线 Figure 2 ROC curve of peripheral zone PCa diagnosis using the 4 logistic regression models and PI-RADS v2 scores. |
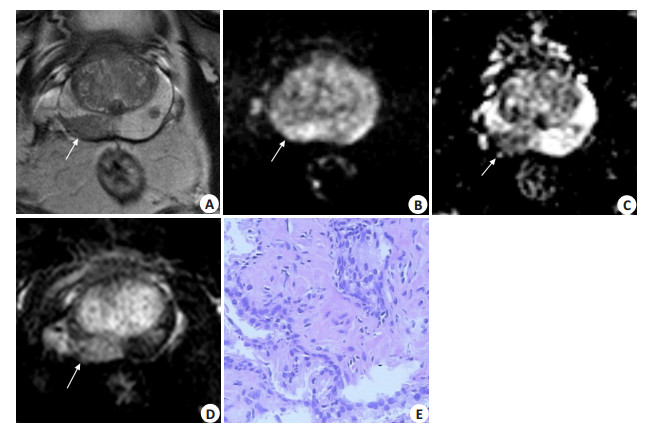
|
图 3 患者男,70岁,PZ-PSAD 0.20 ng/(mL · cm3) Figure 3 MRI and pathological findings in a 70-year-old male patient with PZ-PSAD of 0.20 ng· mL-1· cm-3. A: Axial T2WI showing a focal hypointense T2 signal lesion in the right PZ (arrow); B, C: Diffusion-weighted imaging displaying a moderate-hyperintense lesion in the PZ and corresponding low signal intensity on the ADC map (arrow). The PI-RADS v2 scores was 3. D: DCE-MRI showing a focal early contrast enhancement in this area (positive). The patient's last PI-RADS v2 scores increased to 4 and a diagnosis of PCa was made. E: Histopathology revealing prostatitis. The logistic model D resulted in a predicted probability of 0.27 < 0.35 to support the diagnosis of non-PCa consistent with the histological findings. |
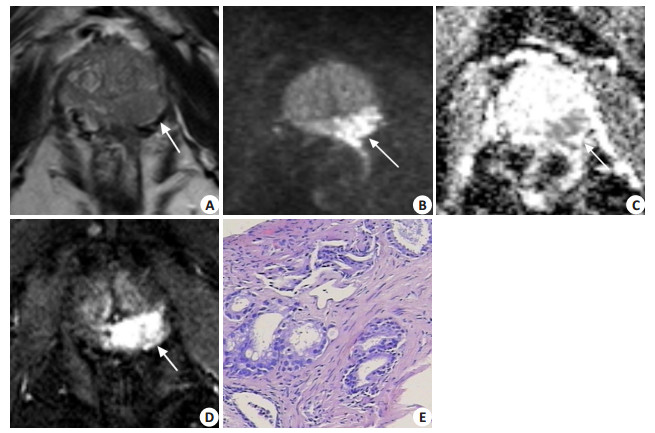
|
图 4 患者男,65岁,PZ-PSAD 0.31 ng/(mL · cm3) Figure 4 MRI and pathological findings in a 65-year-old male patient with PZ-PSAD of 0.31 ng· mL-1· cm-3. A: Axial T2WI showing a hypointense T2 signal lesion with mass effect in the left PZ (arrow); B, C: Diffusion-weighted imaging demonstrating a area in the PZ with high signal intensity (arrow) and corresponding low signal intensity on the ADC map (arrow). The maximum diameter of the area was > 1.5 cm, and the PI-RADS v2 score was 5. D: DCE-MRI showing a focal early contrast enhancement in this area (positive). The last PI-RADS v2 score of the patient was still 5 and a diagnosis of PCa was made. E: Histopathology revealing a PCa Gleason score of 7 (4 + 3). Logistic model D resulted in a predicted probability of 0.86 > 0.35 to support the diagnosis of PCa as was consistent with the histological results. |
| 表 1 4种回归模型、PI-RADS v2的诊断效能 Table 1 Diagnostic efficiency of the 4 logistic regression models and PI-RADS v2 scores |
PSA是由前列腺腺泡及导管上皮细胞分泌的特异性糖蛋白,正常人血液PSA含量很少,而当前列腺癌、前列腺炎时可破坏前列腺腺管及原有生理屏障通过淋巴导管进入血液循环,从而导致PSA升高。tPSA是临床最常用的筛查前列腺癌的肿瘤标记物,但年龄、BPH及前列腺炎均可引起其升高[10]。f/tPSA对前列腺癌的诊断原理为fPSA与前列腺癌的发生率呈负相关,但前列腺炎tPSA升高,血清fSPA降低,这与前列腺癌相类似[11]。PSAD主要利用前列腺癌的单位体积的PSA通常要高于BPH,故PSAD可校正BPH引起的前列腺体积增大对tPSA升高的影响[12]。PZ-PSAD是在PSAD的基础上发展而来,前列腺癌的外周带体积较前列腺炎先发生变化,因此PZ-PSAD主要用于鉴别外周带前列腺癌与前列腺炎[13]。本研究前列腺癌与非前列腺癌组tPSA、f/tPSA、PSAD、PZ-PSAD差异均有统计学意义(P < 0.01)且四者诊断外周带前列腺癌的ROC曲线下面积分别为0.862、0.770、0.881、0.914 > 0.7,均具有较高的诊断价值,但其不足在于无法判断病变的位置
2014年,美国放射学会、欧洲泌尿放射学会和AdMeTech基金会共同发布了PI-RADS v2并提出对移行带与外周带进行分开评分并各自具有主要评分序列及次要评分序列,外周带以DWI为主要评分序列,DCE作为次要评分序列[14-15]。本研究使用PI-RADS v2对外周带前列腺癌进行诊断时,其灵敏度及特异度分别为82.86%与76.36%,与既往研究报道相类似[16],其灵敏度尚可,但特异度相对较低。笔者分析其原因可能如下:外周带除是前列腺癌的好发部位,亦是前列腺炎的好发部位。前列腺炎与前列腺癌于T2WI上可表现为外周带局限性或弥漫性低信号,因此T2WI的低信号对前列腺癌不具有特异度[17-18]。而从外周带主要评分序列DWI考虑,前列腺癌细胞体积小、细胞核大,包浆减少,细胞外间隙缩小,前列腺癌的水分子扩散运动明显受限而导致DWI呈高信号,而部分前列腺炎常因大量炎症细胞聚集细胞密度升高,使水分子扩散受限而导致DWI呈高信号[19-20];对于次要评分序列DCE而言,前列腺癌血供通常较丰富,于DCE上呈早期快速强化,虽多数前列腺炎于DCE上不出现早期局限性强化,但仍有小部分前列腺炎可在DCE上出现早期局限性强化[21-22]。故外周带前列腺癌与前列腺炎在DWI与DCE存在表现“灰区”而使两者的鉴别诊断难度加大,因此基于DWI与DCE的PI-RADS v2评分对外周带前列腺癌诊断特异度相对较差。
虽然与本研究使用相同模型的应用尚未见报道,但之前类似联合使用mp-MRI与PSA诊断前列腺癌a的报道与本研究相接近,mp-MRI联合PSA诊断前列腺癌的诊断效能无一例外都比单独使用mp-MRI诊断效能要高[23-25]。本研究将PI-RADS v2评分与PSA指标相结合使用后,其诊断效能较PI-RADS v2评分单独使用明显提高,ROC曲线的AUC明显高于PI-RADS v2评分单独使用,特异度均得到不同程度的提升,加入PSA指标对PI-RADS v2评分的影响主要在于弥补其特异度的不足。在4种回归模型中,以D模型的诊断价值最高(0.961),D模型加入了PZ-PSAD指标,而PZ-PSAD主要用于鉴别外周带前列腺癌与前列腺炎。当PZ-PSAD与PI-RADS v2评分构成D模型并以0.35为模型预测概率的界值时,其灵敏度及特异度(91.43%与92.73%)明显高于单独使用PI-RADS v2评分时的灵敏度及特异度(82.86%与76.36%),尤其以特异度提升幅度较大(16.37%)。因此D模型主要优势在于避免不必要的穿刺,减轻患者的创伤与心理负担。临床工作中tPSA获取容易、方法简单,前列腺PZ体积可通过测量MRI数据计算获得,故PZ-PSAD获取并不困难,这为D模型的临床使用提供了可行性。
本研究的不足:第一,样本量较小,可能会影响良恶性鉴别诊断价值的评价。第二、部分病例以TRUS引导穿刺活检作为病理结果,可能存在假阴性。
综上所述,联合PI-RADS v2评分与PSA指标的Logistic回归预测模型对外周带前列腺癌的诊断效能优于单独使用PI-RADS v2评分,其主要优点在于明显提高单独使用PI-RADS v2评分对外周带前列腺癌诊断的特异度,为可疑外周带前列腺癌患者行穿刺提供了更可靠的依据。
| [1] | 韩苏军, 张思维, 陈万青, 等. 中国前列腺癌发病现状和流行趋势分析[J]. 临床肿瘤学杂志, 2013, 18(4): 330-4. |
| [2] | Li S, Chen M, Wang W, et al. A feasibility study of Mr elastography in the diagnosis of prostate cancer at 3.0T[J]. Acta Radiol, 2011, 52(3): 354-8. DOI: 10.1258/ar.2010.100276. |
| [3] | Gordetsky JB, Nix JW, Rais-Bahrami S. Perineural invasion in prostate cancer is more frequently detected by multiparametric MRI targeted biopsy compared with standard biopsy[J]. Am J Surg Pathol, 2016, 40(4): 490-4. DOI: 10.1097/PAS.0000000000000546. |
| [4] | Ho R, Siddiqui MM, George AK, et al. Preoperative multiparametric magnetic resonance imaging predicts biochemical recurrence in prostate cancer after radical prostatectomy[J]. PLoS One, 2016, 11(6): e0157313. DOI: 10.1371/journal.pone.0157313. |
| [5] | Vargas HA, Hötker AM, Goldman DA, et al. Updated prostate imaging reporting and data system (PIRADS v2) recommendations for the detection of clinically significant prostate cancer using multiparametric MRI: critical evaluation using whole-mount pathology as standard of reference[J]. Eur Radiol, 2016, 26(6): 1606-12. DOI: 10.1007/s00330-015-4015-6. |
| [6] | Rosenkrantz AB, Babb JS, Taneja SS, et al. Proposed adjustments to PI-RADS version 2 decision rules: impact on prostate cancer detection[J]. Radiology, 2017, 283(1): 119-29. DOI: 10.1148/radiol.2016161124. |
| [7] | Bhowmik NM, Yu J, Fulcher AS, et al. Benign causes of diffusion restriction foci in the peripheral zone of the prostate: diagnosis and differential diagnosis[J]. Abdom Radiol (NY), 2016, 41(5): 910-8. DOI: 10.1007/s00261-016-0719-6. |
| [8] | Meier-Schroers M, Kukuk G, Wolter K, et al. Differentiation of prostatitis and prostate cancer using the Prostate Imaging-Reporting and Data System (PI-RADS)[J]. Eur J Radiol, 2016, 85(7): 1304-11. DOI: 10.1016/j.ejrad.2016.04.014. |
| [9] | 蒋方方, 汪剑, 吴骋, 等. 血清前列腺特异抗原与磁共振波谱成像对前列腺癌的诊断价值[J]. 中华临床医师杂志:电子版, 2012, 06(7): 167-9. |
| [10] | 肖丽萍, 毕向军, 李亚南, 等. 前列腺特异性抗原对前列腺癌早期诊断的价值[J]. 南方医科大学学报, 2007, 27(1): 107-8. |
| [11] | Catalona WJ, Southwick PC, Slawin KM, et al. Comparison of percent free PSA, PSA density, and age-specific PSA cutoffs for prostate cancer detection and staging[J]. Urology, 2000, 56(2): 255-60. DOI: 10.1016/S0090-4295(00)00637-3. |
| [12] | Milkovic B, Dzamic Z, Pejcic T, et al. Evaluation of free-to-total prostate specific antigen (F/T PSA), prostate specific antigen density (PSAD) and (F/T)/PSAD sensitivity on reduction of unnecessary prostate biopsies for patients with PSA in gray zone[J]. Ann Ital Chir, 2015, 85(5): 448-53. |
| [13] | 毕革文, 周元明, 覃智标, 等. Ⅲ型前列腺炎PSA及其相关形式对筛选早期前列腺癌的临床意义[J]. 广西医学, 2013, 35(2): 159-62. |
| [14] | Purysko AS, Rosenkrantz AB, Barentsz JO, et al. PI-RADS version 2: a pictorial update[J]. Radiographics, 2016, 36(5): 1354-72. DOI: 10.1148/rg.2016150234. |
| [15] | Barentsz JO, Weinreb JC, Verma S, et al. Synopsis of the PI-RADS v2 guidelines for multiparametric prostate magnetic resonance imaging and recommendations for use[J]. Eur Urol, 2016, 69(1): 41-9. DOI: 10.1016/j.eururo.2015.08.038. |
| [16] | 姬广海, 孛茹婷, 郑义, 等. 基于第2版前列腺影像报告和数据系统的多参数MRI诊断外周带前列腺癌[J]. 中国医学影像技术, 2016, 32(9): 1414-8. |
| [17] | Rosenkrantz AB, Mannelli L, Kong XA, et al. Prostate cancer: utility of fusion of T2-Weighted and high b-Value DiffusionWeighted images for peripheral Zone tumor detection and localization[J]. J Magn Reson Imaging, 2011, 34(1): 95-100. DOI: 10.1002/jmri.v34.1. |
| [18] | Kitajima K, Kaji Y, Fukabori Y, et al. Prostate cancer detection with 3 T MRI: comparison of diffusion-weighted imaging and dynamic contrast-enhanced MRI in combination with T2-weighted imaging[J]. J Magn Reson Imaging, 2010, 31(3): 625-31. DOI: 10.1002/jmri.v31:3. |
| [19] | Panebianco V, Sciarra A, Marcantonio A, et al. Conventional imaging and Multiparametric Magnetic Resonance (MRI, MRS, DWI, MRP) in the diagnosis of prostate cancer[J]. Q J Nucl Med Mol Imaging, 2012, 56(4): 331-42. |
| [20] | Esen M, Onur MR, Akpolat N, et al. Utility of ADC measurement on diffusion-weighted MRI in differentiation of prostate cancer, normal prostate and prostatitis[J]. Quant Imaging Med Surg, 2013, 3(4): 210-6. |
| [21] | 王宜飞, 李亮, BailiQ, 等. 类似肿瘤表现的前列腺炎的多模态MRI表现[J]. 临床放射学杂志, 2014, 33(4): 540-3. |
| [22] | Quon JS, Moosavi B, Khanna M, et al. False positive and false negative diagnoses of prostate cancer at multi-parametric prostate MRI in active surveillance[J]. Insights Imaging, 2015, 6(4): 449-63. DOI: 10.1007/s13244-015-0411-3. |
| [23] | 李鹏, 杨文君, 陈志强, 等. T2WI和DWI联合血清前列腺特异抗原系列诊断前列腺癌[J]. 中国医学影像技术, 2013, 29(4): 612-6. |
| [24] | 汤洁, 刘晓航. 前列腺癌弥散加权成像与非影像学指标结合的Logistic回归预测模型[J]. 肿瘤影像学, 2014, 23(4): 329-33. |
| [25] | Rais-Bahrami S, Siddiqui MM, Vourganti S, et al. Diagnostic value of biparametric magnetic resonance imaging (MRI) as an adjunct to prostate-specific antigen (PSA)-based detection of prostate cancer in men without prior biopsies[J]. BJU Int, 2015, 115(3): 381-8. DOI: 10.1111/bju.12639. |
 2017, Vol. 37
2017, Vol. 37

