2. 南方医科大学南方医院, 检验科,广东 广州 510515
2. Clinical Laboratory, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
原发性肝癌是我国最常见的肿瘤之一,最新的研究显示,我国原发性肝癌的发病率和癌症相关死亡率分别排在所有恶性肿瘤的第3位和第2位[1],其中绝大多数(85%~90%)为肝细胞癌(HCC)[2]。虽然近年来肝癌切除术与抗病毒药物的应用使患者受益大大增加,但HCC的5年复发率仍然达到70%[3]。因此,有必要对HCC的发生发展机制展开深入探究。
HCC的发生发展是多基因相互作用的过程,包括多种癌基因和抑癌基因表达水平的变化、表观遗传因素的改变,同时涉及多种细胞信号转导通路,如研究较为明确的p53、Ras基因,MAPK、JAK/STAT、Wnt及hedgehog信号通路等[2]。人类Wnt基因家族由19个家族成员组成,它们通过与相应的至少15种受体或协同受体结合(10种fzd受体及Ryk, Ror1, Ror2和Lrp5/6),向细胞内传递信号[4]。为了更清晰地认识复杂的Wnt信号通路,人们将其分为经典Wnt信号通路和非经典信号通路,后者包括Wnt/Ca2+信号通路、Wnt/PCP信号通路以及近年发现的其他非经典通路[4]。Wnt信号通路主要参与了胚胎的正常发育过程及各种内环境稳态的维持,而Wnt通路的异常与多种疾病密切相关,包括代谢性疾病,退行性疾病以及各种肿瘤的发生、发展[5]。
在家族成员中,Wnt5b与Wnt5a相似性最大,有80.5%氨基酸序列完全相同,因此,Wnt5b可能与Wnt5a共用一部分Fzd受体,并介导产生相似的效应[6],如近期有研究报道Wnt5a/b均可与Fzd2受体结合,通过活化Fzd2-Fyn-Stat3信号轴,调控肿瘤细胞EMT相关基因的表达[7]。Wnt5b在胎肺、肾脏、成人肝脏、卵巢及小肠组织中呈弱表达,在成人前列腺和胎儿脑组织中中度表达[6],而在肿瘤中的研究显示,Wnt5b在来自晚期间质型肝癌、乳腺癌、肺癌及直肠癌的细胞株中及慢性淋巴细胞白血病细胞中高表达[7-8]。在口腔鳞癌和结直肠癌细胞中,Wnt5b的异常表达参与了癌细胞的迁移侵袭[9-10]。但目前尚无Wnt5b在HCC组织中表达情况及作用机制的系统研究。因此,本研究拟通过qRT-PCR和免疫组织化学染色两种方法,分别检测Wnt5b mRNA、蛋白在HBV相关HCC癌和非癌组织中的表达,观察并分析其与临床病理参数及术后无瘤生存时间之间的关系,从而初步探究Wnt5b对HBV相关HCC发生、发展的作用,为进一步研究Wnt5b在肝癌发生、发展中的信号传导机制提供线索。
1 资料和方法 1.1 标本来源本研究按照以下纳入标准筛选了在2010年11月~ 2015年5月期间,于南方医科大学南方医院肝胆外科因HBV相关HCC住院,并行根治性肝癌切除术(Ⅰ级标准)的患者[11]:(1)术前血清学检查与术后病理检测证实为HBV相关HCC,无丙肝感染;(2)术前未行其他治疗,如:肝动脉栓塞化疗、射频消融治疗、免疫治疗等;(3)切缘无癌残留;(4)临床资料完整、手术切除后的样本符合实验要求。共筛选得到289例患者。随后,我们通过简单随机抽样的方法,从中抽取了两组患者(各100例),分别用qRT-PCR(队列1)和免疫组织化学染色法(队列2)检测Wnt5b在患者肿瘤组织和非癌组织中mRNA和蛋白质表达水平。非癌组织取自离肿瘤边缘尽可能远的部位(至少2 cm以上)。患者临床病理资料见表 1(即队列1)和表 2(即队列2)。
| 表 1 HBV相关HCC患者Wnt5b mRNA相对表达水平与临床病理参数间的关系 Table 1 Association between Wnt5b mRNA expression and clinicopathological parameters in HBV-related HCC patients (n=100) |
| 表 2 HBV相关HCC患者癌组织中Wnt5b蛋白表达与临床病理参数间的关系 Table 2 Association between Wnt5b protein expression in tumor tissues and clinicopathological parameters in HBV-related HCC patients (n=100) |
所有患者通过术后定期至门诊或电话随访,连续3次无法取得联系的患者定义为失访病例。随访时间:自手术日起至2016年8月1日,因此至随访截止时,每1例患者至少已随访14个月。我们定义转移为:患者术前影像学检查或术中发现存在管腔内癌栓(包括门静脉、肝静脉及胆管癌栓)、淋巴结转移、肝外转移或术后6个月内复发[12];复发为:术后经两种影像学检查证实存在肝癌特征性的占位性病变,或一种影像学检查提示存在肝癌特征性占位性病变,同时伴有甲胎蛋白水平(AFP)持续性增高(排除妊娠、生殖系胚胎源性肿瘤及活动性肝炎)。截至随访截止时间,队列1和2中分别有52例(52.0%)和51例(51.0%)患者术后肿瘤复发,分别有6例(6.0%)和4例(4.0%)患者失访。
1.3 主要试剂与仪器RNAiso plus(9109)、逆转录试剂盒(RR047A)及qRT-PCR试剂盒(RR420)均购自Takara;qRT-PCR引物由生工生物工程(上海)股份有限公司设计并合成;Anti-Wnt5b兔抗人多克隆抗体(ab94914)购自Abcam,免疫染色一抗稀释液(P0103)购自上海碧云天生物技术有限公司;免疫组化二抗即山羊抗兔/小鼠IgG/HRP(PV-6000)、DAB染色液(PV-6000)均购自北京中杉金桥生物技术有限公司。ThermoND2000C超微量分光光度计(Thermo)、GeneAmp PCR system 9700扩增仪(PerkinElmer)、LightCycler®480 IISystem(Roche)分别用于RNA浓度测定、逆转录反应及qRT-PCR检测。
1.4 组织总RNA提取、cDNA合成取适量-80 ℃冰箱冻存的新鲜组织,加入至1 mL RNAiso plus中,研磨至匀浆;按5:1体积比加入0.2 mL氯仿,剧烈震荡15 s,室温静置10 min,4 ℃离心,取上清;按1:1加入异丙醇,离心收集沉淀(即RNA),75%乙醇洗涤沉淀;晾干后DEPC水溶解至适宜浓度。分光光度计测总RNA浓度,1.80≤A260/280≤2.0表明RNA纯度合格;总RNA电泳见清晰28 S和18 S条带,表明RNA未降解。cDNA的合成及qRT-PCR均按照试剂盒内说明书进行操作。Wnt5b前向引物:5'-TGGTTAGAGGA CTGCCTGTG-3',反向引物5'-TGGACAAGACCCTG AAGACA-3';内参(GAPDH)前向引物:5'-CAGGAGG CATTGCTGATGAT-3',反向引物5'-GAAGGCTGGG GCTCATTT-3'。2-ΔΔCT法用于计算Wnt5b mRNA在癌组织中相对于非癌组织的表达水平[13],根据中位数将所有病例分为低表达组和高表达组[14]。
1.5 免疫组织化学染色检测Wnt5b蛋白的表达4%多聚甲醛固定标本,石蜡包埋,切片;65 ℃烘烤2 h,二甲苯脱蜡,梯度酒精水化,微波低火抗原修复10 min,冷却至室温,3%过氧化氢15 min以阻断内源性过氧化物酶,1% BSA封闭30 min,4 ℃一抗孵育过夜;次日室温孵育二抗15 min,DAB显色,苏木素染核,1%盐酸酒精分化,氨水返蓝;梯度乙醇脱水,二甲苯透明,中性树胶封片。
结果判断:每例标本均由两位病理科医师独立阅片。Wnt5b为胞外分泌糖蛋白,定义细胞质及细胞外基质被染成浅棕色至深褐色为阳性(图 1)。根据改良后的免疫组化结果评分方法对结果进行评分:按着色强度分别将无着色、轻度着色、中度着色及深度着色记为0分、1分、2分和3分;按阳性细胞占总细胞数的比例,分别将0%、1%~10%、11%~50%及≥51%记为0分、1分、2分和3分;用着色强度和阳性细胞分布比例得分的乘积代表组织Wnt5b蛋白的表达水平,总分为0~9分,定义0~1分为阴性,≥2分为阳性[15]。
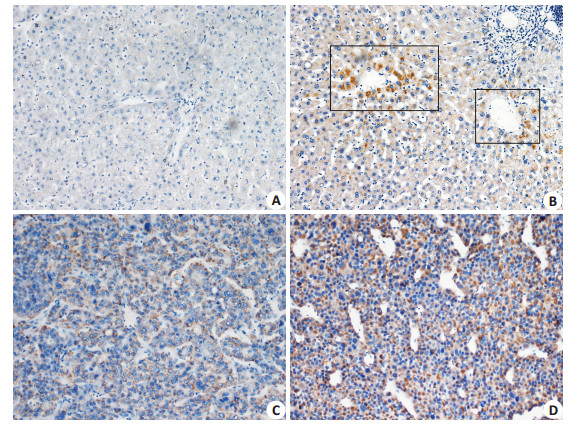
|
图 1 免疫组织化学染色法检测Wnt5b蛋白在HBV相关HCC癌组织及非癌组织中的表达 Figure 1 Representative images of immunohistochemical staining of Wnt5b protein in HBV-related HCC tissues and adjacent tissues (Original magnification: ×200). A: Negative expression of Wnt5b protein in adjacent tissue; B: Positive expression of Wnt5b protein in adjacent tissues, especially in cells around the central vein of the hepatic lobules; C, D: Positive expression of Wnt5b protein in tumor tissues. |
采用IBM SPSS20.0统计分析软件。癌组织与非癌组织间Wnt5b蛋白表达阳性率间的比较、Wnt5b mRNA及蛋白质表达水平与临床病理参数间的关系均采用卡方检验;Kaplan-Meier法分析不同Wnt5b表达水平组的无瘤生存时间,Log-rank法计算组间差异,P < 0.05认为差异有统计学意义。
2 结果 2.1 Wnt5b mRNA的表达与患者临床病理参数间的关系实时荧光定量PCR发现,患者癌组织中Wnt5b普遍较非癌组织高表达(65.0%,65/100,图 2)。根据中位数(median=1.51)将100例患者分为高表达组和低表达组,统计分析与临床病理参数间的关系:Wnt5b的相对表达水平与患者肿瘤大小(P=0.046)、TNM分期(P=0.026)、BCLC分期(P=0.001)、术前是否存在肿瘤转移(P=0.005)、是否复发(P=0.006)以及术后无瘤生存时间的长短显著相关(P=0.005,表 1)。
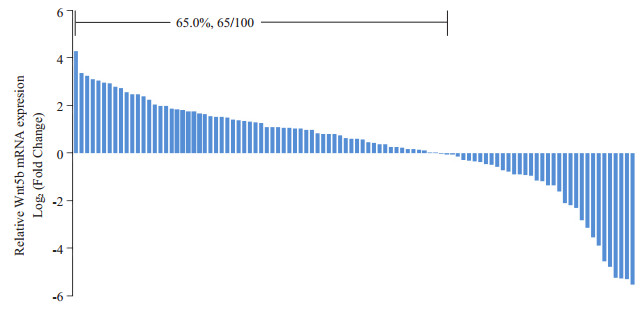
|
图 2 Wnt5b mRNA在HBV相关HCC癌组织中的相对表达水平[Log2(2-ΔΔct)对数转换,> 0表示Wnt5bmRNA的表达水平高于对应的非癌组织 Figure 2 Relative Wnt5b mRNA expression in HBV-related HCC tissues compared with adjacent tissues [Log2(2-ΔΔct) logarithmic transformation, > 0 represents that Wnt5b mRNA expression in HCC tissue is higher than that in adjacent noncancerous tissue]. |
对患者肿瘤组织及非癌组织进行免疫组织化学染色,发现在肿瘤组织中Wnt5b蛋白的阳性率(58.0%,58/100)显著高于非癌组织(22.0%,22/100),结果具有显著差异(P=0.000)。进一步统计分析肿瘤组织中Wnt5b的表达水平与临床病理参数间的关系:Wnt5b在肿瘤组织中的表达水平与患者肿瘤的数目(P=0.009)、大小(P=0.015)、病理分化程度(P=0.005)、TNM分期(P=0.031)、巴塞罗那分期(P=0.048)、术前是否存在肿瘤转移(P=0.012)、是否复发(P=0.010)以及术后无瘤生存时间的长短显著相关(P=0.002,表 2)。此外,我们发现在非癌组织中Wnt5b蛋白阳性或染色更深的细胞往往存在于肝小叶或假小叶的中央静脉周围(9/22,40.9%,图 1B)。
2.3 Wnt5b的表达与患者预后的关系Kaplan-Meier法进一步分析Wnt5b的表达与患者术后无瘤生存时间的关系,结果显示:队列1患者总体中位无瘤生存时间为25.4月,且Wnt5b mRNA高表达组(中位生存时间10.8月)术后无瘤生存时间明显短于低表达组(至观察终点,无瘤生存患者人数超过50%,无法计算中位生存时间,但由图 3A可知,超过60月,P=0.002);队列2患者总体中位无瘤生存时间为31.8月,Wnt5b蛋白阳性组(中位生存时间10.8月)术后无瘤生存时间显著短于阴性组(同样原因无法计算阴性组中位无瘤生存时间,但由图 3B可知,超过60月,P=0.003),结果均具有统计学差异。说明高表达Wnt5b的患者术后发生转移复发的可能性更大,并且更早地复发。
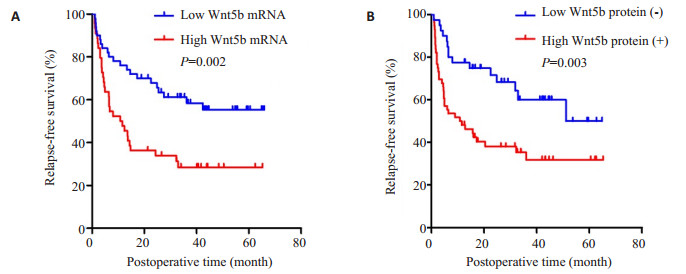
|
图 3 不同Wnt5b mRNA(A)与蛋白(B)表达组术后无瘤生存时间的比较(Kaplan-Meier法) Figure 3 Comparison of post-operative relapse-free survival of patients with in different expressions of Wnt5b mRNA and protein (Kaplan-Meier method). |
在本研究中,我们通过简单随机抽样的方法在近年来本课题组建立的标本库中选取了两组患者,分别检测Wnt5b mRNA和蛋白的表达水平,并首次证实Wnt5b在HBV相关肝细胞癌组织中显著高表达,且其表达水平与患者肿瘤大小、TNM分期、BCLC分期、术前是否存在肿瘤转移等密切相关,在蛋白水平上,Wnt5b的表达水平还与肿瘤数目、病理分化程度密切相关。此外,高表达Wnt5b的患者术后无瘤生存时间更短,提示HBV相关HCC患者中高表达的Wnt5b参与了肿瘤的恶性进展。
近年来对于Wnt5b在肿瘤领域的研究主要集中于肿瘤转移方面。肿瘤的转移是一个多因素级联过程,具有更强迁移侵袭能力的肿瘤细胞首先自原发灶脱离,进入肿瘤或临近组织的脉管系统,最终穿过脉管,在继发部位形成转移灶。期间的每一个步骤都涉及肿瘤细胞的多种生物学功能以及其与组织微环境、免疫系统的交互作用[16]。Gujral等[7]分别在一系列乳腺癌、直肠癌、肝癌及肺癌的细胞株中对Fzd2及其同源配体(Wnt5a和Wnt5b)进行检测,发现三者之间表达水平呈正相关,并均与上皮型标志物呈负相关,与间质标志物呈正相关。深入研究后证实,Wnt5a/b通过与Fzd2受体结合,进而活化Fzd2-Fyn-Stat3信号轴,调控肿瘤细胞的EMT进程, 促进肿瘤转移[7]。在具有高转移潜能的SAS-LM8口腔鳞癌细胞株中,异常高表达的Wnt5b通过活化Wnt/ PCP信号通路(对经典Wnt信号通路相关蛋白及调控基因的表达无影响),促进Cdc42和RhoA蛋白的活化,进而导致细胞骨架重排、丝状伪足形成,最终显著提升SAS-LM8细胞的迁移和侵袭能力[9]。此外,在结直肠癌中有报道称过表达Wnt5b后细胞中JNK信号通路被激活,同时MMP2和MMP9的表达和活化水平均显著增加,促进了肿瘤细胞的迁移和侵袭[10]。我们的研究发现,Wnt5b的表达与HBV相关HCC患者的TNM分期、BCLC分期、转移、复发显著相关,而适合行手术治疗的患者在TNM分期与BCLC分期系统中被归类为Ⅲ/Ⅳ期与C期,很重要的一个因素是发生了肿瘤血管侵犯及肝内外转移[17]。因此,我们在肝癌中的这一发现与其他肿瘤中的研究结论“肿瘤细胞过量分泌的Wnt5b促进肿瘤侵袭转移”相符。
Wnt5b作为一个外分泌糖蛋白,还可通过旁分泌的形式调控肿瘤组织及周围组织中的淋巴内皮细胞,影响淋巴管的形成。Wnt5b在淋巴结转移能力更强的肿瘤细胞株及淋巴结转移的肿瘤组织中显著高表达,并且它的表达水平可有效地预测口腔鳞癌患者是否伴有肿瘤淋巴结转移[18]。深入研究发现,肿瘤细胞中过量分泌的Wnt5b可通过活化淋巴内皮细胞中的经典Wnt信号通路与Wnt/PCP通路,上调Snail和Slug的表达,进而诱导淋巴内皮细胞发生内皮-间质转化,促进淋巴管生成,使肿瘤更易发生淋巴结转移[18]。然而在临床上我们观察到HCC发生淋巴结转移的比例较低,国内外多项研究也报道可手术的HCC患者淋巴结转移的发生率均低于7.5% [19-25],这与本研究中Wnt5b mRNA在HCC中的高表达率65.0%及Wnt5b蛋白在HCC肿瘤组织中的阳性率58.0%均相差甚远。因此,在HCC中Wnt5b与肿瘤细胞发生淋巴结转移可能关系不大。
此外,我们对非癌组织进行免疫组化染色后,首次发现在非癌组织中Wnt5b蛋白阳性的细胞或染色更深的细胞往往存在于肝小叶/假小叶的中央静脉周围。可见,Wnt5b蛋白在非癌组织的表达因在肝小叶/假小叶中部位的不同而异,而这一群Wnt5b蛋白表达更高的肝细胞是否具备独特的生物学特征,甚至是否已初具癌变潜能,有待深入探究。当然,该现象可能尚需抗Wnt5b单克隆抗体(本实验采用多克隆抗体检测)予以验证,排除肝细胞内其他蛋白共同表位的影响。
总之,我们发现Wnt5b高表达与HBV相关HCC的转移、复发及其他一系列临床病理参数显著相关,因此它可能通过影响HCC细胞的增殖、迁移与侵袭能力影响HCC的进展。
| [1] | Chen W, Zheng R, Zuo T, et al. National cancer incidence and mortality in China, 2012[J]. Chin J Cancer Res, 2016, 28(1): 1-11. |
| [2] | Umemura T, Ichijo T, Yoshizawa K, et al. Epidemiology of hepatocellular carcinoma in Japan[J]. Surg Oncol Clin N Am, 2009, 44(19): 102-7. |
| [3] | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245-55. DOI: 10.1016/S0140-6736(11)61347-0. |
| [4] | Liu LJ, Xie SX, Chen YT, et al. Aberrant regulation of Wnt signaling in hepatocellular carcinoma[J]. World J Gastroenterol, 2016, 22(33): 7486-99. DOI: 10.3748/wjg.v22.i33.7486. |
| [5] | Duchartre Y, Kim YM, Kahn M. The Wnt signaling pathway in cancer[J]. Crit Rev Oncol Hematol, 2016, 99(4): 141-9. |
| [6] | Saitoh T, Katoh M. Molecular cloning and characterization of human WNT5B on chromosome 12p13.3 region[J]. Int J Oncol, 2001, 19(2): 347-51. |
| [7] | Gujral TS, Chan M, Peshkin L, et al. A noncanonical frizzled2 pathway regulates epithelial-mesenchymal transition and metastasis[J]. Cell, 2014, 159(4): 844-56. DOI: 10.1016/j.cell.2014.10.032. |
| [8] | Lu D, Zhao Y, Tawatao R, et al. Activation of the Wnt signaling pathway in chronic lymphocytic leukemia[J]. Proc Natl Acad Sci USA, 2004, 101(9): 3118-23. DOI: 10.1073/pnas.0308648100. |
| [9] | Takeshita A, Iwai S, Morita Y, et al. Wnt5b promotes the cell motility essential for metastasis of oral squamous cell carcinoma through active Cdc42 and RhoA[J]. Int J Oncol, 2014, 44(1): 59-68. |
| [10] | Zhang Y, Lin L, Jin Y, et al. Overexpression of WNT5B promotes COLO 205 cell migration and invasion through the JNK signaling pathway[J]. Oncol Rep, 2016, 36(1): 23-30. |
| [11] | 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肝胆病杂志, 2011, 27(11): 1141-59. |
| [12] | Liu X, Huang Y, Jiang C, et al. Methylenetetrahydrofolate dehydrogenase 2 overexpression is associated with tumor aggressiveness and poor prognosis in hepatocellular carcinoma[J]. Dig Liver Dis, 2016, 48(8): 953-60. DOI: 10.1016/j.dld.2016.04.015. |
| [13] | Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6): 1101-8. DOI: 10.1038/nprot.2008.73. |
| [14] | Mudbhary R, Hoshida Y, Chernyavskaya Y, et al. UHRF1 overexpression drives DNA hypomethylation and hepatocellular carcinoma[J]. Cancer Cell, 2014, 25(2): 196-209. DOI: 10.1016/j.ccr.2014.01.003. |
| [15] | Nilsson R, Jain M, Madhusudhan N, et al. Metabolic enzyme expression highlights a key role for MTHFD2 and the mitochondrial folate pathway in cancer[J]. Nat Commun, 2014, 5(3): 3128. |
| [16] | Turajlic S, Swanton C. Metastasis as an evolutionary process[J]. Science, 2016, 352(6282): 169-75. DOI: 10.1126/science.aaf2784. |
| [17] | Pons F, Varela M, Llovet JM. Staging systems in hepatocellular carcinoma[J]. HPB (Oxford), 2005, 7(1): 35-41. DOI: 10.1080/13651820410024058. |
| [18] | Wang SH, Chang JS, Hsiao JR, et al. Tumour cell-derived WNT5B modulates in vitro lymphangiogenesis via induction of partial endothelial-mesenchymal transition of lymphatic endothelial cells[J]. Oncogene, 2017, 36(11): 1503-15. DOI: 10.1038/onc.2016.317. |
| [19] | Ercolani G, Grazi GL, Ravaioli M, et al. The role of lymphadenectomy for liver tumors: further considerations on the appropriateness of treatment strategy[J]. Ann Surg, 2004, 239(2): 202-9. DOI: 10.1097/01.sla.0000109154.00020.e0. |
| [20] | Uenishi T, Hirohashi K, Shuto T, et al. The clinical significance of lymph node metastases in patients undergoing surgery for hepatocellular carcinoma[J]. Surg Today, 2000, 30(10): 892-5. DOI: 10.1007/s005950070040. |
| [21] | Sun HC, Zhuang PY, Qin LX, et al. Incidence and prognostic values of lymph node metastasis in operable hepatocellular carcinoma and evaluation of routine complete lymphadenectomy[J]. J Surg Oncol, 2007, 96(1): 37-45. DOI: 10.1002/(ISSN)1096-9098. |
| [22] | Xiaohong S, Huikai L, Feng W, et al. Clinical significance of lymph node metastasis in patients undergoing partial hepatectomy for hepatocellular carcinoma[J]. World J Surg, 2010, 34(5): 1028-33. DOI: 10.1007/s00268-010-0400-0. |
| [23] | Kobayashi S, Takahashi S, Kato Y, et al. Surgical treatment of lymph node metastases from hepatocellular carcinoma[J]. J Hepatobiliary Pancreat Sci, 2011, 18(4): 559-66. DOI: 10.1007/s00534-011-0372-y. |
| [24] | Awazu M, Fukumoto T, Takebe A, et al. Lymphadenectomy combined with locoregional treatment for multiple advanced hepatocellular carcinoma with lymph node metastases[J]. Kobe J Med Sci, 2013, 59(1): E17-27. |
| [25] | Lee CW, Chan KM, Lee CF, et al. Hepatic resection for hepatocellular carcinoma with lymph node metastasis: clinicopathological analysis and survival outcome[J]. Asian J Surg, 2011, 34(2): 53-62. DOI: 10.1016/S1015-9584(11)60020-1. |
 2017, Vol. 37
2017, Vol. 37

