2. 蚌埠医学院药学院,安徽 蚌埠 233030
2. School of Pharmacy, Bengbu Medical College, Bengbu 233030, China
机体异常的免疫状态与肿瘤的发生发展关系密切[1-2]。近期研究表明[3-6]在喉癌、肺癌、膀胱癌、结肠癌等肿瘤患者外周血CD4+T细胞各亚群失衡。CD4+T淋巴细胞包括Th1、Th2、Th17及调节性T细胞(Treg)4个细胞亚群,这些亚群具有一定可塑性,通过细胞因子相互影响、制约来维持着动态平衡。在分化及功能上Th1/ Th2、Treg/Th17是两对相互制约的平衡体系,对维持机体免疫稳定发挥重要作用,一旦平衡被打破,机体会发生免疫功能失常,导致疾病的发生(炎症、肿瘤、免疫性疾病等)[7-8]。研究证实Th1/Th2及Treg/Th17平衡状态与肾癌、肝细胞癌及肺癌等肿瘤的发生、发展和预后密切相关,Th1/Th2及Treg/Th17平衡失调预示了肿瘤的进展及不良预后[9-11]。卵巢癌是危及女性健康的生殖系统三大恶性肿瘤之一,5年生存率仅有10%~20%。研究发现CD4+T细胞的亚群Th1细胞、Th2细胞、Th17及Treg细胞均与卵巢癌发生发展相关[12-14],但是Th1/Th2、Th17/Treg平衡状态与卵巢癌的关系还未见报道。通过研究卵巢癌患者体内Th细胞亚群分化水平及Th1/Th2、Th17/Treg平衡状态,探讨卵巢癌发病过程中CD4+辅助性T细胞亚群可能发挥的作用,为卵巢癌临床免疫治疗提供理论支持,将有助于改善卵巢癌预后。
1 资料和方法 1.1 临床资料收集蚌埠医学院第一附属医院2013年6月~2015年6月住院手术切除的上皮性卵巢癌患者30例,患者年龄21~75岁,所有患者均经病理学检查确诊。依据国际妇产科联盟(FIGO)2000年手术-病理分期标准,Ⅰ~Ⅱ期8例,Ⅲ~Ⅳ期22例,患者术前均未接受任何抗肿瘤药物治疗及生物免疫治疗。术后病理证实为:浆液性腺癌21例,粘液性腺癌9例;分化程度:低分化13例,中分化9例,高分化8例。另外,女性健康体检者20例为正常对照组。
1.2 试剂和仪器美国BD公司FACSCalibur流式细胞仪;eBioscience 85-15-0038-41 anti-human CD3 PE-Cy5 UCHT1、eBioscience 85-11-0087-41 anti-human CD8 FITC(Clone: SK1)、eBioscience 85-12-7049-41 Phycoerythrin(PE)anti-human IL-4(Interleukin-4, IL4)、eBioscience 85-12-7319-41 anti-human IFN-gamma PE 4S.B3、eBioscience 85-12-4714-41 Mouse IgG1, K Isotype Control PE、eBioscience 85-12-0699-41 Anti-Human CD69 PE(FN50)、Liankebio M LK-GAS003 FIX&PERM Kit Liankebio M LK-CS1001 PMA/Ionomycin mixture(250X)Liankebio M LK-CS1002 BFA/Monensin Mixture(250X)eBioscience 85-12-7178-42Anti-Human 85-12-7178-42Anti-Human IL-17A PE CD25 FITC、CD4 PerCP、CD127 PE来自美国BD公司,进口国内分装。
1.3 标本收集与处理采集受试者清晨空腹外周静脉血3 mL,置入肝素钠抗凝管内。所有患者均在未接受手术、化疗及放射治疗前采血。将抗凝外周血用生理盐水1:1稀释,从离心管边缘轻轻加于Ficoll-Hypaque分离液上,室温500 g离心20 min,培养液洗涤3~5次。用含有10%胎牛血清的RPMI 1640培养液调整细胞浓度为2×106/mL,用于流式细胞仪检测。
1.4 流式细胞仪检测方法 1.4.1 三色法检测Th1、Th2用Th1、Th2分泌的特异细胞因子IFN-r,IL-4来区分,并用CD3和CD8反设CD4细胞,以防PMA诱发细胞表面CD4分子被内吞。方法如下:将400 μL的肝素抗凝血与400 μL RPMI 1640培养液混匀后均分为A、B两管,A管中加入6.8 μL 0.1 mg/mL的monensin或8 μL 0.5 mg/mL的BFA,B管中加入10 μL 1 μg/mL的PMA、8 μL 50 μL/mL的monensin和6.8 μL 0.1 mg/mL的monensin(或8 μL 0.5 mg/mL的BFA);混匀后置于37 ℃、5% CO2培养箱培养4~6 h。加入20 µL CD3-PE-Cy5和20 µL CD8-FITC,室温,避光孵育15 min。将A、B管分为4管,每管中加入100 µL已染色的全血,编号为A1、A2、A3、A4和B1、B2、B3、B4。每管加入ReagentA(固定液)100 µL,室温避光孵育15 min。加PBS洗涤,弃上清。再加入ReagentB(即破膜)100 µL,并分别加入Mouse IgG1-PE、IFN-γ-PE、Rat IgG1-PE、IL-4-PE。室温,避光孵育15 min。加PBS洗涤2次后弃上清。再加入0.5 mL多聚甲醛重悬细胞后上机检测。
1.4.2 Th17检测取新鲜无菌肝素抗凝血和RPMI 1640培养液各100 μL混匀,分别加入佛波醇酯、离子霉素和布雷菲德菌素。在37 ℃、5% CO2培养箱中刺激培养5 h,取出细胞。流式试管中分别加入CD3 APC单抗和CD4 PER-CP单抗,再加入100 μL经刺激培养的全血细胞,混匀后室温避光孵育20 min,溶血后加入固定剂100 μL,室温避光反应15 min,加入PBS洗涤,离心,弃上清。再加入破膜剂100 μL,同时加入IL-17PE单抗或者IgG 1PE同型对照,PBS洗涤2次,离心,弃上清。加入0.5 mL多聚甲醛混匀后上机检测,分析CD3+ CD4+IL-17A+细胞即Th17细胞频数。
1.4.3 调节性T细胞(Treg)检测取2只流式专用管,分别编号为Tr1、Tr2。Tr1管加入同型对照IgG1 FITC IgG2A PE,Tr2管加入Anti-CD25-FITC、Anti-CD4-Percp、Anti-CD127-PE 20 μL。再分别加入新鲜无菌肝素抗凝血100 μL,混均。置35 ℃水浴箱,避光孵育15 min。分别加入FACSLysing溶血液,置35 ℃水浴箱,避光孵育10 min。离心5 min,洗涤,两管各加入1%多聚甲醛0.5 mL。上机检测。
1.5 统计方法所有数据分析采用SPSS16.0进行,绘图采用Graphpad Prism4完成。两组间比较用成组t检验(A two-sample t-test),3组间比较采用方差分析和两两比较的SNK检验。
2 结果 2.1 卵巢癌患者外周血Thl、Th2、Thl7、Treg的表达及Th1/Th2、Treg/Th17比值变化通过流式细胞术检测30例卵巢癌患者和20例健康对照外周血Th1、Th2、Thl7、Treg占CD3+CD4+T cell比率(图 1),并计算出Th1/Th2、Treg/Th17比值后进行统计分析,结果显示:卵巢癌患者Th1表达较健康对照明显降低(P < 0.05),Th2、Thl7及Treg表达均升高,与正常对照组比较均有统计学差异(P < 0.05)。分析卵巢癌患者和健康对照外周Th1/Th2及Treg/Th17比值变化发现,卵巢癌患者Th1/Th2较正常对照明显降低(P < 0.05),Treg与Th17比值(Treg/Th17)较正常对照组升高,有统计学意义(P < 0.05,表 1)。
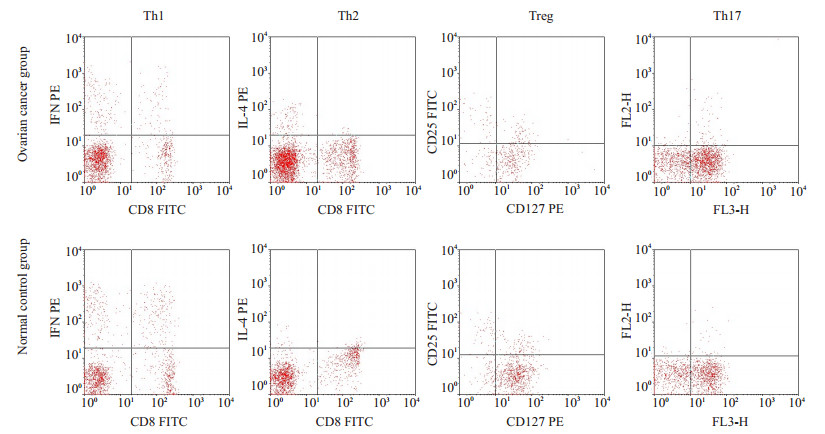
|
图 1 卵巢癌患者及健康对照组Th1、Th2、Treg、Th17表达 Figure 1 Expression of Th1, Th2, Treg and Th17 in ovarian cancer patients and normal control subjects. |
| 表 1 卵巢癌患者外周血Thl、Th2、Thl7、Treg的表达及Th1/Th2、Treg/Th17比值变化 Table 1 Percentages of Thl, Th2, Thl7 and Treg and Th1/Th2 and Treg/Th17 ratios in peripheral blood of patients with ovarian cancer |
进一步分析Thl、Th2、Thl7、Treg各亚群表达与卵巢癌病理因素关系,结果显示:Ⅲ~Ⅳ期卵巢癌组Th1表达较Ⅰ~Ⅱ期明显减少(P < 0.05)。但与组织类型及细胞分化无关(P值分别是0.19、0.98)。在卵巢患者各组中,Th2、Thl7及Treg表达差异与组织类型、细胞分化无统计学意义(P > 0.05),3者表达与临床分期明显相关,Ⅲ~Ⅳ期卵巢癌患者血清中Th2、Thl7及Treg表达均高于Ⅰ~Ⅱ期患者,两组间表达有差异(P < 0.05,表 2)。
| 表 2 卵巢癌患者外周血Thl、Th2、Thl7、Treg的表达与卵巢癌病理因素关系 Table 2 Correlations of Thl, Th2, Thl7 and Treg with the pathological factors of ovarian cancer (Mean±SD) |
中国专家李呼伦教授[15]领导的团队在国际上率先提出了“Th1、Th2、Th17、Treg细胞亚群功能失衡”理论,目前认识到Th1/Th2、Th17/Treg细胞的失衡与肿瘤密切相关。在不同细胞因子作用下Th0细胞(Th细胞前体)可以分化成不同的CD4+T细胞亚群,如Th1、Th2、Th17及Treg等。各亚群通过分泌相应的细胞因子发挥各自的作用,并相互影响制约。Th1细胞通过分泌白细胞介素-2(IL-2)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)等细胞因子,介导细胞毒性T细胞(CTL)及巨噬细胞激活,抑制B细胞功能。Th2细胞主要分泌IL-4、IL-10等细胞因子,促进B细胞激活与分化并产生抗体,介导体液免疫反应[16-17]。肿瘤免疫主要是细胞免疫,Th1细胞诱导的免疫应答抑制了恶性肿瘤增生,肿瘤患者体内如果Th2细胞处于优势,机体细胞免疫功能会受到抑制,从而促进肿瘤发生、进展。研究发现,Th2型细胞因子IL-10及IL-6在喉癌、膀胱癌等肿瘤中成过度表达,而Th1细胞因子IFN-γ、IL-2表达水平显著降低,出现Th1向Th2的飘移,机体细胞免疫受到抑制[3, 5]。本研究发现,与正常对照组比较,卵巢癌患者外周血Th1细胞明显下降(P < 0.05),而Th2细胞较正常对照组升高明显(P < 0.05),提示卵巢癌患者体内Th1细胞分化增殖被抑制,Th2细胞处于极化状态,进一步分析提示卵巢癌临床分期与Th1/Th2比例失衡相关,随着卵巢癌的进展,Th1细胞向Th2细胞漂移逐渐明显,机体免疫抑制进一步加重,导致癌细胞容易逃避细胞免疫监视,加速肿瘤的进展。
Th17细胞主要分泌IL-17、肿瘤坏死因子-α(TNF-α)等,其功能主要是募集活化中性粒细胞,其中IL-17尚能促进树突状细胞的成熟,协同刺激T细胞的活化[18]。研究证实,在自身免疫性疾病及炎症反应疾病中Th17细胞发挥重要作用,但在肿瘤中Th17细胞发挥的作用存在争议。在结肠癌、乳腺癌等肿瘤高水平的IL-17促进肿瘤的发展和转移[6, 19]。但在γt-deficient小鼠肿瘤模型中,减少IL-17表达能够促进肿瘤生长,增强其表达后肿瘤生长受到限制,研究认为Th17通过募集Th1细胞发挥抗肿瘤效应[20]。本次实验结果提示在卵巢癌外周血中Th17细胞百分率增多,并与临床分期相关,与细胞分化、组织类型无关。1995年Sakaguchi等[21]首次证实Treg是一群具有免疫抑制作用的CD4+T细胞亚群,在多种实体肿瘤及血液系统恶性肿瘤Treg细胞数量明显增多。Treg主要通过分泌IL-10和TGF-β负向调节免疫反应以维持内环境稳态。在小鼠肝癌模型中,IL-10、TGF-β可以诱导肿瘤免疫耐受,促进肝癌细胞恶性增殖[22]。在肝细胞癌患者Treg细胞通过促进肿瘤血管生成、降低CD8+T细胞而促进肝癌的进展,被认为是肝癌的一个预后不良指标[23]。在卵巢癌患者外周血Treg细胞比例显著升高,并且与临床分期、生存时间密切相关[11-24]。我们的实验发现卵巢癌患者外周血中Treg细胞百分率增高,并与临床分期显著相关,这与国内外研究结果基本一致,Treg可能参与了卵巢癌患者的免疫抑制,促进了卵巢癌的发生发展。
Treg细胞特异性的转录因子Foxp3可通过结合RORrt抑制其活性,而后者是Th17的特异性转录因子,Treg与Th17两种细胞相互抑制。在胃癌、肺癌中,当Treg/Th17平衡向Treg一方倾斜时,将有利于肿瘤的发展[25-26]。本次研究发现卵巢癌患者外周血Treg/Th17比值(5.95±0.57)较正常对照组(4.81±1.74)明显升高(P < 0.05)。在卵巢癌患者外周血中Th17和Treg细胞均升高,随肿瘤进展,Treg细胞升高优势进一步加强。升高的Th17细胞在卵巢癌中是促进或抑制肿瘤进展难以判断,其具体作用机制有待进一步研究。
综上所述,目前初步研究显示在卵巢癌患者外周血中CD4+T细胞亚群表达发生了变化,Th1/Th2和Treg/ Th17平衡被打破,出现Th2、Treg细胞极化,并且随病情进展极化进一步增强。下一步我们拟扩大样本量,进一步系统研究卵巢良性肿瘤、交界性肿瘤及不同程度恶性肿瘤患者体内Th1/Th2和Treg/Th17细胞失衡及调节机制,为卵巢癌免疫治疗提供理论支持,有助于提高卵巢癌患者免疫治疗疗效。目前肿瘤免疫治疗已应用于临床,当肿瘤患者体内处于免疫抑制时,输入体内的免疫活性细胞或因子不能有效发挥效应,免疫治疗效果必将受到限制。全面了解在肿瘤发生发展过程中机体免疫状态及调节机制,将为逆转肿瘤细胞的免疫耐受提供理论支持,从而提高肿瘤免疫治疗临床疗效。
| [1] | Simonson W, Allison KH. Tumour-infiltrating lymphocytes in cancer: implications for the diagnostic pathologist[J]. Diagn Histopathol, 2011, 17(2): 80-90. DOI: 10.1016/j.mpdhp.2010.10.006. |
| [2] | Zhang YL, Li J, Mo HY, et al. Different subsets of tumor infiltrating lymphocytes correlate with NPC progression in different ways[J]. Mol Cancer, 2010, 9(1): 4. DOI: 10.1186/1476-4598-9-4. |
| [3] | Xu X, Wang R, Su Q, et al. Expression of Th1-Th2-and Th17-associated cytokines in laryngeal carcinoma[J]. Oncol Lett, 2016, 12(3): 1941-8. |
| [4] | Li S, Li Y, Qu X, et al. Detection and significance of TregFoxP3(+) and Th17 cells in peripheral blood of non-small cell lung cancer patients[J]. Arch Med Sci, 2014, 10(2): 232-9. |
| [5] | Satyam A, Singh P, Badjatia N, et al. A disproportion of TH1/TH2 cytokines with predominance of TH2, in urothelial carcinoma of bladder[J]. Urol Oncol, 2011, 29(1): 58-65. DOI: 10.1016/j.urolonc.2009.06.002. |
| [6] | Yoshida N, Kinugasa T, Miyoshi H, et al. A high RORγT/CD3 ratio is a strong prognostic factor for postoperative survival in advanced colorectal cancer: analysis of helper T cell lymphocytes (Th, Th2, Th17 and regulatory T cells)[J]. Ann Surg Oncol, 2016, 23(3): 919-27. DOI: 10.1245/s10434-015-4923-3. |
| [7] | Gage JR, Fonarow G, Hamilton M, et al. Beta blocker and angiotensin-converting enzyme inhibitor therapy is associated with decreased Th1/Th2 cytokine ratios and inflammatory cytokine production in patients with chronic heart failure[J]. Neuroimmunomodulation, 2004, 11(3): 173-80. DOI: 10.1159/000076766. |
| [8] | Diller ML, Kudchadkar RR, Delman KA, et al. Balancing inflammation: the Link between Th17 and regulatory T cells[J]. Mediators Inflamm, 2016, 2016(3): 6309219. |
| [9] | Li L, Yang C, Zhao Z, et al. Skewed T-helper (Th)1/2-and Th17/T regulatory-cell balances in patients with renal cell carcinoma[J]. Mol Med Rep, 2015, 11(2): 947-53. |
| [10] | Saxena R, Kaur J. Th1/Th2 cytokines and their genotypes as predictors of hepatitis B virus related hepatocellular carcinoma[J]. World J Hepatol, 2015, 7(11): 1572-80. DOI: 10.4254/wjh.v7.i11.1572. |
| [11] | Li J, Wang Z, Mao K, et al. Clinical significance of serum T helper 1/T helper 2 cytokine shift in patients with non-small cell lung cancer[J]. Oncol Lett, 2014, 8(4): 1682-6. |
| [12] | Mielczarek-Palacz A, Sikora J, Kondera-Anasz Z, et al. Effect of Th1/Th2 cytokine administration on proinflammatory SKOV-3 cell activation[J]. Arch Med Sci, 2016, 12(6): 1337-47. |
| [13] | Fialová A, Partlová S, Sojka L, et al. Dynamics of T-cell infiltration during the course of ovarian cancer: the gradual shift from a Th17 effector cell response to a predominant infiltration by regulatory T-cells[J]. Int J Cancer, 2013, 132(5): 1070-9. DOI: 10.1002/ijc.v132.5. |
| [14] | Erfani N, Hamedi-Shahraki M, Rezaeifard S, et al. FoxP3 + regulatory T cells in peripheral blood of patients with epithelial ovarian cancer[J]. Iran J Immunol, 2014, 11(2): 105-12. |
| [15] | Mu L, Sun B, Kong Q, et al. Disequilibrium of T helper type 1, 2 and 17 cells and regulatory T cells during the development of experimental autoimmune myasthenia gravis[J]. Immunology, 2009, 128(1 Suppl): e826-36. |
| [16] | Hirahara K, Ghoreschi K, Laurence A, et al. Signal transduction pathways and transcriptional regulation in Th17 cell differentiation[J]. Cytokine Growth Factor Rev, 2010, 21(6): 425-34. DOI: 10.1016/j.cytogfr.2010.10.006. |
| [17] | Wei H, Sun R, Xiao W, et al. Type two cytokines predominance of human lung cancer and its reverse by traditional Chinese medicine TTMP[J]. Cell Mol Immunol, 2004, 1(1): 63-70. |
| [18] | Caruso R, Fina D, Peluso I, et al. A functional role for interleukin-21 in promoting the synthesis of the T-cell chemoattractant, MIP-3alpha, by gut epithelial cells[J]. Gastroenterology, 2007, 132(1): 166-75. DOI: 10.1053/j.gastro.2006.09.053. |
| [19] | Thibaudin M, Chaix M, Boidot R, et al. Human ectonucleotidaseexpressing CD25(high) Th17 cells accumulate in breast cancer tumors and exert immunosuppressive functions[J]. Oncoimmunology, 2016, 5(1): e1055444. DOI: 10.1080/2162402X.2015.1055444. |
| [20] | Nu?ez S, Saez JJ, Fernandez D, et al. T helper type 17 cells contribute to anti-tumour immunity and promote the recruitment of T helper type 1 cells to the tumour[J]. Immunology, 2013, 139(1): 61-71. DOI: 10.1111/imm.2013.139.issue-1. |
| [21] | Sakaguchi S, Sakaguchi N, Asano M, et al. Immunologic selftolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of selftolerance causes various autoimmune diseases[J]. J Immunol, 1995, 155(3): 1151-64. |
| [22] | Deng B, Zhu JM, Wang Y, et al. Intratumor hypoxia promotes immune tolerance by inducing regulatory T cells via TGF-β1 in gastric cancer[J]. PLoS One, 2013, 8(5): e63777. DOI: 10.1371/journal.pone.0063777. |
| [23] | Huang Y, Wang FM, Wang T, et al. Tumor-infiltrating FoxP3 + Tregs and CD8+T cells affect the prognosis of hepatocellular carcinoma patients[J]. Digestion, 2012, 86(4): 329-37. DOI: 10.1159/000342801. |
| [24] | Hermans C, Anz D, Engel J, et al. Analysis of FoxP3+ T-regulatory cells and CD8 + T-cells in ovarian carcinoma: location and tumor infiltration patterns are key prognostic markers[J]. PLoS One, 2014, 9(11): e111757. DOI: 10.1371/journal.pone.0111757. |
| [25] | Maruyama T, Kono K, Mizukami Y, et al. Distribution of Th17 cells and FoxP3(+) regulatory T cells in tumor-infiltrating lymphocytes, tumor-draining lymph nodes and peripheral blood lymphocytes in patients with gastric cancer[J]. Cancer Sci, 2010, 101(9): 1947-54. DOI: 10.1111/j.1349-7006.2010.01624.x. |
| [26] | Duan MC, Han W, Jin PW, et al. Disturbed Th17/Treg balance in patients with non-small cell lung cancer[J]. Inflammation, 2015, 38(6): 2156-65. DOI: 10.1007/s10753-015-0198-x. |
 2017, Vol. 37
2017, Vol. 37

