2. 重庆医科大学 分子医学与肿瘤研究中心,重庆 400016;
3. 重庆医科大学附属第二医院三腺外科,重庆 400010
2. Research Center of Molecular Medicine and Cancer, Chongqing Medical University, Chongqing 400016, China;
3. Department of Thyroid, Pancreatic and Breast Surgery, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
骨是乳腺癌最常见转移部位之一,约50%的首发转移和80%二次转移均为骨转移。由于乳腺癌骨转移的分子机制还未完全阐明,临床常用的乳腺癌骨转移的治疗手段,主要是姑息治疗与支持治疗,虽然近年来有一些靶向治疗的手段逐渐涌现,但总体来说患者获益不足且疗效较为有限[1]。因此,研究乳腺癌骨转移发生的分子机制具有重要的意义。
乳腺癌骨转移以骨质破坏为主要表现。“种子-土壤学说”认为,骨对于乳腺癌细胞的转移生长是肥沃的土壤,其微环境在转移灶的形成和生长中扮演重要角色[2]。研究表明从乳腺癌细胞在原发部位的形成、穿越基底膜入血、向骨组织特异性移行、到骨组织微环境中与骨细胞相互作用,有一系列复杂分子事件的参与[3-6],但其乳腺癌骨转移的机制仍不清楚。
硬化蛋白(SOST)是骨形成的负性调节因子,主要由骨细胞特异性表达。SOST基因的突变和表达异常与一系列骨病相关。如SOST基因的功能缺失性突变可导致严重的硬化性骨化病:Sclerosteosis和Van Buchem病。而骨关节炎、骨质疏松患者中,可观察到SOST基因的表达明显上升[7-8]。以药物或抗体破坏SOST基因的功能可增加骨量,用于骨质疏松治疗[9],也可用于治疗糖尿病性骨病[10]。SOST抗体做为骨质疏松患者潜在的治疗方案近年来引起了广泛的关注[11-12]。同样,正畸牙移动过程中,压力侧的骨吸收改建也有牙槽骨骨细胞分泌的SOST参与[13]。但在以骨质破坏为主的乳腺癌骨转移中有无SOST基因的参与?SOST抗体能否用于乳腺癌骨转移的治疗却并不清楚。
本文中,我们用乳腺癌细胞和成骨细胞MG63或间充质干细胞C3H10共培养,体外模拟乳腺癌骨转移微环境,观察乳腺癌细胞与骨微环境之间的相互作用;并通过干扰SOST基因的表达,初步探讨SOST基因在乳腺癌骨转移中的作用。
1 材料和方法 1.1 材料人乳腺癌细胞株MDA-MB-231,成骨细胞株MG63,小鼠间充质干细胞C3H10由本实验室冻存;腺病毒Ad-siSOST由本课题组构建。DMEM培养基及胎牛血清购自美国Hyclone公司;总RNA提取试剂盒、qRT-PCR试剂盒及荧光定量试剂盒均购自TAKARA公司;碱性磷酸酶(ALP)化学发光试剂盒及染色试剂盒(Sigma公司)。
1.2 方法 1.2.1 细胞培养细胞用含10%胎牛血清的高糖型DMEM培养基于37 ℃、无CO2温育箱中培养。MG63细胞和C3H10细胞在诱骨分化时使用成骨培养基:含10%胎牛血清,1 μmol/L地塞米松,50 mg/L抗坏血酸,0.01 mol/L b-甘油磷酸钠。
1.2.2 体外共培养模型的构建及实验分组使用含10%胎牛血清的高糖型DMEM培养MDA-MB-231细胞,细胞达50%汇合时加入适量的Ad-SiSOST或Ad-RFP,使其24 h后荧光感染率达到50%,48 h后收集培养基,与新鲜的2X成骨培养基1:1混合,制备条件培养基。以条件培养基培养成骨细胞MG63或间充质干细胞C3H10。
实验共分6组,(1)成骨培养基诱导的MG63或C3H10(阳性对照组);(2)以未感染病毒的MDA-MB-231准备的条件培养基培养的MG63或C3H10;(3)感染Ad-RFP的MDA-MB-231准备的条件培养基培养的MG63或C3H10;(4)感染Ad-SiSOST的MDA-MB-231准备的条件培养基培养的MG63或C3H10;(5)普通培养基培养的MG63或C3H10(阴性对照组)。
1.2.3 逆转录与定量PCR检测MDA-MB-231细胞感染病毒2 d后,收集细胞总RNA,逆转录制备cDNA。逆转录后cDNA稀释100倍用于荧光定量PCR的模板。采用SYBR Green染料法检测各组样本中SOST基因的表达。根据软件Primer 5设计引物,由上海生工生物技术有限公司合成,引物序列见表 1。反应条件:95 ℃、94 ℃、65 ℃、72 ℃分别反应5 min、15 s、30 s、30 s,40个循环。相对基因表达分析采用2-ΔΔCt法,ΔΔCt=(Ct目的基因-Ct内参)处理组(-Ct目的基因-Ct内参)阴性对照组,实验重复3次,每组设置3个复孔。
| 表 1 PCR反应引物 Table 1 PCR primers for genes |
MDA-MB-231和MG63或C3H10细胞共培养11 d后,如上分别收集各组细胞的总RNA,逆转录制备cDNA。定量PCR检测各组细胞中IBSP、OPG、OPN和OCN等基因的表达。引物序列见表 1。反应条件同上。
1.2.4 化学发光法检测ALP活性细胞共培养14 d后,按照试剂盒说明书分别对共培养的MG63和C3H10细胞ALP活性进行化学发光检测。
1.2.5 化学染色法检测ALP活性细胞共培养14 d后,按照说明书分别对共培养的MG63和C3H10细胞ALP进行细胞化学染色。
1.3 统计学分析本研究中各项试验均独立重复3次。所得数据采用SPSS 20.0统计软件进行统计处理,采用配对t检验进行组间的比较。P < 0.05表示差异有统计学意义。
2 结果 2.1 腺病毒Ad-SiSOST抑制效率检测。结果可见,MDA-MB-231细胞空白对照组中SOST基因表达为0.702 ± 0.143;腺病毒Ad-SiSOST组中SOST基因表达为0.176±0.053,差异具有统计学意义(P < 0.01)。说明腺病毒Ad-SiSOST可以有效的降低MDA-MB-231细胞中SOST基因的表达。
2.2 定量PCR检测各组细胞中成骨分化相关基因表达的改变从结果可见(图 1),与未诱导的阴性对照组相比,用成骨培养基培养的MG63和C3H10中骨桥蛋白、骨钙素、护骨因子和整合素结合涎蛋白表达均有不同程度的上升,说明该成骨培养基能有效诱导成骨细胞及间充质干细胞的成骨分化,且间充质干细胞诱导分化效果更好。加入乳腺癌细胞MDA-MB-231上清液共培养时,尽管也用成骨培养基诱导,其成骨分化的指标表达却明显降低(P < 0.01)。说明乳腺癌骨转移微环境中,能抑制成骨细胞的分化成熟,这也和以往的报道和患者的临床表现一致。和未感染病毒的MDA-MB-231上清液共培养相比,感染了Ad-siSOST的上清液与MG63和C3H10共培养,能有效逆转降低的OPN、OCN、OPG和IBSP的表达(P < 0.01),说明在乳腺癌骨转移微环境中下调SOST基因的表达,能逆转乳腺癌细胞导致的成骨细胞分化障碍。
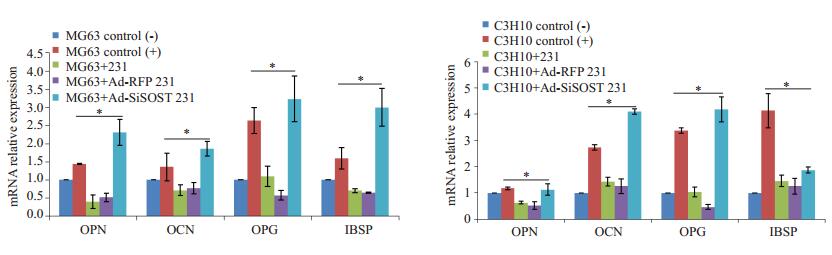
|
图 1 荧光定量PCR检测成骨细胞分化相关基因的表达 Figure 1 The change of expression of osteogenicis differentiation relative genes in MG63 or C3H10 co-cultured with MDA-MB-231 (*P < 0.01). |
细胞共培养14 d后,按试剂盒操作定量检测MG63和C3H10中碱性磷酸酶ALP活性。结果可见(图 2),与乳腺癌细胞的共培养会降低MG63和C3H10中碱性磷酸酶ALP活性(P < 0.01),而这一现象在降低乳腺癌细胞MDA-MB-231中SOST的表达后被部分逆转。
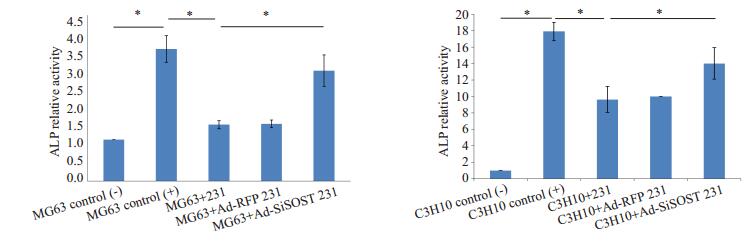
|
图 2 化学发光法检测与MDA-MB-231共培养的MG63或C3H10中ALP活性变化 Figure 2 the change of ALP expression of osteogenicis differentiation relative genes in MG63 or C3H10 co-cultured with MDA-MB-231, *P < 0.01. |
细胞共培养14 d后,按照试剂盒步骤做化学染色法定性检测各组细胞中ALP的活性。结果可见(图 3),诱导培养14 d后,MG63细胞和C3H10细胞中均可见ALP染色阳性的细胞,其中C3H10更为明显。当加入MDA-MB-231细胞上清液共培养后,阳性细胞的数量减少,同样说明乳腺癌细胞可抑制成骨细胞的分化,而降低乳腺癌细胞中SOST基因的表达后,降低的ALP阳性细胞数量开始增多,说明在乳腺癌细胞导致的成骨细胞分化抑制中有SOST基因的参与。SOST基因的下调有利于缓解成骨的抑制。
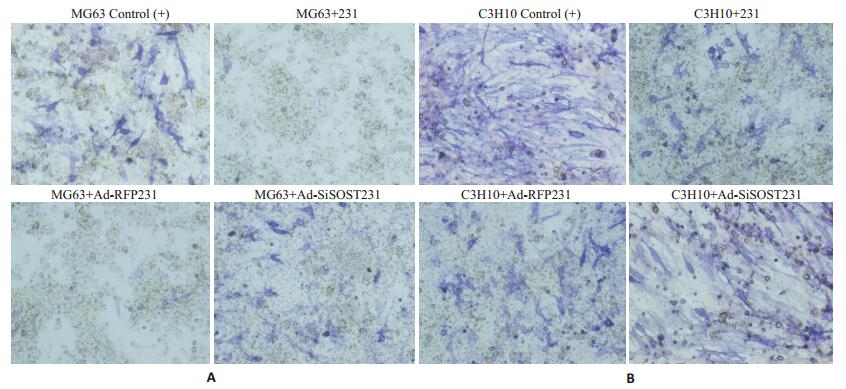
|
图 3 ALP染色检测 Figure 3 ALP staining of MG63 of C3H10 co-cultured with MDA-MB-231 for 14 days (Original magnification: ×100). A: MG63; B: C3H10. |
骨钙素、骨桥蛋白、护骨因子、整合素结合涎蛋白是判断骨细胞分化程度的常用指标。骨钙素是一种非胶原蛋白,仅由成骨细胞分泌,且参与了骨矿化和钙离子稳态。骨桥蛋白和整合素结合涎蛋白均为包含RGD(精-甘-门冬氨酸)整合素结合区的磷酸化糖蛋白,是成骨细胞分化成熟的特征性标志,并在矿化过程中起重要作用。护骨因子可竞争性结合RANKL,抑制破骨细胞的分化成熟,护骨因子的升高,预示着骨形成的增加。因此,这四个指标均可做为成骨细胞分化成熟的标志,在一定程度上反应成骨细胞的分化水平。本研究中,我们发现,在易发生骨转移的乳腺癌细胞MDA-MB-231中,有SOST基因的内源性表达。以培养MDA-MB-231细胞的上清液培养成骨细胞MG63或间充质干细胞C3H10,模拟乳腺癌骨转移微环境,与成骨培养基诱导的阳性对照相比,可明显降低MG63和C3H10中骨钙素、骨桥蛋白、护骨因子、整合素结合涎蛋白等的表达,说明乳腺癌骨转移微环境可抑制成骨细胞的分化,该结果与其他研究一致。为进一步证实该作用中是否有SOST基因的参与,我们构建了干扰SOST基因表达的腺病毒,下调MDA-MB-231细胞中的SOST基因的表达,再用上清液培养MG63和C3H10细胞,结果发现,与未感染病毒的MDA-MB-231上清液相比,下调上清液中SOST基因的表达,能有效逆转降低的骨钙素、骨桥蛋白、护骨因子和整合素结合涎蛋白的表达,说明SOST基因表达的下调有利于诱导成骨细胞的分化,缓解乳腺癌骨转移微环境导致的成骨细胞分化受阻。
碱性磷酸酶是成骨细胞的一种外酶,它的表达活性是成骨细胞分化的一个明显特征,常作为成骨细胞早期分化指标。本实验中碱性磷酸酶活性检测和染色结果均可见到与乳腺癌细胞的共培养可抑制成骨细胞的早期分化,而降低乳腺癌细胞中SOST基因的表达可有效改善成骨细胞的分化程度。这同样提示我们乳腺癌骨转移过程中,乳腺癌细胞本身表达的SOST基因参与了乳腺癌细胞对骨质的破坏,降低SOST基因的表达可改善骨质破坏的程度。该研究为临床乳腺癌骨转移的治疗提供了新的靶点。
尽管SOST基因与多种骨病的发生密切相关[14],甚至在骨与脂肪的分化中也有重要作用[15],但其在肿瘤骨转移中的作用却研究较少。SOST最初被认为是通过与BMP受体竞争性结合,下调成骨细胞中BMP活性而抑制成骨。随后发现Sclerostin与BMP受体结合较弱,更易与Wnt受体结合,通过与Wnt受体LRP5和LRP6的胞外段结合,破坏Wnt诱导的frizzled-LRP复合物的形成,抑制Wnt信号途径[16-17]。因此,目前多认为SOST是WNT途径的抑制剂[18]。我们的结果显示,在乳腺癌骨转移微环境中SOST表达升高,提示骨转移环境中WNT途径可能被抑制,但以往的报道乳腺癌微环境中WNT途径多被激活,混乱表达[19]。这提示我们在乳腺癌骨转移过程中,SOST的作用也许不仅仅是通过WNT信号,或者说有不同的WNT通路参与了骨质破坏和肿瘤生长的调节。在前列腺癌骨转移研究中也发现,SOST与同为WNT信号途径的抑制剂DKK1,有着完全相反的作用[20],这可能与LRP5/6胞外域有4个不同的结构域,具有不同的功能[21]。DKK1主要与第一和第三结构域结合,而SOST主要与第一和第二个结构域结合发挥不同的生理功能有关[22-23]。Kedlaya等[11]研究发现同时敲除SOST和LRP5的小鼠比单独敲除LRP5的小鼠有更高的骨量,提示SOST对骨的负性调控作用除通过LRP5的参与以外还有其他的受体。因此,在乳腺癌骨转移中,SOST究竟如何发挥作用?阻断SOST基因表达,对同处于微环境中的肿瘤细胞会产生什么影响?成为我们下一步研究的重点。Delgado-Calle [24]等人的研究认为在多发性骨髓瘤中阻断SOST基因的表达可减轻骨病的形成而不会对肿瘤细胞产生影响,这也为SOST抗体在临床上联合应用于乳腺癌骨转移的治疗提供了可能。我们将进一步探讨SOST在乳腺癌骨转移中作用的具体机制,为临床乳腺癌骨转移的治疗提供新的潜在靶点。
| [1] | Thibaudeau L, Quent VM, Holzapfel BM, et al. Mimicking breast cancer-induced bone metastasis in vivo: current transplantation models and advanced humanized strategies[J]. Cancer Metastasis Rev, 2014, 33(2/3): 721-35. |
| [2] | Kucerova L, Skolekova S. Tumor microenvironment and the role of mesenchymal stromal cells[J]. Neoplasma, 2013, 60(1): 1-10. |
| [3] | Drooger JC, Van Der Padt A, Sleijfer S, et al. Denosumab in breast cancer treatment[J]. Eur J Pharmacol, 2013, 717(1/3): 12-9. |
| [4] | Moorthi A, Vimalraj S, Avani C, et al. Expression of microRNA-30c and its target genes in human osteoblastic cells by nano-bioglass ceramic-treatment[J]. Int J Biol Macromol, 2013, 56: 181-5. DOI: 10.1016/j.ijbiomac.2013.02.017. |
| [5] | Yin Q, Wang X, Fewell C, et al. MicroRNA miR-155 inhibits bone morphogenetic protein (BMP) signaling and BMP-mediated Epstein-Barr virus reactivation[J]. J Virol, 2010, 84(13): 6318-27. DOI: 10.1128/JVI.00635-10. |
| [6] | Tomé M, López-Romero P, Albo C, et al. miR-335 orchestrates cell proliferation, migration and differentiation in human mesenchymal stem cells[J]. Cell Death Differ, 2011, 18(6): 985-95. DOI: 10.1038/cdd.2010.167. |
| [7] | Zarei A, Hulley PA, Sabokbar A, et al. Co-expression of DKK-1 and sclerostin in subchondral bone of the proximal femoral heads from osteoarthritic hips[J]. Calcif Tissue Int, 2017, 100(6): 609-18. DOI: 10.1007/s00223-017-0246-7. |
| [8] | Reppe S, Refvem H, Gautvik VT, et al. Eight genes are highly associated with BMD variation in postmenopausal Caucasian women[J]. Bone, 2010, 46(3): 604-12. DOI: 10.1016/j.bone.2009.11.007. |
| [9] | Li XD, Ominsky MS, Warmington KS, et al. Sclerostin antibody treatment increases bone formation, bone mass, and bone strength in a rat model of postmenopausal osteoporosis[J]. J Bone Miner Res, 2009, 24(4): 578-88. DOI: 10.1359/jbmr.081206. |
| [10] | Hamann C, Rauner M, Höhna Y, et al. Sclerostin antibody treatment improves bone mass, bone strength, and bone defect regeneration in rats with type 2 diabetes mellitus[J]. J Bone Miner Res, 2013, 28(3): 627-38. DOI: 10.1002/jbmr.1803. |
| [11] | Kedlaya R, Veera S, Horan DJ, et al. Sclerostin inhibition reverses skeletal fragility in an Lrp5-deficient mouse model of OPPG syndrome[J]. Sci Transl Med, 2013, 5(211): 211r. |
| [12] | Chang MK, Kramer I, Keller H, et al. Reversing LRP5-dependent osteoporosis and SOST deficiency-induced sclerosing bone disorders by altering WNT signaling activity[J]. J Bone Miner Res, 2014, 29(1): 29-42. DOI: 10.1002/jbmr.2059. |
| [13] | Shu R, Bai D, Sheu T, et al. Sclerostin promotes bone remodeling in the process of tooth movement[J]. PLoS One, 2017, 12(1): e0167312. DOI: 10.1371/journal.pone.0167312. |
| [14] | Wu L, Guo H, Sun K, et al. Sclerostin expression in the subchondral bone of patients with knee osteoarthritis[J]. Int J Mol Med, 2016, 38(5): 1395-402. |
| [15] | Fairfield H, Rosen CJ, Reagan MR. Connecting bone and fat: the potential role for sclerostin[J]. Current Mol Biol Rep, 2017, 3(2): 114-21. DOI: 10.1007/s40610-017-0057-7. |
| [16] | Semënov M, Tamai K, He X. SOST is a ligand for LRP5/LRP6 and a Wnt signaling inhibitor[J]. J Biol Chem, 2005, 280(29): 26770-5. DOI: 10.1074/jbc.M504308200. |
| [17] | Collette NM, Genetos DC, Murugesh D, et al. Genetic evidence that SOST inhibits WNT signaling in the limb[J]. Dev Biol, 2010, 342(2): 169-79. DOI: 10.1016/j.ydbio.2010.03.021. |
| [18] | Wu J, Ma L, Wu L, et al. Wnt-β-catenin signaling pathway inhibition by sclerostin May protect against degradation in healthy but not osteoarthritic cartilage[J]. Mol Med Rep, 2017, 15(5): 2423-32. |
| [19] | Ma F, Li W, Liu C, et al. MiR-23a promotes TGF-β1-induced EMT and tumor metastasis in breast cancer cells by directly targeting CDH1 and activating Wnt/β-catenin signaling[J]. Oncotarget, 2017 Jun 9. doi: 10.18632/oncotarget.18422.[Epubaheadofprint] http://www.ncbi.nlm.nih.gov/pubmed/28622695 |
| [20] | Hudson BD, Hum NR, Thomas CB, et al. SOST inhibits prostate cancer invasion[J]. PLoS One, 2015, 10(11): e0142058. DOI: 10.1371/journal.pone.0142058. |
| [21] | Van Dinther M, Zhang J, Weidauer SE, et al. Anti-Sclerostin antibody inhibits internalization of sclerostin and sclerostinmediated antagonism of Wnt/LRP6 signaling[J]. PLoS One, 2013, 8(4): e62295. DOI: 10.1371/journal.pone.0062295. |
| [22] | Bourhis E, Wang W, Tam C, et al. Wnt antagonists bind through a short peptide to the first β-propeller domain of LRP5/6[J]. Structure, 2011, 19(10): 1433-42. DOI: 10.1016/j.str.2011.07.005. |
| [23] | Zhihong C, Travis B, Zhiyi W, et al. Crystal structures of the extra-cellular domain of LRP5 and its complex with DKK1[J]. Nat Struct Mol Biol, 2011, 18(11): 1204-10. DOI: 10.1038/nsmb.2139. |
| [24] | Delgado-Calle J, Anderson J, Cregor MD, et al. Genetic deletion of Sost or pharmacological inhibition of sclerostin prevent multiple myeloma-induced bone disease without affecting tumor growth[J]. Leukemia, 2017 May 22. doi: 10.1038/leu.2017.152.[Epubaheadofprint] http://www.ncbi.nlm.nih.gov/pubmed/28529307 |
 2017, Vol. 37
2017, Vol. 37

