2. 蚌埠医学院, 科研中心, 安徽 蚌埠 233030
2. Department Science Research Center, Bengbu Medical College, Bengbu 233030, China
心肌缺血再灌注损伤(MIRI)常发生于缺血性心脏病的再灌注治疗过程中,随着MIRI研究的深入,人们发现MIRI的产生是一个多机制参与的复杂的病理过程,目前为止MIRI涉及的机制主要包括钙超载[1]、氧自由基增多[2]、炎症反应[3]、能量代谢障碍[3]、线粒体膜通透性转化孔的开放[4]、及各种信号通路的激活[5]、细胞凋亡[5]等。研究表明,内吗啡肽-1(EM-1)是一种μ阿片受体激动剂,具有强大的镇痛作用[6]。实验证明[7],通过激动阿片受体,EM-1后处理可有效缓解心肌缺血再灌注损伤,但其中的具体机制尚未明确。
Erk1/2是促分裂原活化蛋白激酶家族中重要的一员,Erk1/2通路也是MIRI过程中的重要信号调节通路之一。研究表明EM-1能够在多种细胞中激活Erk1/2通路。Li等[8]发现经EM-1处理的小鼠树突状细胞,表现出Erk通路激活增强;Belcheva等[9]也发现EM-1可引起大鼠C6神经胶质瘤细胞中Erk通路的快速激活。那么在MIRI过程中,EM-1后处理是否也涉及Erk1/2通路的激活,目前未见相关报道。
因此本研究复制了在体大鼠MIRI模型,在EM-1后处理之前给予Erk1/2信号通路抑制剂PD98059干预,通过检测血流动力学指标心率(HR)、平均动脉压(MAP)、心率-血压乘积(RPP)反映大鼠的心功能变化;测定大鼠血浆心肌酶学指标肌酸激酶(CK-MB)、心肌肌钙蛋白I( cTnI)、乳酸脱氢酶(LDH)指标,测定大鼠心肌梗死面积、及镜下观察大鼠心肌HE染色组织切片来反映各组大鼠的心肌损伤情况;检测大鼠血浆肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、超氧化物歧化酶(SOD)和丙二醛(MDA)等指标反映大鼠炎症反应及抗氧化能力;同时Western检测了Erk1/2、P-Erk1/2及其下游Cleaved Caspase-3蛋白的表达量以探索EM-1后处理对Erk1/2信号通路的影响。
1 材料和方法 1.1 实验动物SD雄性大鼠45只:SPF级,体质量270~290 g,购自蚌埠医学院实验动物中心[动物许可证号:SCXK2013(沪)2013-0006;合格证编号:2010002608616]。
1.2 主要试剂与仪器(1)主要试剂。EM-1(Sigma)、PD98059(Sigma),水合氯醛(沪试化学试剂),乳酸脱氢酶(LDH)、TNF-α、SOD、肌酸激酶(CK-MB)、IL-6和丙二醛(MDA)检测试剂盒(建成生物工程研究所),一抗:Erk1/2、P-Erk1/2、β-Actin抗体(Cell Signaling Technology)。二抗:HRP标记羊抗兔IgG抗体(博士德生物工程)、羊抗小鼠IgG抗体购自(Biosharp)。脱脂奶粉(Bio-rad)、PVDF膜和曝光液(Millipore)。(2)仪器。动物呼吸机(奥尔科技生物有限公司MED-LAB ALC-V9)、生物信号采集处理系统(美易科技有限公司MED-LAB U/4C501H)、EPOCH酶标仪(Biotek)。
1.3 方法 1.3.1 建立大鼠MIRI模型、实验分组依据Zhang等[10]的方法建立大鼠在体心肌缺血再灌注模型。将45只SD雄性大鼠随机分为5组:假手术组(S组)、缺血再灌组(IR组),EM-1后处理50 μg/kg组(EM50组),内吗啡肽-1 50 μg/kg + PD98059(0.3 mg/kg)后处理组(EM50+PD组)、PD98059后处理组(0.3 mg/kg)后处理组(PD组)。(1)S组:仅在大鼠心脏的冠状动脉左前降支(LAD)下穿线维持150 min。(2)IR组:结扎LAD 25 min后,经大鼠股静脉注射生理盐水0.5 mL,缺血30 min后再灌注120 min。(3)EM50组:基本处理同IR组,再灌注前5 min静脉给予内吗啡肽-1 50 μg/kg。(4)EM50+PD组:基本处理同IR组,再灌注前5 min静脉给予PD98059 0.3 mg/kg,再给予内吗啡肽-1 50 μg/kg。(5)PD组:基本处理同IR组,再灌注前5 min静脉给予PD98059 0.3 mg/kg。
1.3.2 测定血流动力学指标BL-420E生物机能实验系统实时监测大鼠术中HR、MAP、RPP,RPP=HR×MAP,记录下各指标并对其进行统计学分析。
1.3.3 血清酶学及生化指标的测定灌注结束后,自大鼠颈总动脉采血5 mL于肝素抗凝管中,4500 r/min离心10 min分离血清,-20 ℃保存待测。收集各处理组血清后,分别检测SOD、MDA、IL-6、TNF-α、LDH、CK-MB、CTnI等指标。
1.3.4 心肌梗死面积测定造模结束后随即摘下心脏,于K-H液中将残余的血洗净,并将结扎冠状动脉的线再次扎紧,取1% Evans blue经主动脉注入心脏约2 mL,放入-80 ℃冰箱中冷冻约30 min,用手术刀片沿心脏纵轴垂直切成厚约2 mm薄片,将薄片浸没在1% TTC中,37 ℃水浴中避光染色15 min,后放入4%甲醛溶液固定,根据薄片上不同颜色划分区域,梗死区呈灰白色,非梗死区呈蓝色,危险区呈红色。通过Image-J测切片各区域面积,并计算梗死区所占危险区比值。
1.3.5 大鼠心肌HE染色取材梗死区心肌组织,将组织浸泡于4%多聚甲醛中,经过固定、脱水、透明、石蜡包埋、切片机中进行制片。切片用丙酮固定30 s~1 min、PBS浸洗3 min、苏木素染色3 min、双蒸水浸洗1 min、HCl-C2H5OH分化5 s、在水龙头的细流下冲洗5 min返蓝、然后在70% C2H5OH、80% C2H5OH、90% C2H5OH、95% C2H5OH、100% C2H5OH共5个染色缸中均浸洗2 min、伊红30 s~1 min、二甲苯浸洗2 min后,中性树胶封片,待其干燥后即可镜下观察。
1.3.6 Western blot检测P-Erk、Cleaved Caspase-3蛋白的表达实验结束后,准确留取缺血区心肌组织0.1 g加入1 mL蛋白提取液,冰上经过研磨器充分研磨后,将混合液吸入试管中,4 ℃ 12 000 r/min离心15 min后取上清液,BCA试剂盒测定蛋白浓度,确定上样量为60 μg,经过上样缓冲液稀释、95 ℃ 5 min蛋白变性、加样、200 mA 120 min电泳转膜,5% BSA室温封闭120 min。1:2000 TBST稀释的兔源P-Erk抗体、1:1000 TBST稀释的兔源Erk抗体、1:500 TBST稀释的小鼠来源的β-Actin抗体分别加入孵育袋中,37 ℃孵育30 min,60 r/min摇床30 min,4 ℃过夜后取出重复上一步骤,TBST液洗涤(10 min/次)4次后分别加入1:12 000稀释的山羊抗兔二抗、1:5000稀释的山羊抗小鼠二抗,37 ℃孵育60 min,100 r/min摇床30 min,TBST液洗涤共4次(10 min/次),浸入曝光液并吹打均匀上机曝光,并对曝光结果进行灰度值统计分析。
1.3.7 统计学方法所有数据采用SPSS 21.0统计学软件进行处理,实验数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用LSD法检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠的血流动力学指标的变化实验结果表明,HR、MAP、RPP的基础值,各组均无统计学差异(P > 0.05);与S组相比,IR组、EM50+PD组及PD组HR、MAP、RPP均有所下降(P < 0.05);与IR组相比,EM50组的HR、MAP、RPP均有所升高(P < 0.05),说明EM-1后处理对再灌注的心肌功能起到一定的改善作用;与EM50组比较,EM50+PD组HR、MAP、RPP均有所下降(P < 0.05),同时PD组的HR、MAP、RPP也有所降低(P < 0.05),说明PD98059的加入减弱了EM50组改善心肌功能的作用(表 1)。
| 表 1 各组大鼠HR、MAP、RPP的变化 Table 1 Hemodynamic parameters of the isolated rat heart (Mean±SD, n=6/group) |
乳酸脱氢酶(LDH)是心肌受损的标志物,心肌肌钙蛋白I(CTnI)在心肌受损早期即开始升高,其浓度有助于估计心肌梗死情况[11],肌酸激酶(CK-MB)也是心肌缺血期的敏感指标,3个心肌酶学指标可用于评价心肌细胞的受损情况。实验结果可知,与S组相比,IR组LDH、CK-MB、CTnI的活性或浓度均有所升高;与IR组相比,EM50组的LDH、CK-MB、CTnI的活性或浓度有所降低(P < 0.05),说明EM50组对心肌细胞具有保护作用;与EM50组比较,PD组的CK-MB及EM50+PD组血浆中LDH、CK-MB、CTnI含量均有所升高(P < 0.05),说明PD98059的加入减弱了EM50组的心肌保护作用(图 1)。
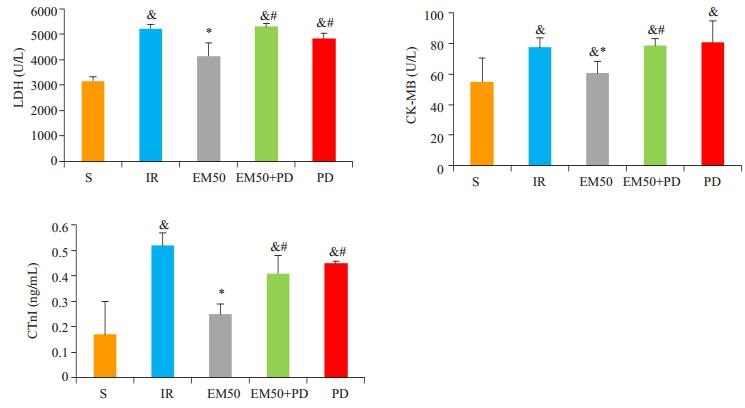
|
图 1 各处理组大鼠血清中LDH、CK-MB、CTnI的变化 Figure 1 Changes of LDH, CK-MB, and CTnI in different groups (Mean ± SD, n=6). &P < 0.05 vs S group; *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
丙二醛(MDA)是膜脂过氧化的终产物之一,也是细胞膜在功能和架构上氧化受损的标志物[20],超氧化物歧化酶(SOD)是内源性抗氧化剂。实验结果表明,与S组相比,IR组的SOD活性是降低的,MDA含量有所升高(P < 0.05);与IR组相比,EM50组的SOD活性增高,MDA含量有所降低(P < 0.05),提示EM-1后处理对心肌细胞具有一定的抗氧化作用;与EM50组相比,EM50+PD组和PD组的SOD活性均有所降低、MDA含量均有所升高(P < 0.05),说明PD98059的加入,使EM50组抗氧化作用有所削弱(图 2)。
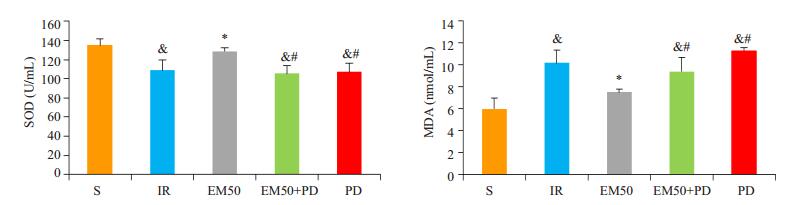
|
图 2 各处理组大鼠血浆SOD、MDA的变化 Figure 2 Changes of SOD and MDA in different groups (Mean±SD, n=6). & P < 0.05 vs sham (S) group; *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
炎症与心肌缺血再灌注过程密不可分[15],TNF-α与IL-6可反映心肌缺血再灌注过程中的炎症程度。实验结果表明,与S组相比,IR组的TNF-α、IL-6含量均有所增高(P < 0.05);与IR组相比,EM50组TNF-α、IL-6含量是降低的(P < 0.05),说明EM50组具有一定的抗炎作用;与EM50组相比,EM50+PD组、PD组的TNF-α、IL-6含量均有所增高(P < 0.05),PD98059的加入削弱了EM50组的抗炎作用(图 3)。
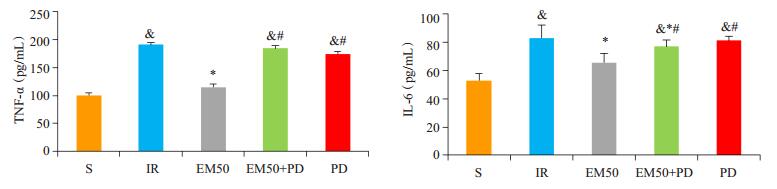
|
图 3 各处理组大鼠血清中TNF-α、IL-6的变化 Figure 3 Changes of TNF-α and IL-6 in different groups (Mean±SD, n=6). & P < 0.05 vs S group; *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
TTC双染法测心梗面积,有助于评估大鼠心肌受损程度。根据薄片上梗死区(IS)呈灰白色,非梗死区呈蓝色,危险区(AAR)呈红色,使用Image-J软件计算梗死区所占危险区比值。与IR组相比,EM50组心肌梗死面积减少(P < 0.05);与EM50组相比,EM50+PD组心肌梗死面积增加(P < 0.05,图 4)。
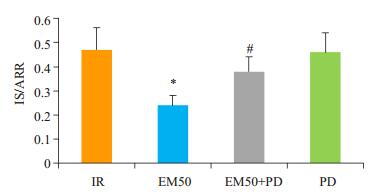
|
图 4 各处理组下大鼠心肌梗死面积百分比 Figure 4 Percentage of myocardial infarction area in differenr groups (Mean±SD, n=3). *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
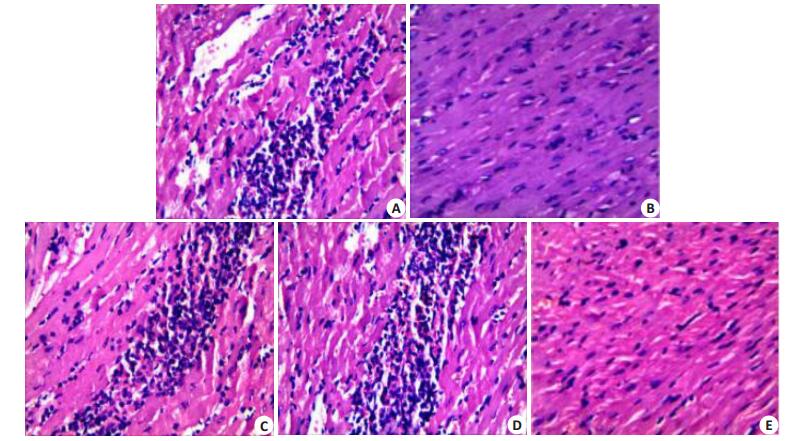
心肌组织HE染色反映了大鼠心肌组织形态学改变及局部炎症情况。S组:心肌细胞排列紧密整齐,肌纤维完整,间质中未见红细胞及炎细胞浸润;IR组:心肌纤维萎缩排列紊乱,间质扩大,血管扩张伴充血,多重区域间质红细胞外渗,局部区域白细胞浸润伴红细胞漏出,且该处心肌细胞消失,伴心肌细胞空泡变性;EM50组:心肌细胞排列较紧密,局部区域纤维排列紊乱呈波浪状,间质未见炎细胞浸润及红细胞;EM50+PD组:心肌纤维排列较紊乱,间质红细胞外渗,局部白细胞浸润伴红细胞漏出;PD组:心肌纤维排列紊乱,血管扩张伴充血,间质红细胞外渗,局部白细胞浸润伴红细胞漏出。大体上,IR组、EM59+PD组、PD组心肌受损程度较EM50组心肌受损程度重,IR组心肌组织的受损程度较S组心肌受损程度重(图 5)。
|
图 5 各处理组大鼠心肌组织HE染色切片镜下结果 Figure 5 HE staining of the cardiac tissues in different groups (Original magnification: ×400). A: S group; B: IR group; C: EM50 group; D: EM50+PD group; E: PD group. |
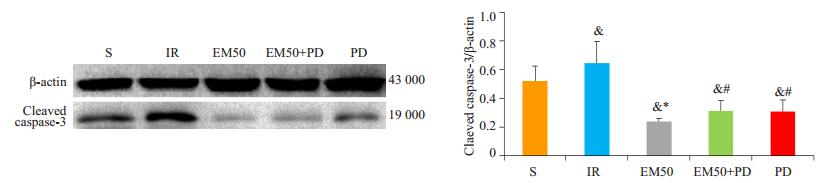
与S组相比,IR组的P-Erk蛋白表达增高(P < 0.05),Cleaved Caspase-3表达增高;与IR组比较,EM50组心肌组织中P-Erk表达增高(P < 0.05),Cleaved Caspase-3表达降低(P < 0.05);与EM50组比较,EM50+PD组心肌组织中P-Erk的表达降低(P < 0.05),Cleaved caspase-3的表达增高(P < 0.05,图 6、7)。

|
图 6 各处理组下大鼠心肌中Erk1/2、P-Erk1/2蛋白表达情况 Figure 6 Expression of Erk1/2 and P-Erk1/2 proteins in rat myocardial tissue in different groups (Mean±SD, n=3/group). & P < 0.05 vs S group; *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
|
图 7 各处理组下大鼠心肌中Cleaved Caspase-3蛋白表达情况 Figure 7 Expression of cleaved caspase-3 in rat myocardial tissue in different groups (Mean±SD, n=3/group). & P < 0.05 vs S group; *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
由实验结果可知,EM50组能够改善缺血再灌注损伤心肌的心功能、保护心肌细胞,并且具有一定抗氧化、抗炎的作用,能减小大鼠缺血再灌注损伤心肌的心梗面积、减轻心肌组织病理学改变,以上均说明EM-1后处理具有一定心肌保护作用。此结果亦与ZHANG等人[10]的实验结果是一致的。
Erk1/2通路属于再灌注损伤补救激酶系统,是调控体内细胞生长、凋亡、增殖的重要信号转导通路。研究表明,当心肌发生缺血再灌注时,香芹酚、昔多芬后处理通过激活Erk1/2通路,上调Erk1/2蛋白磷酸化水平,可对心肌产生一定的保护作用[16-17];Caspase-3是细胞凋亡过程中的关键酶,研究表明磷酸化的Erk1/2可激活其下游的Caspase家族,引起Caspase-9的表达量增加和Caspase-3的表达量降低,从而抑制细胞的凋亡[18-19],Cleaved Caspase-3是Caspase-3的活化形式,也是心肌细胞凋亡的标志性蛋白[19-21],随着Erk1/2通路激活、Caspase-3表达量的降低,Cleaved Caspase-3表达量也随之降低。那么,EM-1后处理过程中是否涉及了Erk1/ 2通路的激活,对Cleaved Caspase-3的表达影响如何。
我们使用Erk1/2通路的抑制剂PD98059阻断Erk1/2通路,再给予EM-1后处理,对大鼠心肌组织P-Erk1/2、Cleaved Caspase-3蛋白的进行检测。结果显示,与IR组相比,EM50组的P-Erk1/2表达量是增高的,Cleaved Caspase-3表达量有所降低;与EM50组相比,EM50 + PD组P-Erk1/2表达量有所降低,Cleaved Caspase-3表达量增高。说明EM50组激活了Erk1/2通路,并且EM50组对Erk1/2通路的激活作用可被PD98059阻断。
Chen等人[22]通过对离体MIRI大鼠心脏进行吗啡后处理,发现吗啡后处理组大鼠的血浆CK-MB含量有所降低、心肌功能有所改善、心梗面积显著较小并且以上作用可被PD98059阻断。He等[23]已证明,PD98059通过阻断Erk1/2通路,对吗啡预处理心肌保护作用起到抑制作用。以上说明激活的Erk1/2通路具有心肌保护作用。我们的实验表明,EM-1后处理能够改善大鼠在体缺血再灌注损伤心肌的心功能、保护心肌细胞,具有抗氧化、抗炎的作用,可减小大鼠心梗面积、减轻心肌组织病理学改变。使用PD98059阻断Erk1/2通路,再给予EM-1后处理,发现这些保护性作用被减弱,提示EM-1后处理可能通过激活Erk1/2通路发挥了心肌保护作用。
作为丝裂原活化蛋白激酶家族中的重要亚族,Erk1/2在调节细胞的生长、分化、应激以及死亡中起重要作用。Erk通路能够调节Bcl-2家族成员的活性[24],促进抗凋亡蛋白Bcl-2表达,而Bcl-2具有拮抗促凋亡蛋白Bax的表达、抑制细胞色素C的释放和Caspase-3的激活、抗氧化以及维持细胞内钙稳态的作用[25]。Erk的激活可以促进细胞ATP水平的恢复和稳定,以提供细胞足够的能量,从而抑制细胞损伤[26]。
EM-1属于μ阿片受体激动剂,研究表明EM-1通过其N端Tyr捕获自由基,形成Tyr自由基,提高心肌细胞的抗氧化能力,有效减轻氧化应激对心肌细胞造成的氧化损伤[27]。文献表明EM-1通过调节外周MOR抑制细胞因子的释放、抑制IL-6等炎症因子的分泌等机制发挥抗炎作用[28]。我们的实验结果也发现EM-1后处理可通过抗氧化、抗炎作用减弱心肌缺血再灌注损伤,并且此作用可被PD98059减弱。但EM-1的抗氧化、抗炎作用是否与Erk1/2通路的激活有关,有待进一步探索。我们推测EM-1后处理通过激活Erk1/2通路、下调Cleaved Caspase-3的蛋白表达水平,抑制心肌细胞的凋亡,促进细胞ATP水平的恢复和稳定,心肌细胞受损减少、因而降低了释放入血的心肌酶(CK-MB、LDH、CTnI)含量;减少氧自由基的产生,减少炎症介质的释放。
综上所述,EM-1后处理通过改善心功能、保护心肌细胞、抗氧化应激、减小心梗面积发挥心肌保护作用,并且在此过程中可能涉及了Erk1/2通路的激活。
| [1] | Bompotis GC, Deftereos S, Angelidis C, et al. Altered Calcium handling in reperfusion injury[J]. Med Chem, 2016, 12(2): 114-30. DOI: 10.2174/1573406411666150928112420. |
| [2] | Röth E. The role of free radicals in the myocardial reperfusion injuries and in the development of endogenous adaptation[J]. Orv Hetil, 2015, 156(47): 1908-11. DOI: 10.1556/650.2015.30304. |
| [3] | Neri M, Riezzo I, Pascale N, et al. Ischemia/reperfusion injury following acute myocardial infarction: a critical issue for clinicians and forensic pathologists[J]. Mediators Inflamm, 2017: 7018393. |
| [4] | Ong SB, Samangouei P, Kalkhoran SB, et al. The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury[J]. J Mol Cell Cardiol, 2015, 78: 23-34. DOI: 10.1016/j.yjmcc.2014.11.005. |
| [5] | Heusch G. Molecular basis of cardioprotection: signal transduction in ischemic pre-, post-, and remote conditioning[J]. Circ Res, 2015, 116(4): 674-99. DOI: 10.1161/CIRCRESAHA.116.305348. |
| [6] | 霍笑风, 吴宁, 任维华, 等. 内吗啡肽-1及其类似物的合成及与阿片受体结合作用[J]. 高等学校化学学报, 2001, 22(7): 1157-9. |
| [7] | 宗巧凤, 程向阳, 于影, 等. 内吗啡肽-1后处理对心肌缺血再灌注损伤的实验研究[J]. 中国临床药理学与治疗学, 2015, 20(2): 132-7. |
| [8] | Li ZH, Chu N, Shan LD, et al. Inducible expression of functional mu opioid receptors in murine dendritic cells[J]. J Neuroimmune Pharmacol, 2009, 4(3): 359-67. DOI: 10.1007/s11481-009-9145-7. |
| [9] | Belcheva MM, Clark AL, Haas PD, et al. Mu and kappa opioid receptors activate ERK/MAPK via different protein kinase C isoforms and secondary messengers in astrocytes[J]. J Biol Chem, 2005, 280(30): 27662-9. DOI: 10.1074/jbc.M502593200. |
| [10] | Zhang WP, Zong QF, Gao Q, et al. Effects of endomorphin-1 postconditioning on myocardial ischemia/reperfusion injury and myocardial cell apoptosis in a rat model[J]. Mol Med Rep, 2016, 14(4): 3992-8. |
| [11] | 张俊蒙, 苏瑞娟, 杨娅, 等. 小鼠血清心肌肌钙蛋白I变化与心肌梗死面积相关性[J]. 中华实用诊断与治疗杂志, 2015, 29(10): 964-6. |
| [12] | Yu J, Wang L, Akinyi M, et al. Danshensu protects isolated heart against ischemia reperfusion injury through activation of Akt/ERK1/2/Nrf2 signaling[J]. Int J Clin Exp Med, 2015, 8(9): 14793-804. |
| [13] | De Vries DK, Kortekaas KA, Tsikas D, et al. Oxidative damage in clinical ischemia/reperfusion injury: a reappraisal[J]. Antioxid Redox Signal, 2013, 19(6): 535-45. DOI: 10.1089/ars.2012.4580. |
| [14] | 董淑英, 童旭辉, 刘浩, 等. 石榴多酚对心肌缺血/再灌注损伤大鼠心功能的保护作用[J]. 南方医科大学学报, 2012, 32(7): 924-7. |
| [15] | Sun N, Wang H, Wang L. Protective effects of ghrelin against oxidative stress, inducible nitric oxide synthase and inflammation in a mouse model of myocardial ischemia/reperfusion injury via the HMGB1 and TLR4/NF-κB pathway[J]. Mol Med Rep, 2016, 14(3): 2764-70. |
| [16] | Das A, Salloum FN, Xi L, et al. ERK phosphorylation mediates sildenafil-induced myocardial protection against ischemiareperfusion injury in mice[J]. Am J Physiol Heart Circ Physiol, 2009, 296(5): H1236-43. DOI: 10.1152/ajpheart.00100.2009. |
| [17] | Chen Y, Ba L, Huang W, et al. Role of carvacrol in cardioprotection against myocardial ischemia/reperfusion injury in rats through activation of MAPK/ERK and Akt/eNOS signaling pathways[J]. Eur J Pharmacol, 2017, 796(796): 90-100. |
| [18] | Terada K, Kaziro Y, Satoh T. Analysis of Ras-dependent signals that prevent caspase-3 activation and apoptosis induced by cytokine deprivation in hematopoietic cells[J]. Biochem Biophys Res Commun, 2000, 267(1): 449-55. DOI: 10.1006/bbrc.1999.1955. |
| [19] | Cardone MH, Roy N, Stennicke HR, et al. Regulation of cell death protease caspase-9 by phosphorylation[J]. Science, 1998, 282(5392): 1318-21. DOI: 10.1126/science.282.5392.1318. |
| [20] | Condorelli G, Roncarati R, Ross J, et al. Heart-targeted overexpression of caspase3 in mice increases infarct size and depresses cardiac function[J]. Proc Natl Acad Sci USA, 2001, 98(17): 9977-82. DOI: 10.1073/pnas.161120198. |
| [21] | 叶红伟, 方婷婷, 谷小雨, 等. Rho激酶和自噬在法舒地尔抗心肌缺血/再灌注损伤中的作用[J]. 南方医科大学学报, 2016, 37(12): 1706-11. DOI: 10.3969/j.issn.1673-4254.2016.12.20. |
| [22] | Chen Z, Li T, Zhang B. Morphine postconditioning protects against reperfusion injury in the isolated rat hearts[J]. J Surg Res, 2008, 145(2): 287-94. DOI: 10.1016/j.jss.2007.07.020. |
| [23] | He SF, Jin SY, Wu H, et al. Morphine preconditioning confers cardioprotection in doxorubicin-induced failing rat hearts via ERK/GSK-3β pathway Independent of PI3K/Akt[J]. Toxicol Appl Pharmacol, 2015, 288(3): 349-58. DOI: 10.1016/j.taap.2015.08.007. |
| [24] | 郑铭, 韩启德. 参与细胞凋亡的丝裂原活化蛋白激酶及其作用机制[J]. 生理科学进展, 2000, 31(2): 157-60. |
| [25] | Katz S, Boland R, Santillán G. Modulation of ERK 1/2 and p38 MAPK signaling pathways by ATP in osteoblasts: involvement of mechanical stress-activated Calcium influx, PKC and Src activation[J]. Int J Biochem Cell Biol, 2006, 38(12): 2082-91. DOI: 10.1016/j.biocel.2006.05.018. |
| [26] | 任玉伟, 宿华威. Bcl-2基因家族研究进展[J]. 大连医科大学学报, 2015, 56(2): 202-5. DOI: 10.11724/jdmu.2015.02.025. |
| [27] | 龚频. 内吗啡肽体内抗氧化活性及其体外氧化代谢产物的研究[D]. 兰州: 兰州大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10730-2010016874.htm |
| [28] | Chakass D, Philippe D, Dharancy S, 等. Mu阿片受体(MOR)表达于肝脏组织之中并可抑制肝脏炎症[C]. 首届国际中西医结合肝病学术会议论文汇编. 2005 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGZP200509007005.htm |
 2017, Vol. 37
2017, Vol. 37

