冠心病常合并的炎症因子激活,氧化应激等可导致红细胞氧化损伤并干扰铁代谢,红细胞存活时间缩短,未成熟红细胞释放入血,红细胞分布宽度(RDW)增加。临床上RDW曾经多用于血液系统疾病的诊治。RDW升高的原因常见于红细胞破坏如溶血性贫血,造血物质缺乏如叶酸、维生素B12摄入不足等。目前关于RDW与心血管疾病的研究日趋增加[1],RDW与冠心病存在密切的关系[2]。RDW基线水平可以预测急性心肌梗死(AMI)支架术后患者12个月主要不良心血管事件(MACE)的发生风险[3]。但目前RDW与AMI的研究较多的集中在与患者病死率的相关性分析[4],以及RDW对于AMI发作的预测价值方面[5]。深入的研究提示,RDW联合肌钙蛋白Ⅰ提高AMI诊断敏感性[6],碎裂QRS波易发生AMI,RDW与碎裂QRS波密切相关[7]。但是AMI的发生和发展离不开炎症因子改变和血小板激活以及冠脉内血栓的形成。目前关于AMI时RDW与上述指标改变系统性的报道未见。研究AMI时RDW与炎症指标,血小板活化指标平均血小板体积(MPV)的关系,以及在AMI疾病特定环境下,这些因素是否影响到RDW的改变,仍需要临床研究数据。本研究期望得出相应的结果,积累临床资料。
1 资料和方法 1.1 研究对象选取2015年6月~2016年7月就诊于西安交通大学第一附属医院的冠心病患者,急性心肌梗死诊断参考指南。经皮介入确诊,至少有一处血管狭窄≥70%。对照组为不稳定型心绞痛的患者。共纳入患者127例,其中男性90人,女性37人,年龄为60.1±12.9岁。
排除标准:详细询问病史,排除瓣膜性心脏病、原发和继发性心肌病、风湿性心脏病、感染性疾病、恶性肿瘤等易引起干扰因素的相关疾病。影响RDW的血液系统疾病如:溶血性贫血,缺铁性贫血,地中海贫血,遗传性球形红细胞症,血红蛋白变异等。
急性心肌梗死诊断标准:(1)持续性胸痛>30 min,含服硝酸甘油不能缓解;(2)心电图2个或2个以上相邻导联ST段抬高,肢体导联≥0.1 mV,胸前导联≥0.2 mV;(3)新发生或怀疑新发生的左束支传导阻滞;(4)心肌酶谱CK-MB超过正常值上限3倍,肌钙蛋白T或I阳性。
1.2 研究方法 1.2.1 基线资料记录入院时记录患者的性别、年龄、身高、体质量、既往病史等基本资料。
1.2.2 生化指标检测受试者晚餐后禁食8~10 h,次日空腹抽取静脉血并检测血脂和血糖,均在本院中心实验室进行检测。血生化指标包括糖化血红蛋白(HBA1C)、血糖、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)、脂蛋白A(LPA)、血清肌酐(CREA)、尿酸(UA)、超敏C反应蛋白(hsCRP)、B型脑钠肽(BNP)、肌酸激酶同工酶MB型(CKMB)、心肌肌钙蛋白Ⅰ(CTNI)、D-二聚体(D-Dimers),使用Sysmex XE-5000全自动血液分析仪及配套试剂。
血小板指标:血小板计数(PLT),平均血小板体积(MPV),血小板分布宽度(PDW),大血小板比率(P-LCR),使用Sysmex XE-5000全自动血液分析仪及配套试剂。
红细胞指标:红细胞计数(RBC)、红细胞分布宽度(RDW)、平均红细胞体积(MCV)、血红蛋白(HGB)心功能检测指标为射血分数(LVEF,%),由两位从事心脏超声检查工作的高年资医师同时诊断。
1.2.3 分组AMI组为心肌梗死组,共66例,男、女分别为54、12例。UA为不稳定型心绞痛组,共61例,男、女分别为36、25例。根据入选实验的冠心病患者RDW 50%累积频再次分组,分为A组:低RDW,RDW < 50%(n=63);B组:高RDW,RDW≥50%(n=64)。
1.3 统计学处理应用SPSS 19.0统计软件对所得相关数据进行统计学分析。正态分布计量资料以均数±标准差表示。两组计量资料之间的比较用t检验,非正态分布的计量资料用中位数表示,组间差异采用秩和检验。计数资料采用卡方检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 临床基线资料的比较AMI组和UA组之间,性别,BMI,LVEF(%)差异有统计学意义(P < 0.01),而年龄,高血压病史,糖尿病史,吸烟史差异没有统计学意义(表 1)。
| 表 1 不同分组临床基线资料比较 Table 1 Clinical baseline data inAMI and UA groups |
AMI组和UA组之间,hsCRP,NT-proBNP,CKMB,CTNI,D-Dimer差异具有统计学意义(P < 0.01),而HBA1C,Glucose,LDL-C,HDL-C,TG,LPA,CREA,UA之间差异没有统计学意义(表 2)。
| 表 2 不同分组临床生化指标检测结果比较 Table 2 Comparison of blood biochemical parameters between AMI and UA groups (Mean±SD) |
AMI组和UA组之间,P-LCR,MPV差异具有统计学意义(P < 0.01),RDW差异具有统计学意义(P < 0.05)。血小板指标PLT,PDW差异没有统计学意义,红细胞指标RBC,MCV,HGB差异没有统计学意义(表 3)。
| 表 3 不同分组血小板检测与红细胞检测结果比较 Table 3 Comparison of the platelet and RBC tests results between AMI and UA groups (Mean±SD) |
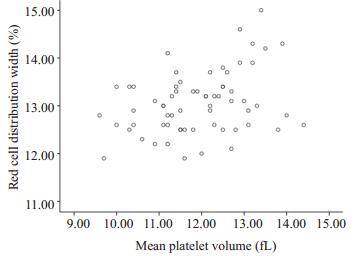
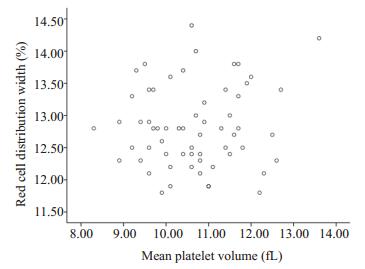
AMI组MPV与RDW进行相关分析,r=0.34,具有统计学意义(P < 0.01),而UA组RDW与MPV相关r= 0.11,差异没有统计学意义(P=0.42,图 1,图 2)。
|
图 1 AMI组RDW与MPV散点图 Figure 1 RDW and MPV scatter chart in AMI group. |
|
图 2 UA组RDW与MPV散点图 Figure 2 RDW and MPV scatter chart in UA group. |
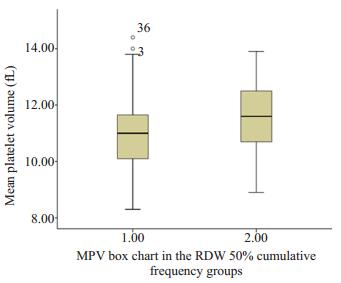
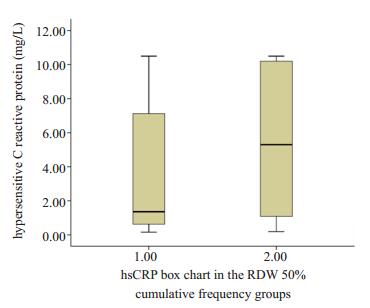
A组低RDW组,B组高RDW组,MPV,P-LCR,hsCRP,D-Dimer差异具有统计学意义(P < 0.05),NT-proBNP差异具有统计学意义(P < 0.01),而RBC,MCV差异则没有统计学意义(表 4,图 3,图 4)。
| 表 4 纳入患者RDW 50%累积频率分组 Table 4 Comparison of parameters between subgroups with different RDW 50% cumulative frequencies groups (Mean±SD) |
|
图 3 RDW分组中MPV箱图 Figure 3 MPV box chart in the RDW 50% cumulative frequency groups. |
|
图 4 RDW分组中hsCRP箱图 Figure 4 hsCRP box chart in the RDW 50% cumulative frequency groups. |
AMI组中,以RDW为因变量,MPV,P-LCR,hsCRP,NT-proBNP,D-Dimer为自变量,采用多元回归分析,MPV β=0.19,有统计学意义(P < 0.05,表 5),回归方程RDW= 0.19MPV+10.83。
| 表 5 AMI组多元回归分析结果 Table 5 Multivariate regression analysis results in AMI group |
虽然有许多先进的治疗方法,心血管疾病也得到了有效的控制,但是最新数据表明[8],心脏病引起的发病率和死亡率依旧在全球范围内居首位。既往研究报道贫血和血红蛋白水平可以作为心血管事件和死亡的预测因素,尤其是在急性心肌梗死,心力衰竭,PCI术后更为显著[9],但研究发现在非贫血患中,RDW升高增加心血管事件发生率和全因死亡率,比贫血中的更加明显,RDW可能是心血管疾病的独立危险因素[10]。既往文献报道,RDW升高可能与冠心病慢血流有关[11],RDW能够预测心血管疾病的预后[12]。AMI发作时,机体处于应激状态,会出现一系列复杂的病理改变,包括炎症因子激活,氧化应激,血小板活化,血栓形成等。本研究中,AMI与UA组间生化检测结果表明,hsCRP,NT-proBNP,CKMB,CTNI,D-Dimer差异有明显的统计学意义的(P < 0.01)。反映了AMI与UA之间炎症,损伤和凝血的异常。接下来,对AMI与UA组间的血小板和红细胞检测结果比较中,P-LCR,MPV,RDW差异有统计学意义(P < 0.05),是这与MPV在急性冠脉综合征中的报道一致[13]。
RDW的水平升高,也被称为红细胞的大小不等症,红细胞的大小不等症与AMI的关系有着可靠的生物学机制,可以作为判断AMI预后的重要指标[14]。在纳入的冠心病患者中,以RDW累积频率进行二次分组,比较AMI组与UA组中有明显差异的指标,结果表明,MPV,P-LCR,hsCRP,D-Dimer,NT-proBN差异具有统计学意义(P < 0.05),关于RDW与hsCRP关系的报道结果[15]与本研究一致,Martina等[16]关于RDW与凝血的研究中,揭示的RDW与D-Dimer类似的关系,Wang等[17]对PCI术后的STEMI患者研究表明,高RDW(≥14%)与低RDW( < 14%)之间,也表明了NT-proBNP,CRP有明显的差异。这些检测结果表明RDW与血小板的活化,炎症因子激活,心功能状态异常有一定关系。Fukuta等[18]的研究也表明,NT-proBNP与RDW存在相关性。RDW所伴随的MPV,P-LCR,hsCRP,D-Dimer,NT-proBNP改变,可能是RDW能够作为心血管疾病预后预测因素之一,这是有关RDW预测冠心病预后的报道中未提到的[19]。
MPV可以被看作是血小板功能和活性的指标[20],体积增大的血小板有增多的伪足,更多的血小板颗粒,具有更强的聚集力和致血栓能力。血小板颗粒包括血栓烷A2(TXA2),促凝血膜蛋白比如p-选择素糖蛋白IIIa等,在凝血,炎症,和动脉粥样硬化的过程中起着很关键的作用[21-22]。AMI会出现MPV的异常改变。大体积血小板是动脉粥样硬化血栓形成的危险因素常可导致心肌梗死[23]。目前关于MPV的研究结论不断积累[24-25],循环中的血小板可以呈现各种不同的形状,有不同的密度和反应活性,而血小板活性的增加伴随着MPV的增加[26],研究表明MPV水平在AMI组和UA组之间没有明显的差异[27],与本研究结果有差异,但是Musluhittin等[28]的研究与本研究一致,有研究更是提出了MPV水平升高可以作为AMI预后的独立危险因素[29]。
RDW水平升高提示红细胞异质性的增加,MPV水平升高时存在血小板激活和血栓形成,上述相关文献报道,MPV与RDW均是预测AMI预后的重要因素。RDW与MPV可能存在相互的影响,但是AMI人群中,未见RDW和MPV的关系明确的报道。在本研究中,AMI组RDW与MPV相关分析表明,RDW与MPV存在正相关关系(r=0.34, P < 0.01)。进一步通过对可能影响RDW的因素进行回归分析,将P-LCR,hsCRP,NT-proBNP,D-Dimer,MPV纳入回归方程。结果表明,MPV可以解释RDW的改变,回归方程RDW= 0.19MPV + 10.83,而其它的指标如P-LCR,hsCRP,NT-proBNP,D-Dimer则被排除在外。
综上所述,RDW和MPV均是重要的临床指标,反映了机体重要的病理生理改变。影响着AMI的病程和预后。高水平的RDW伴随较高的MPV,hsCRP,NT-proBNP,以及D-Dimer。AMI组中RDW与MPV存在正相关的关系,通过回归分析RDW的改变由MPV可解释。AMI时会出现MPV活性的改变,血小板以及凝血系统的激活,促血栓形成等因素,可能增加了RBC的消耗,促使更多的RBC合成增加,RBC的不均一性增加。两者共同影响了AMI的预后,随着更多的研究出现,RDW与MPV对于AMI的发生发展以及预后的意义可能会更明确。
| [1] | Aung N, Ling HZ, Cheng AS, et al. Expansion of the red cell distribution width and evolving iron deficiency as predictors of poor outcome in chronic heart failure[J]. Int J Cardiol, 2013, 168(3): 1997-2002. DOI: 10.1016/j.ijcard.2012.12.091. |
| [2] | Ren H, Hua Q, Quan M, et al. Relationship between the red cell distribution width and the one year outcomes in Chinese patients with stable angina pectoris[J]. lntern Med, 2013, 52(16): 1769-74. DOI: 10.2169/internalmedicine.52.9314. |
| [3] | Lee JH, Yang DH, Jang SY, et al. lncremental predictive value of red cell distribution width for 12-month clinical outcome after acute myocardial infarction[J]. Clin Cardiol, 2013, 36(6): 336-41. DOI: 10.1002/clc.22114. |
| [4] | Khaki S, Mortazavi SH, Bozorgi A, et al. Relationship between red blood cell distribution width and mortality of patients with acute myocardial infarction referring to tehran heart center[J]. Grit Pathw Cardiol, 2015, 14(3): 112-5. DOI: 10.1097/HPC.0000000000000047. |
| [5] | Timoteo AT, Papoila AL, Lousinha A, et al. Predictive impact on medium-term mortality of hematological parameters in acute coronary syndromes: added value on top of GRACE risk score[J]. Eur Heart J Acute Cardiovasc Care, 2015, 4(2): 172-9. DOI: 10.1177/2048872614547690. |
| [6] | Tenekecioglu E, Yilmaz M, Yontar OC, et al. Red blood cell distribution width is associated with myocardial injury in non-STelevation acute coronary syndrome[J]. Clinics, 2015, 70(1): 18-23. DOI: 10.6061/clinics. |
| [7] | Bekler A, Gazi E, Tenekecioglu E, et al. Assessment of the relationship between red cell distribution width and fragmented QRS in patients with non-ST elevated acute coronary syndrome[J]. Med Sci Monit, 2014, 20: 413-9. DOI: 10.12659/MSM.890151. |
| [8] | Writing Group Members, Mozaffarian D, Benjamin EJ, et al. Heart disease and stroke statistics-2016 Update: A report from the american heart association[J]. Circulation, 2016, 133: e38-60. DOI: 10.1161/CIR.0000000000000350. |
| [9] | Hong YJ, Jeong MH, Choi YH, et al. Relation between anaemia and vulnerable coronary plaque components in patients with acute coronary syndrome: virtual histology intravascular ultrasound analysis[J]. J Korean Med Sci, 2012, 27(4): 370-76. DOI: 10.3346/jkms.2012.27.4.370. |
| [10] | Arbel Y, Weitzman D, Raz R, et al. Red blood cell distribution width and the risk of cardiovascular morbidity and all-cause mortality. A population-based study[J]. Thromb Haemost, 2014, 45(111): 300-7. |
| [11] | Luo SH, Jia YJ, Nie SP, et al. Increased red cell distribution width in patients with slow coronary flow syndrome[J]. Clinics, 2013, 68(4): 732-7. |
| [12] | Fatemi O, Paranilam J, Rainow A, et al. Red cell distribution width is a predicaor of mortality in patients undergoing percutaneous coronary intervention[J]. J Thromb Thromholysis, 2013, 35(1): 57-64. DOI: 10.1007/s11239-012-0767-x. |
| [13] | Niu X, Yang C, Zhang Y, et al. Mean platelet volume on admission improves risk prediction in patients with acute coronary syndromes[J]. Angiology, 2015, 66(5): 456-63. DOI: 10.1177/0003319714536024. |
| [14] | Danese E, Lippi G, Montagnana M. Red blood cell distribution width and cardiovascular diseases[J]. J Thorac Dis, 2015, 7(10): e402-11. |
| [15] | Agarwal S. Red cell distribution width, inflammatory markers and cardiorespiratory fitness: results from the national health and nutrition examination survey[J]. Int Heart J, 2012, 64(64): 380-7. |
| [16] | Martina M, Gianfranco C, Tiziana M, et al. The role of red blood cell distribution width in cardiovascular and thrombotic disorders[J]. Clin Chem Lab Med, 2012, 50(4): 635-41. |
| [17] | Wang P, Wang Y, Li H, et al. Relationship between the red blood cell distribution width and risk of acute myocardial infarction[J]. J Atheroscler Thromb, 2015, 22(1): 21-6. DOI: 10.5551/jat.23937. |
| [18] | Fukuta H, Ohte N, Mukai S, et al. Elevated plasma levels of B-type natriuretic peptide but not C-reactive protein are associated with higher red cell distribution width in patients with coronary artery disease[J]. Int Heart J, 2009, 50(6): 301-12. |
| [19] | Arbel Y, Shacham Y, Finkelstein A, et al. Red blood cell distribution width(RDW) and long-term survival in patients with ST elevation myocardial infarction[J]. Thromb Res, 2014, 134(5): 976-9. DOI: 10.1016/j.thromres.2014.08.016. |
| [20] | Ghaffari S, Pourafkari L, Javadzadegan H, et al. Mean platelet volume is a predictor of ST resolution following thrombolysis in acute ST elevation myocardial infarction[J]. Thromb Res, 2015, 136(1): 101-6. DOI: 10.1016/j.thromres.2015.05.003. |
| [21] | Hou Y, Carrim N, Wang Y, et al. Platelets in hemostasis and thrombosis: Novel mechanisms of fibrinogen-independent platelet aggregation and fibronectin-mediated protein wave of hemostasis[J]. J Biomed Res, 2015, 29(6): 437-44. |
| [22] | Muller KA, Chatterjee M, Rath D, et al. Platelets, inflammation and anti-inflammatory effects of antiplatelet drugs in ACS and CAD[J]. Thromb Haemost, 2015, 114(3): 498-518. DOI: 10.1160/TH14-11-0947. |
| [23] | Larsen SB, Grove E, Hvas Am, et al. Platelet turnover in stable coronary artery disease -influence of thrombopoietin and low grade inflammation[J]. PLoS One, 2014, 9(1): e85566. DOI: 10.1371/journal.pone.0085566. |
| [24] | Sayin MR, Yavuz N, Karabag T, et al. Renal artery stenosis and mean platelet volume[J]. Anatol J Cardiol, 2016, 16(3): 197-201. |
| [25] | Chen Y, Xiao Y, Lin Z, et al. The role of circulating platelets microparticles and platelet parameters in acute ischemic stroke patients[J]. J Stroke Cerebrovasc Dis, 2015, 24(10): 2313-20. DOI: 10.1016/j.jstrokecerebrovasdis.2015.06.018. |
| [26] | Evstatiev R, Bukaty A, Jimenez K, et al. Iron deficiency alters megakaryopoiesis and platelet phenotype independent of thrombopoietin[J]. Am J Hematol, 2014, 89(5): 524-9. DOI: 10.1002/ajh.23682. |
| [27] | Dehghani MR, Taghipour SL, Rezaei Y. Diagnostic importance of admission platelet volume indices in patients with acute chest pain suggesting acute coronary syndrome[J]. Indian Heart J, 2014, 66: 622-8. DOI: 10.1016/j.ihj.2014.10.415. |
| [28] | Musluhittin EE, Recep D. Mean platelet volume in acute coronary syndrome[J]. Indian Heart J, 2015, 67(4): 409-10. DOI: 10.1016/j.ihj.2015.05.004. |
| [29] | Wang X, Xu XL, Li XM, et al. Diagnostic value of mean platelet volume combined with troponin Ⅰ for acute coronary syndrome[J]. Am J Med Sci, 2016, 352(2): 159-65. DOI: 10.1016/j.amjms.2016.04.014. |
 2017, Vol. 37
2017, Vol. 37

