地中海贫血是最常见的人类单基因遗传病之一,中国南方地区,如广西、广东、云南等是高发流行地区[1-2]。中国人群地中海贫血以α地贫和β地贫为主,重型α地贫往往因为宫内贫血而胎死腹中或出生很快死亡。α地贫主要基因缺陷背景为大片段缺失,其中大约90%的α地中海贫血是由包含α珠蛋白基因簇或其调控区域的片段缺失所导致[3]。作为严重的公共卫生问题,其预防措施主要依赖于产前诊断和遗传咨询,而产前诊断和遗传咨询则依赖于地贫基因的明确[4-5]。目前常规的地贫基因检测不能检测到少见、罕见及新发现的地贫基因。因此,对血常规参数和常规地贫基因检测不相符的标本,应进一步明确其是否存在其它地贫突变基因。本研究发现一种未见报道的缺失α地贫突变基因,同时建立其检测方法,丰富了α地贫基因突变图谱。现报道如下:
1 对象和方法 1.1 对象先证者:男,41岁,汉族,海南省人,地贫筛查怀疑为地贫基因携带者,进行地中海贫血基因检测确认;先证者母亲:女,65岁。
1.2 标本采集采集先证者及其母亲外周血2~3 mL,乙二胺四乙酸(EDTA-2K)抗凝。
1.3 仪器及试剂AB 9700聚合酶链反应仪购自美国ABI公司,UVP凝胶成像系统购自美国Gene有限公司,NANODROP 2000核酸测定仪购自美国Thermo公司。Taq DNA聚合酶(Ex Taq)为大连TAKARA宝生物工程有限公司产品,缺失α地贫基因检测试剂盒、非缺失α地贫基因检测试剂盒及β地贫基因检测试剂盒均为深圳益生堂生物企业有限公司产品。
1.4 血液学表型分析RBC参数分析采用日本Sysmex XS-800i全自动血液分析仪;Hb组分定量分析采用毛细血管电泳法,检测仪器Capillarys2 Flex Piercing及配套试剂均为法国SEBIA公司产品。
1.5 血清铁和血清铁蛋白检测采用美国Beckman公司生化分析仪DXC800和DXI800及配套试剂。
1.6 常规缺失α地贫基因检测基于跨越断裂点PCR(gap-PCR)原理的多重PCR检测α地中海贫血基因缺失突变,检测类型包括--SEA、-α3.7、-α4.2及--THAI。操作严格按照试剂说明书进行。
1.7 α、β地贫基因点突变检测PCR-反向斑点杂交技术(PCR-RDB)诊断α、β地中海贫血基因点突变。操作严格按照试剂说明书进行。α地贫基因点突变包括Hb Constant Spring(αCS)、HbQuong Sze(αQS)和HbWestmead(αWS),β基因点突变包括CD41-42、IVS-Ⅱ-654等中国人群常见的的8种β-地贫基因非缺失突变和不常见的7种β-地贫基因非缺失突变。
1.8 α1基因扩增引物序列:a1(F):5'-TGGAGGGTGGAGACGT CCTG-3',a1(R):5'-TCCATCCCCTCCTCC CGCCCC TGCCTTTTC-3'。引物均由上海生工生物工程技术服务有限公司合成。gap-PCR检测体系:2 mmol dNTP 2.0 μL,5×buffer 4.0 μL,25 mmol MgCl2 2.0 μL,Taq酶1 U,10 μmol引物各0.5 μL,模板2 μL,加超纯水至20 μL。扩增条件:95 ℃预变性5 min;97 ℃ 45 s,66 ℃ 30 s,72 ℃ 120 s,32个循环;72 ℃延伸10 min。电泳条件:1.5%琼脂,100 v,60 min。
1.9 针对位点特异的缺失α地贫基因检测利用gap-PCR检测新发现的缺失α地贫基因。PCR引物序列:3814(F):5'-CTCGGTAGCCGTTCCTCCT G-3',3814(R):5'-GGACTTCGCGGTGGCTCCAC-3'。引物均由上海生工生物工程技术服务有限公司合成。gap-PCR检测体系:2 mmol dNTP 2.0 μL,5×buffer 4.0 μL,25 mmol MgCl2 2.0 μL,Taq酶1 U,10 μmol引物各0.5 μL,模板2 μL,加超纯水至20 μL。扩增条件:95 ℃预变性5 min;95 ℃ 40 s,64 ℃ 45 s,72 ℃ 180 s,30个循环;72 ℃延伸10 min。电泳条件:1.5%琼脂,100 v,70 min。取3 μL扩增产物进行电泳验证,将电泳产物送广州英骏生物技术有限公司测序,分析测序峰图,并与GenBank中标准序列(NG_000006.1)进行比对,以确定缺失的范围和断裂位点。
2 结果 2.1 血液学表型分析结果(表 1)| 表 1 先证者及其母亲血液学检测结果 Table 1 Hematological testresults of the proband and his mother |
先证者地贫筛查结果提示,先证者可能为轻型α地贫携带者。
2.2 常规缺失α地贫基因检测gap-PCR检测结果显示,先证者检测出代表正常α珠蛋白基因的1.7 kb条带和代表左缺4.2 kb的1.4 kb条带,其基因型为(-α4.2/αα);其母亲只有正常条带,故基因型为αα/αα(图 1)。
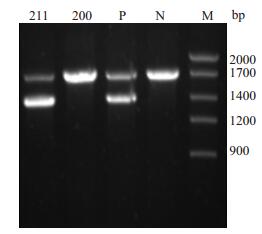
|
图 1 缺失α地贫基因检测结果 Figure 1 Detection for deletional α-thalassemia gene. 211: Proband(-α4.2/αα), 200: Mother(αα/ αα). P: Positive(-α4.2/αα), N: Control(αα/αα). |
PCR-RDB检测结果显示,先证者标本PCR扩增没有扩增产物,3个位点αCS、αQS和αWS的正常对照及相应突变点均无显示蓝点(图 2)。
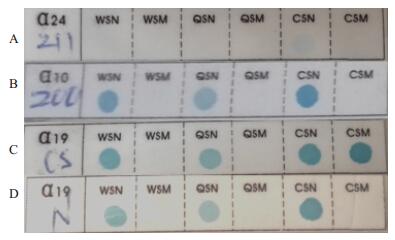
|
图 2 PCR-RDB检测α地贫基因非缺失突变结果 Figure 2 Detection for non-deletional α-thalassemia gene. A: proband (no PCR product); B: Mother(αα/αα); C: Positive (ααcs/αα); D: Control(αα/αα). |
先证者及其母亲均没有检测到17种β-地贫基因非缺失突变。
2.5 单独扩增α1基因α1基因进行单独扩增,先证者标本无扩增产物,其母亲及正常对照标本均扩增出正常1.1 kb产物条带(图 3)。
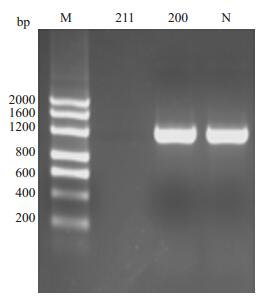
|
图 3 α1基因PCR扩增结果 Figure 3 Detection result of α1 hemoglobin gene. 211: Proband (no PCR product), 200: Mother, N: Control. |
设计特异引物,利用gap-PCR技术,针对新发现的缺失α-地贫基因进行检测、验证。
电泳结果显示,正常对照标本出现4.0 kb条带,而先证者标本无此条带,反而扩增出约250 bp条带,其母亲则同时扩增出4.0 kb和约250 bp条带(图 4)。
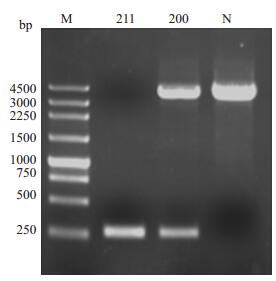
|
图 4 针对断裂点的特异gap-PCR扩增结果 Figure 4 Specific PCR for detecting the breakpoint region. 211: Proband, 200: Mother, N: Control. |
将gap-PCR扩增的特异产物进行测序,正反双向测序结果显示电泳条带长度为268 bp。将测序结果在NCBL网站与NG_000006.1序列进行BLAST比对,比对结果发现,该缺失α-地贫基因缺失片段断裂范围在34 592~38 405 bp,缺失片段长度为3814 bp(NG_ 000006.1: g.34592_38405del3814),丢失片段包括编码血红蛋白亚基α1的HBA1基因(图 5、6)。
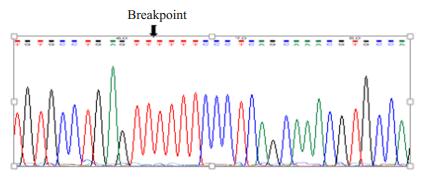
|
图 5 α3.8地贫基因断裂处序列 Figure 5 DNA breakpoint of -α3.8 thalassemia. |

|
图 6 扩增产物与NG_00006.1序列比对结果 Figure 6 Alignment results between the PCR product and NG_00006.1. |
α地中海贫血是高度异质性的单基因遗传病,其分子病理基础为α珠蛋白基因片段的缺失或位点突变导致α珠蛋白肽链合成减少或不能合成而导致溶血性贫血。迄今为止,全球至少已经报道了40多种α地贫基因缺失类型,在中国人群中发现的超过10种[6-8]。目前,国内α地贫基因诊断主要包括中国人常见的4种α地贫缺失型(缺失型--SEA、-α3.7、-α4.2及--THAI)和3种非缺失型基因突变类型(αCS、αQS和αWS点突变类型)。由于方法的局限性,一些少见甚至未曾报道的突变类型则需要机遇、敏锐以及进一步实验探究发现。
本研究中的先证者,由于血液学指标筛查疑为缺失两个α珠蛋白基因的轻型地贫,故进行常规缺失α地贫基因、非缺失α地贫基因及β-地贫基因检测。检测结果显示,先证者未检测出β-地贫基因,缺失α地贫基因检测结果为缺失一个α珠蛋白基因的静止型α地贫(-α4.2/αα),非缺失α地贫基因检测结果为没有扩增产物。由于缺失及非缺失α地贫基因检测结果矛盾,且血液学筛查结果提示为轻型α地贫而常规基因检测结果为静止型α地贫,故推测该样本可能存在其它少见缺失型α地贫基因,从而导致非缺失α地贫基因扩增无产物。
针对这异常检测结果,首先对α1基因进行单独扩增,以确定该标本有无缺失α1基因。扩增结果显示:正常对照标本则扩增出预期1.1 kb产物条带,而先证者标本无扩增条带,提示该标本缺失α1基因,且缺失下游部位可能位于α1下游区域。
从常规非缺失α地贫基因检测结果可以推测,该断裂片段可能包括非缺失α地贫基因扩增引物序列,初步推断缺失断裂点可能位于α2基因第三外显子下游部位,由于缺失片段大小无法确定,在确定α1缺失后,针对可能的突变位点,设计多对引物重新扩增,多组扩增结果显示,只有引物3.8(F)及3.8(R)扩增出预期结果,该标本与正常对照标本相比,没有4.0 Kb条带,反而出现了约250 bp条带。将产物测序后,通过与序列NG_ 000006.1比对,发现该缺失α地贫基因缺失片段断裂范围在34 592~38 405 bp之间,缺失片段长度为3814 bp,缺失部分包括完整α1基因,因此,先证者α地贫基因型为-α4.2/-α3.8。由于该3.8 kb缺失部位包含常规非缺失α地贫因检测中PCR扩增下游引物的结合位点,故常规非缺失α地贫基因检测无法进行PCR扩增,导致其非缺失α地贫基因检测膜条没有显色点。而先证者由于缺失两个α珠蛋白基因,虽然血红蛋白浓度正常,但其MCV及MCH均降低,符合α轻型地贫临床表现。
在PubMed上进行文献检索,以及查询珠蛋白基因网站(http://globin.cse.psu.edu/),均未发现此缺失突变类型,证实此缺失突变是世界首报的新型缺失α地贫基因型(GenBank登录号:KY472788)。
gap-PCR是目前检测缺失α地贫基因的常用方法[9-10]。除了常见的缺失类型外,也可能存在一些少见或尚未发现的地贫基因,同样都可以利用多重连接探针扩增技术(MLPA)和gap-PCR技术进行分析和鉴定[11-12]。本研究中,针对3814 bp缺失片段,通过在其断裂处上、下游设计特异引物,不仅可以用于分析其缺失片段分子生物学特征,而且还可以用于此新型地贫基因的临床快速检测、鉴定。
致谢: 感谢深圳益生堂生物企业有限公司的指导和帮助,谨此致谢!| [1] | Rund D. Thalassemia 2016: modern medicine battles an ancient disease[J]. Am J Hematol, 2016, 91(1): 15-21. DOI: 10.1002/ajh.24231. |
| [2] | Weatherall DJ. Keynote address: The challenge of thalassemia for the developing countries[J]. Ann N Y Acad Sci, 2005, 1054(1): 11-7. DOI: 10.1196/annals.1345.002. |
| [3] | Higgs DR. The molecular basis of alpha-Thalassemia[J]. Cold Spring Harb Perspect Med, 2013, 3(1): a011718. |
| [4] | Yin A, Li B, Luo M, et al. The prevalence and molecular spectrum of α-and β-globin gene mutations in 14, 332 families of Guangdong Province, China[J]. PLoS One, 2014, 9(2): e89855. DOI: 10.1371/journal.pone.0089855. |
| [5] | Pharephan S, Sirivatanapa P, Makonkawkeyoon S, et al. Prevalence of α-thalassaemia genotypes in pregnant women in northern Thailand[J]. Indian J Med Res, 2016, 143(3): 315-22. DOI: 10.4103/0971-5916.182622. |
| [6] | Wang XY, Lin MX, Lin M. A novel 6.3 kb deletion and the Rare 27.6 kb Deletion Causing α(+)-Thalassemia in two Chinese Patients[J]. Hemoglobin, 2016, 40(5): 365-8. DOI: 10.1080/03630269.2016.1211535. |
| [7] | Long J, Pang W, Sun L, et al. Diagnosis of a family with the novel-α (21.9) thalassemia deletion[J]. Hemoglobin, 2015, 39(6): 419-22. DOI: 10.3109/03630269.2015.1077142. |
| [8] | 徐湘民. 地中海贫血预防控制操作指南[M]. 北京: 人民军医出版社, 2011. |
| [9] | 李朋, 张杰. 地中海贫血基因检测方法的研究进展[J]. 中国妇幼保健, 2016, 31(4): 891-4. |
| [10] | 周玉球, 肖鸽飞, 李莉艳, 等. Gap-PCR作为临床一线α-珠蛋白生成障碍性贫血携带者筛查技术的应用评价[J]. 第一军医大学学报, 2002, 22(5): 434-6. |
| [11] | Soler AM, Schelotto M, De Oliveira Mota N, et al. The -(α) (5.2) deletion detected in a uruguayan family: first case report in the Americas[J]. Hemoglobin, 2016, 40(4): 289-92. DOI: 10.1080/03630269.2016.1200072. |
| [12] | Yasmeen H, Toma S, Killeen N, et al. The molecular characterization of Beta globin gene in thalassemia patients reveals rare and a novel mutations in Pakistani population[J]. Eur J Med Genet, 2016, 59(8): 355-62. DOI: 10.1016/j.ejmg.2016.05.016. |
 2017, Vol. 37
2017, Vol. 37

