2. 南方医科大学药学院 广东省新药筛选重点实验室,广东 广州 510515
2. Guangdong Provincial Key Laboratory of New Drug Screening, School of Pharmaceutical Sciences, Southern Medical University, Guangzhou 510515, China
胰岛素(INS)是治疗糖尿病的常用必备药物。但是,INS存在体内代谢消除快,易被胃肠内强酸、碱、消化酶破坏降解,生物利用度低等缺陷[1],故临床常皮下注射且需长期频繁给药,这就容易导致体内血药浓度波动过大,给患者带来生命危险。近年来,为达到增加INS的胃肠道稳定性,提高生物利用度,延长体内降糖时间,减少给药次数等目的,具有良好生物相容性的天然生物可降解高分子材料如海藻酸盐[2]、玻尿酸[3]、壳聚糖及其衍生物[4]等以及人工合成生物可降解高分子材料如聚己内酯(PCL)[5]、聚丙烯酸及其共聚物[6-7]、聚乳酸及其共聚物[8]等已应用于INS的纳米粒给药系统。
本课题组前期研究发现,以生物相容性良好且可降解[9-10]的聚乙二醇(mPEG)和PCL为原料制备的两亲性嵌段聚合物mPEG-PCL囊泡对INS有较高包封率和体外缓释作用,但存在明显突释效应[11]。此后,我们在PEG、PCL链段的基础上引入了阳离子聚合物聚乙烯亚胺(PEI),通过PEI与INS产生静电作用形成离子复合物的形式增加了INS与载体的相互作用,有效降低了载体材料对INS的突释效应,但其最高包封率和载药率仅为59.59%和18.63%,并且体外缓释时间仅有48 h[12]。为提高载体的包封率、载药率以及缓释性能,本文在两嵌段聚合物mPEG-PCL的基础上连接了pH响应型阳离子聚合物聚甲基丙烯酸-N,N-二乙氨基乙酯(PDEAEMA)链段,合成了三嵌段聚合物mPEGPCL-PDEAEMA。
此前,Liu等[13]采用可逆加成-断裂链转移聚合(RAFT)法合成了上述聚合物,发现该聚合物对牛血清白蛋白(BSA)、L-赖氨酸(Lys)等蛋白有很高的包封率,但这种合成方法存在聚合阻滞,不易控制的缺点[14],并且目前未有该聚合物负载大分子蛋白INS的相关报道。因此,本文以体系简单可控的ATRP法合成的三嵌段聚合物mPEG-PCL-PDEAEMA作为INS的载体,制备得到包封率、载药率更高,体外缓释时间更长和体内降糖效果稳定持久的INS缓释纳米粒,以期为INS的缓释制剂开发提供参考。
1 材料和方法 1.1 试剂与仪器甲基丙烯酸-N, N-二乙氨基乙酯(DEAEMA,99%),ε-己内酯(ε-CL,纯度99%),聚乙二醇单甲醚(mPEG5000),辛酸亚锡(Sn(oct)2,95%),2-溴异丁酰溴(BiBB,98%),2,2'-联吡啶(Bpy,99.0%),溴化亚铜(CuBr,99.0%),链脲佐菌素(STZ,98%)均购于上海阿拉丁生化科技股份有限公司,胰岛素原料药(INS,26.9 U/mg,徐州万邦金桥制药有限公司,批号1601A09),BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司),透析袋(8~14 000、25 000,科昊生物工程有限公司),二氯甲烷(DCM)、四氢呋喃(THF)、三乙胺(TEA)等其他试剂均为分析纯。
Malvern-3000Hs型光子相关光谱仪(英国马尔文公司),AvanceⅡ40型核磁共振波普仪(德国布鲁克公司),Nicolet 6700型傅里叶红外光谱仪(美国赛默飞世尔公司),H-7650型透射电子显微镜(日本Hitachi),RF-5301PC型荧光检测仪(日本岛津公司),iMark型酶标仪(BIO-RAD),冷冻离心机(德国Eppenddorf),Pico 21型离心机(美国赛默飞世尔公司)
Sprague-Dawley(SD)大鼠,雄性,由南方医科大学动物实验中心提供,合格证:SCXK(粤)2011-0015。
1.2 三嵌段聚合物mPEG-PCL-PDEAEMA的合成 1.2.1 mPEG-PCL-OH的合成采用开环聚合法。精密称取适量mPEG5000和ε-CL,置于50 mL干燥圆底烧瓶内,以1% ε-CL摩尔质量的Sn(oct)2为催化剂,于130 ℃下氮气环境中反应24 h。反应结束后加适量DCM稀释,于过量冰乙醚中沉淀,抽滤,收集沉淀,加入适量DCM重新溶解。重复上述操作2次,得到白色粉末状产物,40 ℃下真空干燥至恒重。
1.2.2 大分子引发剂mPEG-PCL-Br的合成精密称取适量上述1.2.1产物于50 mL干燥圆底烧瓶,加入适量DCM溶解,于冰水浴中按比例加入TEA和BiBB(mPEG-PCL-OH:TEA:BiBB=1:4:2),室温下氮气环境中反应48 h。反应结束后,过滤,35 ℃旋蒸除去大量有机溶剂,于过量冰甲醇中沉淀,抽滤,收集沉淀,加入适量DCM重新溶解,重复上述操作2次,得到白色粉末状产物,30 ℃下真空干燥至恒重。
1.2.3 三嵌段聚合物mPEG-PCL-PDEAEMA合成通过原子自由转移基聚合反应,大分子引发剂和DEAEMA在CuBr和Bpy催化下生成mPEG-PCLPDEAEMA三嵌段聚合物。精密称取适量大分子引发剂置于50 mL干燥圆底烧瓶中,加入适量干燥THF溶解,于氮气环境下依次按比例加入Bpy,DEAEMA和CuBr(大分子引发剂:Bpy:CuBr=1:4:2),60 ℃下氮气环境中反应24 h。反应结束后,加入适量THF稀释,于中性氧化铝柱中除去铜络合物,用截取相对分子质量为8~14 000的透析袋在去离子水中透析24 h(每8 h换1次去离子水),除去未反应的单体及小分子杂质,冷冻干燥,最终得到三嵌段聚合物mPEG-PCL-PDEAEMA。合成路线如图 1所示。
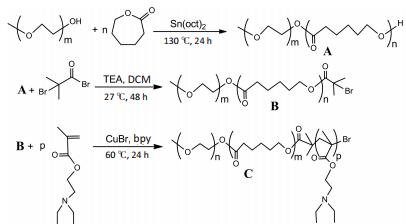
|
图 1 三嵌段聚合物的路线合成示意图 Figure 1 Synthesis route of the triblock copolymer. A: mPEGPCL-OH; B: mPEG-PCL-Br; C: mPEG-PCL-PDEAEMA. |
将适量待测产物和干燥后溴化钾于室温下碾磨成粉末,取适量粉末进行压片处理,扫描400~4 000 cm-1波数吸收光谱。
1.3.2 核磁共振氢谱(1H-NMR)表征氘代氯仿(CDCl3)为溶剂,四甲基硅(TMS)为内标,25 ℃下测定待测样品的核磁光谱。依据谱图中相关峰的位置及面积,确定聚合物结构组成及聚合度。
1.3.3 临界聚集浓度的测定参考文献[15],采用芘荧光探针法测定三嵌段聚合物的临界聚集浓度(CAC值)。CAC值是表征聚合物纳米粒子结构稳定性和抗稀释能力的重要参数,CAC值越小,抗稀释能力越强,粒子结构越稳定。
1.3.4 聚合物纳米粒粒径及形态的表征采用动态光散射激光粒度和Zeta电位分析仪对聚合物载药纳米粒的粒度进行表征,取待测纳米粒溶液适量,充分稀释使之分散均匀后检测粒径和Zeta电位;采用透射电子显微镜观察聚合物载INS纳米粒的大小和形态。取适量待测纳米粒溶液,充分稀释后,滴于碳膜铜网上,停留3 min,用滤纸吸去多余的溶液,滴加0.1% wt磷钨酸溶液染色3 min,室温下干燥,透射电镜观察,拍摄粒子形态。
1.4 聚合物载INS纳米粒的制备采用纳米沉淀技术[16]制备聚合物载INS纳米粒。精密称取适量INS溶于6 mL,0.01 mol/L的HCl溶液,在pH计检测下,用1 mol/L NaOH溶液调节其pH值至6.0。将6 mg聚合物充分溶于0.6 mL THF中,搅拌条件下缓慢滴加到上述溶液中,室温下通风橱中搅拌过夜使THF挥尽。4 ℃,14 000 r/min条件下离心30 min,收集沉淀,去离子水洗涤3次,冷冻干燥,即得聚合物载INS纳米粒。同法制备聚合物空白纳米粒。
1.5 包封率及载药率的测定分别将不同投药比的6 mL空白聚合物纳米粒溶液和聚合物载INS纳米粒溶液在4 ℃,14 000 r/min条件下离心30 min后收集上清液。采用BCA法测定上清中INS含量,再根据下式计算聚合物载药纳米粒的包封率和载药量。
包封率(EE%)=(INS的总质量-上清INS的质量)/投药总质量×100%
载药率(DL%)=(INS的总质量-上清INS的质量)/纳米制剂总质量×100%
1.6 溶液pH值对聚合物自组装行为考察方法同1.4。取6份6 mL去离子水,在pH计检测下,用0.01 mol/L HCl和1 mol/L NaOH调节至不同pH(1.2、2.5、6.0、6.4、7.2、7.4),另取6份6 mg三嵌段聚合物,分别溶于0.6 mL THF中,充分溶解后,在200 r/min搅拌下,分别缓慢逐滴滴入上述去离子水中(10 s/d),室温下通风橱中搅拌过夜将THF挥尽。对聚合物纳米粒的粒径和形态进行检测。
1.7 载INS纳米粒的体外释放行为考察精密称取INS原料药和聚合物载INS纳米粒冻干粉各5 mg,放置在截取相对分子质量为25 000的透析袋中,经紧密包扎后,分别置于50 mL的离心管,加入5 mL事先预热至37 ℃的PBS缓冲液(0.01 mol/L,pH7.4),浸润透析袋,并在37±1 ℃恒温水浴中,以80 r/min转速匀速搅拌。按设定的时间点取样5 mL,同时补充等量等温的新鲜介质。样品经14 000 r/min离心30 min后,取出上清液测定INS含量,计算规定时间内的药物累计释放率。每个样品平行操作3次,以累积释放率的平均值对时间绘制体外累计释放曲线。
1.8 体内药效考察选择雄性SD大鼠建立STZ诱导的糖尿病大鼠模型[17]。造模前禁食过夜,第2天空腹腹腔注射STZ(60 mg/kg,柠檬酸盐缓冲液,pH4.2),1周后开始监测血糖。选取血糖值持续1周高于16.7 mmol/L,体质量为200±20 g的大鼠24只,将大鼠随机分成4组(mPEG5kPCL13k-PDEAEMA10k空白纳米粒组、INS组、mPEG5k-PCL10k-PDEAEMA10k载INS纳米粒组和mPEG5k-PCL13k-PDEAEMA10k载INS纳米粒组),每组6只,分别以5 U/kg的剂量皮下注射给药,按设定的时间点眼眶取血测定血糖值,绘制体内血糖浓度曲线。
1.9 统计分析应用SPSS 20.0软件进行统计学分析,数据用均数±标准差表示,采用单因素方差分析双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 聚合物结构表征结果分析 2.1.1 FT-IR谱图结果分析图 2中所有谱图均在1109 cm-1处存在有mPEG链段C-O键的伸缩振动峰,在1724 cm-1处存在有PCL链段C=O键的伸缩振动峰,在2878 cm-1处存在有mPEG链段和PCL链段-CH2-的伸缩振动峰,表明mPEG和ε-CL合成成功。由于在mPEG5k-PCL10k-Br中的-C-Br-所占比例很小,因此图 2A,B差别不明显。图 2C中在2776 cm-1和2834 cm-1处可以明显看到DEAEMA特有的甲基和亚甲基的伸缩峰,表明DEAEMA与mPEG5k-PCL10k-Br成功发生聚合,红外图谱结果与聚合物的预计结构一致。同理,mPEG5k-PCL13k-PDEAEMA10k按同样的方法进行红外分析,也确证得到了相应的三嵌段聚合物。
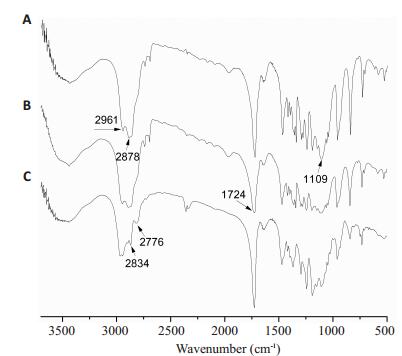
|
图 2 三嵌段聚合物mPEG5k-PCL10k-PDEAEMA10k合成过程中各步产物的红外谱图 Figure 2 FT-IR spectra of the products during synthesis of mPEG5k-PCL10k-PDEAEMA10k copolymers. A: mPEG5kPCL10k-OH; B: mPEG5k-PCL10k-Br; C: mPEG5k-PCL10kPDEAEMA10k. |
图 3中所有谱图均存在mPEG的甲基质子特征峰(Ha, δ=3.4 ppm)和亚甲基质子特征峰(Hb, δ =3.66 ppm)。图 3A中,δ =4.07 ppm(Hg)、δ=2.33 ppm(Hc)、δ=1.65 ppm(Hd和Hf)和δ=1.39 ppm(He)属于PCL的亚甲基质子特征峰,表明mPEG和ε-CL成功发生聚合。与图 3A相比,图 3B中有溴甲基质子特征峰(Hh, δ=1.94 ppm)。图 3C中,在δ=2.73 ppm(Hl)、δ=2.59 ppm(Hm)、δ=1.84 ppm(Hi)、δ=1.07 ppm(Hn)和δ=0.9 ppm(Hj和Hh)的信号峰是DEAEMA的特征峰,表明DEAEMA与大分子引发剂mPEGPCL-Br发生聚合。通过核磁谱图可计算聚合物的数均相对分子质量,根据δ=3.66 ppm(Hb)峰面积与δ= 2.33 ppm(Hc)峰面积之比可计算出PCL段的聚合度,根据Hb、Hc峰面积与δ=4.07 ppm(Hg和Hk)峰面积之比可计算出DEAEMA段的聚合度[15]。最终计算出聚合物mPEG5k-PCL10k-PDEAEMA10k和mPEG5kPCL 13k-PDEAEMA10k的相对分子质量分别为24 609和27 801,均与理论值比较接近,说明聚合具有良好的可控性。
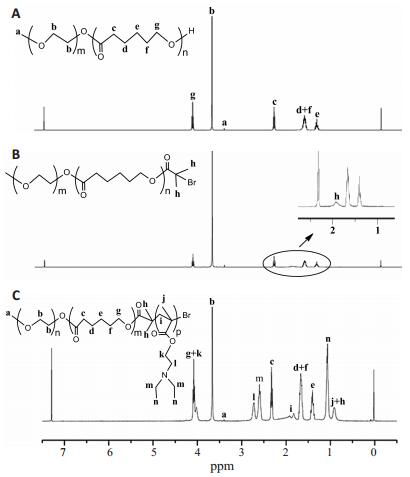
|
图 3 三嵌段聚合物mPEG5k-PCL10k-PDEAEMA10k合成过程中各步产物的核磁谱图 Figure 3 1H-NMR spectra of the products during synthesis of mPEG5k-PCL10k-PDEAEMA10k copolymers. A: mPEG5kPCL10k-OH; B: mPEG5k-PCL10k-Br; C: mPEG5k-PCL10kPDEAEMA10k. |
mPEG5k-PCL10kPDEAEMA10k和mPEG5k-PCL13k-PDEAEMA10k的CAC值分别为6.4×10-4 g/L和2.8×10-4 g/L,均比普通小分子表面活性剂的CAC值低若干个数量级,抗稀释能力较强。当聚合物其他链段长度不变时,PCL链段的增加有利于降低聚合物的CAC值。
2.2 聚合物纳米粒粒径及形态分析选择mPEG5k-PCL10k-PDEAEMA10k聚合物来观察溶液pH值对聚合物自组装行为的影响。由图 4~5可知,在溶液pH为1.2和2.5时,纳米粒发生了团聚,粒径较大,在溶液pH为6.0~7.4时,随着溶液pH值增大,纳米粒粒径逐渐呈现减小趋势,形态也呈现球形或类球形状。
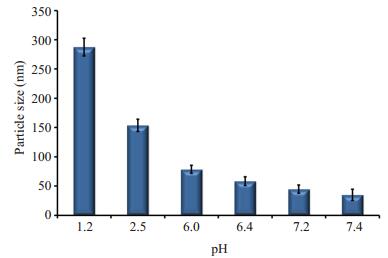
|
图 4 聚合物在不同pH溶液中自组装形成纳米粒的粒径 Figure 4 Size of mPEG5k-PCL10k-PDEAEMA10k nanoparticles determined by dynamic light scattering in different pH conditions (Mean±SD, n=3). |

|
图 5 聚合物在不同pH溶液中自组装形成纳米粒的透射电镜图 Figure 5 Transmission electron microscopy (TEM) of mPEG5k-PCL10k-PDEAEMA10k nanoparticles in different pH conditions. |
DLS结果显示在溶液pH为6.0时,聚合物mPEG5kPCL10k-PDEAEMA10k和mPEG5k-PCL13k-PDEAEMA10k空白纳米粒的粒径分别为78.5±2.5 nm和81.8±2 nm,Zeta电位分别为31.06±1.51 mv和24.1± 0.6 mv,载INS纳米粒的粒径分别为169±7.1 nm和181.9±6.67 nm,Zeta电位分别为16.1±1.15 mv和2.8± 0.91 mv,可见负载INS后纳米粒粒径明显增大,这种尺寸大小的改变可以通过TEM直接观察(图 6)。TEM结果显示在上述环境中,空白纳米粒和载药纳米粒均呈球形状态,且分散比较均一。两者空白粒径均为60 nm左右,载INS纳米粒的粒径分别为150 nm和170 nm左右。因DLS测试是基于微小粒子悬浮在液体中进行布朗运动,从而使光发生散射的原理来测得纳米粒的水合直径,而TEM测试则是基于电子束中的电子与干燥样品中的原子发生碰撞,从而产生立体角散射的原理来测得纳米粒的干态尺寸,故二者测试结果略有差异[18-19]。

|
图 6 聚合物纳米粒和载INS纳米粒的透射电镜图及聚合物自组装纳米粒负载,释放胰岛素过程的示意图 Figure 6 TEM micrographs of (A) mPEG5k-PCL10k-PDEAEMA10k nanoparticles, (B) insulin-loaded nanoparticles based on mPEG5k-PCL10k-PDEAEMA10k, (C) mPEG5k-PCL13k-PDEAEMA10k nanoparticles and (D) insulin-loaded nanoparticles based on mPEG5k-PCL13k-PDEAEMA10k. (E) schematic diagram illustrating the formation of self-assembled nanoparticles and the process of loading and releasing insulin. |
分别以mPEG5k-PCL10k-PDEAEMA10k和mPEG5k-PCL13k-PDEAEMA10k为载体考察两种不同相对分子质量的聚合物载INS性能,投料比如表 1所示。包封率是评价载体材料质量好坏的重要指标,包封率越高,游离药物越少,即载药工艺中游离药物的利用率越高,而载药量是评价载体材料载药性能的一项重要指标,载药量越高载药性能越好。故选取包封率和载药量为综合指标[20]考察最优投料比,权重系数均为0.5,以最高综合评分组的投料比为最佳。其中,mPEG5k-PCL10k-PDEAEMA10k载INS纳米粒90% wt投料比组的综合评分与20% wt(P < 0.001),50% wt(P < 0.001)和70% wt(P < 0.001)投料比组的综合评分有显著性差异,90% wt投料比组的综合评分高于其他3组的综合评分。mPEG5k-PCL13k-PDEAEMA10k载INS纳米粒90% wt投料比组的综合评分与20% wt(P < 0.001),50% wt(P < 0.001)和70% wt(P < 0.001)投料比组的综合评分有显著性差异,90% wt投料比组的综合评分高于其他3组的综合评分,故最终选择90% wt投料比制备两种聚合物载INS纳米粒进行后续试验(表 1)。
| 表 1 聚合物载INS纳米粒的包封率与载药量 Table 1 Encapsulation and drug loading efficiency of insulin-loaded polymeric nanoparticles (Mean±SD, n=3) |
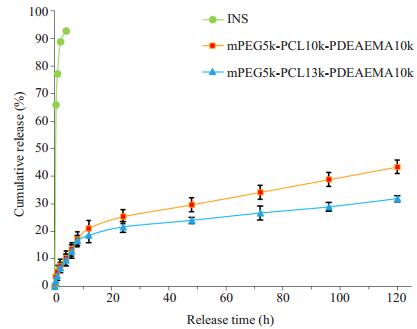
为了和体内药效实验保持一致,本文选择了在正常生理条件下,即pH7.4的释放介质中进行体外释放行为考察。由图 7可知,游离INS在4 h末的累计释放量为90%以上,而不同聚合物载INS纳米粒在前8 h均处于快速释放期,随后释药速率逐步趋于平缓。mPEG5k-PCL10k-PDEAEMA10k载INS纳米粒和mPEG5k-PCL13k-PDEAEMA10k载INS纳米粒在前8 h的突释量分别仅为17.07%和16.64%,120 h后的累计释药量仅为43.41%和31.86%。从图 7可看出,mPEG5k-PCL13k-PDEAEMA10k载INS纳米粒的药物突释量明显低于mPEG5k-PCL10k-PDEAEMA10k载INS纳米粒且前者在平缓期释药更慢,缓释时间更长。动力学拟合结果表明,二者的体外释放行为均与Weibull模型的拟合效果最好,相关系数r均高达0.96以上,提示该制剂存在释放延迟,释药过程包括被动扩散和基质侵蚀[21-22]。
|
图 7 INS原料药与不同聚合物载INS纳米粒的体外累积释放率 Figure 7 Accumulative release rate of insulin of different insulin-loaded nanoparticles in vitro (Mean±SD, n=3). |
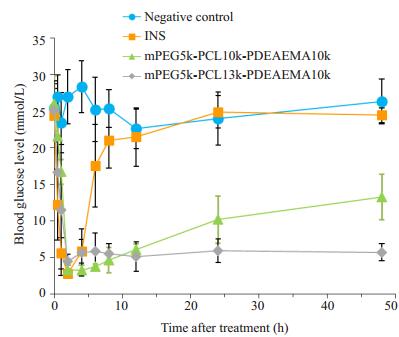
由图 8可知,糖尿病大鼠皮下注射空白纳米粒,INS原料药和不同聚合物载INS纳米粒后,空白纳米粒组血糖维持在给药前水平,波动幅度较小;INS组在2 h后血糖降至最低,随后血糖明显上升,并逐渐恢复到给药前的血糖水平;而不同聚合物载INS纳米粒组的血糖也明显下降,2~4 h内血糖降至最低。其中,mPEG5kPCL10k-PDEAEMA10k载INS纳米粒组在4 h后血糖逐渐升高,并于48 h后回升至13.3 mmol/L,而mPEG5kPCL13k-PDEAEMA10k载INS纳米粒组在4~48 h的血糖水平总体波动不大,血糖维持在5.1~7.5 mmol/L之间。参考SD大鼠空腹正常血糖值[23],可知INS组的降糖作用时间仅为4 h,mPEG5k-PCL10k-PDEAEMA10k载INS纳米粒组的降糖作用时间为12 h,而mPEG5kPCL13k-PDEAEMA10k载INS纳米粒的作用时间可长达48 h。与游离INS相比,聚合物载药纳米粒的体内降糖时间明显延长。
|
图 8 糖尿病大鼠给药后的体内血糖曲线 Figure 8 Hypoglycemic effects in diabetic rats after subcutaneous administration of insulin, polymeric nanoparticles and different insulin-loaded nanoparticles (Mean±SD, n=6) |
作为可控/活性自由基聚合法,ATRP和RAFT合成得到的聚合物均具有相对分子质量可控且相对分子质量分布较窄的优点,但RAFT反应存在聚合阻滞现象[14, 24]。故本研究采用ATRP聚合的方法在基础链段mPEG-PCL上连接PDEAEMA链段,得到相对分子质量可控的三嵌段聚合物mPEG-PCL-PDEAEMA。目前,虽已有研究发现PDEAEMA能与外源蛋白形成有效的静电或氢键作用,以三嵌段聚合物mPEGPCL-PDEAEMA负载外源蛋白具有高蛋白包封率[13],但以PDEAEMA或PDEAEMA的相关嵌段聚合物负载INS的相关报道仍较少。因此本研究以三嵌段聚合物mPEG-PCL-PDEAEMA负载INS,通过调节溶液pH稍高于INS等电点(5.5),使带负电荷的INS能与质子化带正电荷的PDEAEMA发生静电作用而形成稳定的离子复合物,得到了不仅包封率和载药率均较高,而且在体外具有出色缓释效果,在生理条件下能缓慢释放具有生物活性INS的载INS纳米粒。
三嵌段聚合物mPEG-PCL-PDEAEMA具有两亲性和pH敏感性,在水中能自发组装形成以PCL为核,mPEG为壳的类球形纳米结构,并且在pH 1.2~7.4的范围内,纳米粒粒径会随溶液pH的增大而减小。其原因是在强酸环境中,PDEAEMA上叔胺基会发生质子化带上大量正电荷,一方面正电荷之间的相互排斥作用使PDEAEMA链段表现为伸展构象,从而以分子的形式存在于水溶液中[25],另一方面链段周围的正电场吸引了水溶液中的负离子,这些负电荷阻止了PDEAEMA链段的进一步伸展[26],二者共同作用下使聚合物纳米粒在pH 1.2和2.5时呈现松散团块状并且粒径较大,特别是在pH 1.2的水溶液中,空白聚合物纳米粒的粒径接近300 nm。而在弱酸或中性环境中,叔胺基上的正离子随pH值的增大逐渐减少,PDEAEMA链段溶解性逐渐降低而引起自身链段收缩缠绕或与PCL链段发生无规缠绕,疏水作用的增强阻止了共聚物聚集为更大的微粒,纳米粒收缩,故纳米粒pH 6.0~7.4的范围内呈规则球形或类球形状,粒径随pH增大呈现减小的趋势。
与之前报道的纳米粒体外释放多肽与蛋白质类药物的典型曲线相一致[27],不同聚合物载INS纳米粒在两种pH释放介质中的体外释药曲线均呈现起始突释相和平缓释放相。这是因为在释放初期,通过氢键或其他结合力粘附在纳米粒亲水性表面INS由于与释放介质存在较大浓度差而被快速释放[11],造成载INS纳米粒在前8 h存在突释效应。而在8~120 h,其释药速度缓慢且恒定,原因是随着表面结合INS的释放,纳米粒开始崩解形成空隙,释放介质进入粒子内部,包埋的INS会被连续释放。但由于粒子表面经水化溶胀逐渐形成了水化膜,粒子内部INS与释放介质中INS浓度差减小,内外渗透压降低,使粒子内部INS向释放介质扩散受阻[12]。并且随着释药时间的延长,纳米粒中的mPEG-PCL链段在体外降解的过程缓慢[28],进一步阻碍了粒子内部包埋的INS的释放,故载INS纳米粒在8 h后的释药曲线呈现平缓释放相。
体外释放实验中,mPEG5k-PCL13k-PDEAEMA10k载INS纳米粒的突释量和释放速度明显低于mPEG5kPCL10k-PDEAEMA10k载INS纳米粒,一方面可能是疏水链段的增加增强了纳米粒结构的稳定性。有研究报道[29],两亲性聚合物在溶液中的自组装形态与聚合物的亲疏水链段有关,可通过亲水链段体积所占聚合物分子总体积的百分系数feo确定,当0.2 < feo≤0.4可形成囊泡结构,而聚合物囊泡结构具稳定性好,结构强度大,抗稀释能力强,载药能力大等优点[30-31]。本文在制备载INS纳米粒时的pH低于PDEAEMA链段的pKa(7.3),PDEAEMA链段为亲水链段,mPEG5k-PCL10kPDEAEMA10载INS纳米粒的feo值为0.6,而mPEG5kPCL13k-PDEAEMA10k载INS纳米粒的feo值为0.53。推测后者的形成的纳米粒结构更接近于囊泡,故其CAC值更小,结构更加稳定,包封率和载药率也更高。另一方面,PCL链段的增加也会增加纳米粒内核疏水性,间接增强了INS与载体的相互作用,同时也会减慢纳米粒的崩解速度,使释放介质不易进入粒子内部,从而降低药物的释放速度。
体内药效实验中,相同剂量皮下给药后,游离INS降糖水平仅能维持4 h,而mPEG5k-PCL10kPDEAEMA10k载INS纳米粒和mPEG5k-PCL13kPDEAEMA10k载INS纳米粒的降糖水平分别可维持12 h和48 h。说明载INS纳米粒能在体内有效缓慢释放具有降糖活性的INS。由于模型大鼠的个体差异和测定手段的不稳定性,两种聚合物载INS纳米粒的降血糖作用时间相差较大,但均比游离INS的降糖效果好。
本研究制得的三嵌段聚合物载INS纳米粒,包封率和载药率均较高,分别可达80%和40%以上,体外缓释明显,突释药量较少,并且能在体内呈现缓慢释放的降糖疗效,故pH敏感三嵌段聚合物mPEG-PCL-PDEAEMA有望成为理想的胰岛素缓释载体。此外,改变制备方法以得到其他制剂形式和给药方式的缓释制剂正在研究中。
| [1] | Torchilin VP, Lukyanov AN. Peptide and protein drug delivery to and into tumors: challenges and solutions[J]. Drug Discov Today, 2003, 8(6): 259-66. DOI: 10.1016/S1359-6446(03)02623-0. |
| [2] | Li X, Qi J, Xie Y, et al. Nanoemulsions coated with alginate/ chitosan as oral insulin delivery systems: preparation, characterization, and hypoglycemic effect in rats[J]. Int J Nanomedicine, 2013, 8(2): 23-32. |
| [3] | Han L, Zhao Y, Yin L, et al. Insulin-loaded pH-sensitive hyaluronic acid nanoparticles enhance transcellular delivery[J]. AAPS PharmSciTech, 2012, 13(3): 836-45. DOI: 10.1208/s12249-012-9807-2. |
| [4] | Zhang P, Xu Y, Zhu X, et al. Goblet cell targeting nanoparticle containing drug-loaded micelle cores for oral delivery of insulin[J]. Int J Pharm, 2015, 496(2): 993-1005. DOI: 10.1016/j.ijpharm.2015.10.078. |
| [5] | Damgé C, Socha M, Ubrich N, et al. Poly(epsilon-caprolactone)/ eudragit nanoparticles for oral delivery of aspart-insulin in the treatment of diabetes[J]. J Pharm Sci, 2010, 99(2): 879-89. DOI: 10.1002/jps.21874. |
| [6] | Zhang Y, Wu X, Meng L, et al. Thiolated eudragit nanoparticles for oral insulin delivery: preparation, characterization and in vivo evaluation[J]. Int J Pharm, 2012, 436(1/2): 341-50. |
| [7] | Park W, Kim D, Kang HC, et al. Multi-arm histidine copolymer for controlled release of insulin from poly(lactide-co-glycolide) microsphere[J]. Biomaterials, 2012, 33(34): 8848-57. DOI: 10.1016/j.biomaterials.2012.08.042. |
| [8] | Xiong XY, Li QH, Li YP, et al. Pluronic P85/poly(lactic acid) vesicles as novel carrier for oral insulin delivery[J]. Colloids Surf B Biointerfaces, 2013, 111(6): 282-8. |
| [9] | Kakizawa Y, Kataoka K. Block copolymer micelles for delivery of gene and related compounds[J]. Adv Drug Deliv Rev, 2002, 54(2): 203-22. DOI: 10.1016/S0169-409X(02)00017-0. |
| [10] | Webb AR, Yang J, Ameer GA. Biodegradable polyester elastomers in tissue engineering[J]. Expert Opin Biol Ther, 2004, 4(6): 801-12. DOI: 10.1517/14712598.4.6.801. |
| [11] | 李伟炜, 王颐婷, 沈梅, 等. mPEG-PCL聚合物囊泡的制备及INS-mPEG114-PCL-152_囊泡体外释放特性考察[J]. 中国实验方剂学杂志, 2014, 20(23): 15-21. |
| [12] | 王颐婷, 李伟炜, 沈梅, 等. 聚乙二醇/聚己内酯/聚乙烯亚胺载胰岛素纳米粒的体外释药性能[J]. 南方医科大学学报, 2016, 36(1): 109-15. |
| [13] | Liu G, Ma S, Li S, et al. The highly efficient delivery of exogenous proteins into cells mediated by biodegradable chimaeric polymersomes[J]. Biomaterials, 2010, 31(29): 7575-85. DOI: 10.1016/j.biomaterials.2010.06.021. |
| [14] | 吴晓明, 霍冀川, 雷永林. 可逆加成一断裂链转移(RAFT)聚合的研究进展[J]. 广东化工, 2010, 37(3): 9-11. |
| [15] | Huang XJ, Xiao Y, Lang MD. Synthesis and self-assembly behavior of six-armed block copolymers with pH-and thermo-responsive properties[J]. Macromolecular Research, 2011, 19(2): 113-21. DOI: 10.1007/s13233-011-0202-8. |
| [16] | Yue X, Qiao Y, Qiao N, et al. Amphiphilic methoxy poly (ethylene glycol)-b-poly (ε-caprolactone)-b-poly (2-dimethylaminoethyl methacrylate) cationic copolymer nanoparticles as a vector for gene and drug delivery[J]. Biomacromolecules, 2010, 11(9): 2306-12. DOI: 10.1021/bm100410m. |
| [17] | Liu L, Zhou C, Xia X, et al. Self-assembled lecithin/chitosan nanoparticles for oral insulin delivery: preparation and functional evaluation[J]. Int J Nanomedicine, 2016, 11(7): 761-9. |
| [18] | Zhu JL, Cheng H, Jin YE, et al. Novel polycationic micelles for drug delivery and gene transfer[J]. J Mater Chem, 2008, 18(37): 4433-41. DOI: 10.1039/b801249k. |
| [19] | Morita T, Horikiri Y, Suzuki T, et al. Preparation of gelatin microparticles by co-lyophilization with poly(ethylene glycol): characterization and application to entrapment into biodegradable microspheres[J]. Int J Pharm, 2001, 219(1/2): 127-37. |
| [20] | 吴丽莎, 喻红英, 曾庆冰. 姜黄素mPEG114-PCL36纳米胶束的制备及体外释药考察[J]. 中国实验方剂学杂志, 2013, 19(12): 53-8. |
| [21] | Papadopoulou V, Kosmidis K, Vlachou M, et al. On the use of the Weibull function for the discernment of drug release mechanisms[J]. Int J Pharm, 2006, 309(1/2): 44-50. |
| [22] | Xi N, Hou LB. Preparation and in vitro drug release study of long-circulating hydroxycamptothecin nanoparticles[J]. Zhong Yao Cai, 2010, 33(4): 610-3. |
| [23] | 王茵, 楼正清, 来伟旗, 等. SD大鼠血液生化指标正常参考值范围的探讨[J]. 卫生毒理学杂志, 2000, 14(2): 112-3. |
| [24] | Wang H, Xu D, Jiang P, et al. Novel restricted access chiral stationary phase synthesized via atom transfer radical polymerization for the analysis of chiral drugs in biological matrices[J]. Analyst, 2010, 135(7): 1785-92. DOI: 10.1039/c0an00050g. |
| [25] | Zhang YF, Wu T, Liu SY. Micellization kinetics of a novel multi-responsive double hydrophilic diblock copolymer studied by stopped-flow pH and temperature jump[J]. Macromol Chem Phys, 2007, 208(23): 2492-501. DOI: 10.1002/(ISSN)1521-3935. |
| [26] | Yao J, Ravi P, Tam KC, et al. Association behavior of poly(methyl methacrylate-block-methacrylic acid) in aqueous medium[J]. Langmuir, 2004, 20(6): 2157-63. DOI: 10.1021/la0355343. |
| [27] | 马利敏, 张强, 李玉珍. 载多肽和蛋白质药物的纳米粒给药系统的研究进展[J]. 中国药学杂志, 2000, 35(7): 437-40. |
| [28] | Liu Y, Steele T, Kissel T. Degradation of Hyper-Branched poly (ethylenimine)-graft-poly(caprolactone)-block-monomethoxyl-poly (ethylene glycol) as a potential gene delivery vector[J]. Macromol Rapid Commun, 2010, 31(17): 1509-15. DOI: 10.1002/marc.201000337. |
| [29] | Ahmed F, Discher DE. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles[J]. J Control Release, 2004, 96(1): 37-53. DOI: 10.1016/j.jconrel.2003.12.021. |
| [30] | Meng F, Hiemstra C, Engbers G, et al. Biodegradable polymersomes[J]. Macromolecules, 2003, 36(9): 3004-6. DOI: 10.1021/ma034040+. |
| [31] | Levine DH, Ghoroghchian PP, Freudenberg J, et al. Polymersomes: a new multi-functional tool for cancer diagnosis and therapy[J]. Methods, 2008, 46(1): 25-32. DOI: 10.1016/j.ymeth.2008.05.006. |
 2017, Vol. 37
2017, Vol. 37

