2. 南方医科大学深圳医院药剂科,广东 深圳 518000;
3. 南方医科大学南方医院药学部,广东 广州 510515;
4. 南方医科大学,广东 广州 510515
2. Department of Pharmacy, Shenzhen Hospital, Southern Medical University, Shenzhen 518000, China;
3. Department of Pharmacy, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
4. Southern Medical University, Guangzhou 510515, China
特应性皮炎(AD)是一种慢性、复发性、炎症性皮肤病,主要表现为剧烈瘙痒、反复搔抓、多形性皮疹及渗出倾向。其发病机制不清,可能与遗传、免疫、环境、感染、精神心理等多种因素有关[1-2]。20世纪90年代,Elias和Taieb首先提出皮肤屏障损害可能是AD发生的首要机制,皮肤屏障功能与AD发病的关系逐渐成为研究热点[3-4]。皮肤屏障的主要结构基础是连续性屏障的角质层,主要由角质形成细胞和细胞间脂质构成[5],它对皮肤内环境的稳态发挥了极其重要的作用。皮肤屏障功能受损引起AD这一观点的提出使得AD的治疗多了一个新方向——修复受损的皮肤屏障。目前,国内外多个特应性皮炎治疗指南均指出在AD的稳定期可以通过保湿润肤剂的使用来缓解皮肤脱屑、干燥、瘙痒等不适症状,充分肯定了保湿润肤剂在AD的后期治疗及预防复发的重要地位[6]。杨雪源等[7]通过实验研究指出,AD患者连续使用润肤剂一个月后,皮肤红斑、干燥、瘙痒等不适症状得到了明显改善。由于保湿润肤剂能缓解AD患者的不适症状且直接作用于皮肤表面,故本课题拟在保湿润肤剂中加入有助于修复皮肤屏障的有效成分,使得该润肤剂不仅可以改善AD的不适症状,而且还能修复受损的皮肤屏障,达到治疗AD的目的。目前,国内对于有皮肤屏障修复功能的润肤剂研发尚在起步阶段,针对不同患者的皮肤生理指标精准选择有效成分合理配比的润肤剂,将进一步提高润肤剂对AD的治疗效果,本文为此进行了前期的动物实验研究。
由于神经酰胺是皮肤屏障结构中脂质的重要组成部分,它具有保湿、抗衰老、抗过敏等作用,这对皮肤生物活性的调节及生理功能的维护起到了极其关键的作用[8]。有研究发现,轻度AD患者在使用了含有神经酰胺的外用药治疗1个月后,其红斑、干燥、瘙痒症状均得到明显改善,同时皮损处的皮肤含水量较使用前明显增加[9]。透明质酸钠被称为理想的天然保湿因子[10],它具有很好的润滑性和成膜性,能在皮肤表面形成一层透气的水化膜,使皮肤具有润滑感及滋润感[11]。丹皮酚是从中药徐长卿和牡丹皮中分离得到的生物活性物质,它具有抗过敏、抗炎、抗氧化等药理作用[12]。高健等[13]通过琼脂扩散抑菌实验证实了丹皮酚对白色念珠菌、金黄色葡萄球菌、短小芽孢杆菌以及肺炎克雷伯杆菌均有明显的抑制作用。山茶籽油与皮肤亲和性好,易被皮肤吸收使皮肤柔嫩而富有弹性,而且它富含维生素E,具有抗衰老、抗氧化的功效[14]。蒋玲艳等[15]证实了山茶籽油具备一定的抑菌能力,并且不受pH值影响,在pH值较正常人高的AD患者皮肤表面仍能发挥作用。另外,山茶籽油还具有促透皮吸收的作用[16],如果将其加入润肤剂的成分中,将有助于皮肤对其他有效成分的吸收。基于神经酰胺、透明质酸钠、丹皮酚、山茶籽油的以上特性,本课题选取这4种主要成份,按L9(34)正交试验的方法设计实验,通过检测AD小鼠皮肤生理指标优选润肤剂的处方,拟研制出具有一定抗炎、抗过敏活性、成分配比合理并且能修复皮肤屏障的保湿润肤剂,以及明确其有效性及安全性。
1 材料和方法 1.1 材料 1.1.1 主要试剂和仪器神经酰胺、透明质酸钠、丹皮酚、山茶籽油、2,4-二硝基氟苯(DNFB)、丙酮、橄榄油、小鼠干扰素-γ(IFN-γ)酶联免疫检测试剂盒(南京建成生物工程研究所,批号20160503),小鼠白介素-4(IL-4)酶联免疫检测试剂盒(南京建成生物工程研究所,批号20160503),小鼠免疫球蛋白E(IgE)酶联免疫检测试剂盒(南京建成生物工程研究所,批号20160503),全波长酶标仪(Thermo,型号Multiskan GO)、电动搅拌机(科析仪器DD001)、电热恒温水浴锅(上海一恒科技有限公司,型号HWS-28)、皮肤检测仪(丹麦Cortex,型号Dermalab Combo)及部分常用乳膏基质及化学仪器等。
1.1.2 动物4~6 W的SPF级纯系雌性BALB/c小鼠,成年新西兰大耳白家兔,雌雄各半,均由广东省医学实验动物中心提供(许可证号SCXK(粤)2013-0002)。
1.2 实验方法 1.2.1 润肤剂的制备方法(1)制备工艺的优选:在单因素实验的基础上,选取搅拌速度(A),乳化温度(B),搅拌时间(C)3个因素作为考察指标,如表 1所示,采用L9(34)正交实验设计。根据《中国药典》 2015年版的有关规定,选择乳膏剂的细腻度、涂展性、粒度、离心试验、耐热耐寒试验作为制剂外观性状和稳定性的评价指标。其中,细腻度的评分标准为:若样品均匀、细腻、无气泡及异物感即为100分;涂展性的评分标准为:若易于涂布于皮肤且均匀一致即为100分;粒度的评分标准为:取适量样品涂抹于载玻片上放在显微镜下观察,若未检出大于180 μm的粒子,且粒子大小一致、分布均匀即为100分;离心试验的评分标准为:取适量样品置于离心管中,在4000 r/min下离心30 min后观察,若无分层、油水分离现象即为100分;耐热耐寒试验的评分标准为:取适量样品置于密闭透明玻璃瓶中,分别置于55 ℃恒温箱中6 h或-15 ℃冰箱中24 h,恢复至室温后观察,若外观无改变、无油水分层即分为100分。并且对上述5项指标的得分进行加权处理,每项占20%,加权后的得分之和即为最终得分,同时,为了保证评分的客观性,每个指标均由5个人同时评分,取平均值作为最后的得分。从而优选出最佳的搅拌速度、乳化温度及搅拌时间。
| 表 1 制备工艺的正交实验因素及水平 Table 1 Factors and levels of the orthogonal design in emollient preparation process |
(2)润肤剂的处方组成:通过反复预实验,以及对基质稳定性的考察,确定了各种辅助成分的用量。而透明质酸钠、神经酰胺、丹皮酚、山茶籽油这4种主要成分,则各取3个不同的浓度按L9(34)正交实验表安排实验(表 2),制备出9种主要成分浓度不一的润肤剂。9种润肤剂的处方成分及用量如表 3所示。
| 表 2 4种主要成分的正交实验因素及水平 Table 2 Orthogonal test factors and levels of 4 main components in the emollient |
| 表 3 润肤剂处方成分及用量 Table 3 Composition of the emollients and their dosage |
(3)润肤剂的制备方法:取处方量的神经酰胺、丹皮酚、山茶籽油、硬脂酸、羊毛脂、白凡士林置一容器内水浴加热(油相);另取透明质酸钠、亚硫酸钠、尼泊金乙酯、三乙醇胺、丙二醇、甘油、蒸馏水置于另一容器内水浴加热(水相),将油相、水相分别加热至最佳的乳化温度,在最优的搅拌速度下把水相加入油相中搅拌至成形,并加入氮酮搅拌均匀即得。
1.2.2 特应性皮炎动物模型的制备(1)66只BALB/c小鼠,随机分成11组,每组6只,其中10组为模型组,1组为对照组,参照Choi[17]、纪玉青[18]、张丽霞[19]等制备AD小鼠模型的方法制备模型。制备前1周对小鼠背部进行脱毛处理,面积约2 cm×3 cm,实验第1天和第2天模型组小鼠皮损致敏与激发用0.5% DNFB以及丙酮/橄榄油(3:1)混合溶液涂搽小鼠背部脱毛区,每天1次,每次100 μL,第3~6天不作处理,第7天开始改为每3天涂搽1次,每次70 μL,共涂搽10次。对照组小鼠背部脱毛区仅涂搽丙酮/橄榄油(3:1)混合液,涂搽时间及涂搽剂量与模型组一致;(2)观察指标:① 搔抓行为:建模完成后,将小鼠单独放置,观察10 min内小鼠搔抓次数,连续搔抓算1次;② 皮损表现:观察各组小鼠皮损表现情况并拍照;③ 血清IFN-γ、IL-4及IgE浓度检测;④ 组织病理检查:显微镜下观察组织病理改变。
1.2.3 筛选润肤剂的最优处方将造模成功后的小鼠分成9组,分别使用上述实验所配制的9种润肤剂,每天均在小鼠背部皮肤涂抹0.1 g,连续7 d。实验第0天和第8天均使用皮肤检测仪对小鼠背部皮肤的含水量、TEWL两个指标进行检测,统计所得数据,筛选出最优处方。
1.2.4 药效学实验(1)造模:方法同前,制备50只AD小鼠模型;(2)分组及给药方法:造模成功后的小鼠随机分为5组,分别为空白对照组、阳性对照组、高剂量组、中剂量组、低剂量组,空白对照组使用润肤剂空白基质0.1 g,阳性对照组使用玉泽皮肤屏障修复精华乳(上海交通大学医学院附属瑞金医院皮肤科研制)0. 1 g,高剂量组、中剂量组、低剂量组分别使用上述实验所筛选出的最优处方润肤剂0.5、0.3、0.1 g;(3)实验方法:给药前进行皮肤生理指标检测(含水量、pH、TEWL),其后连续给药7 d,每天1次,第8天再次检测皮肤生理指标,收集数据进行统计分析。
1.2.5 皮肤刺激性试验新西兰大耳白家兔8只,分为正常皮肤组和破损皮肤组,每组4只,雌雄各半。采用同体左右侧自身对比法,实验前24 h进行脱毛处理,选取脱毛范围内左右各3 cm×3 cm作为实验区。破损皮肤组在用药部位用针头划破皮肤,以轻度渗血为度。左侧涂润肤剂0.5 g,右侧涂等量赋形剂(凡士林),贴敷4 h,每天1次,连续7 d。贴敷结束后,用温水去除残留受试物。每次去除药物后1 h以及再次用药前观察刺激情况。末次敷药后,在去除药物后1、24、48、72 h肉眼观察皮肤刺激情况。按《化妆品卫生规范(2007版)》 [20]的要求进行皮肤刺激性评价,记录涂抹处有无红斑和水肿、色素沉着、出血点、皮肤粗糙或皮肤菲薄等情况。皮肤刺激反应评分标准为[20]:红斑勉强可见为1分,中度红斑为2分,严重红斑为3分,紫色红斑并有焦痂形成为4分;水肿勉强可见为1分,皮肤隆起轮廓清楚为2分,隆起1 mm为3分,隆起1 mm以上并有扩大为4分;皮肤刺激强度评价标准:分值 < 0.50分为无刺激性,0.50≤分值 < 3.00分为轻度刺激性,3.00≤分值 < 6.00为中度刺激性,分值≥6.00为强刺激性。若动物出现死亡情况,及时进行尸检和肉眼观察,当有肉眼可见病变时,将进行病理组织学检查。
1.3 统计学方法实验数据均采用SPSS 20.0统计软件处理,计量资料以均数±标准差表示,两独立样本用t检验进行分析,多组间比较采用方差分析,两两比较用LSD检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 制备工艺的优选由表 4极差分析结果可知:因素影响的顺序为B> A>C。由表 5方差分析结果可知:B因素的影响非常显著(P < 0.05),其他两个因素差异无统计学意义(P > 0.05)。由于因素A无显著性,故选择一个中间值2000 r/min,C因素选择一个最低值10 min。即最佳组合为A2B2C1,搅拌速度为2000 r/min;乳化温度为80 ℃;搅拌时间为10 min。
| 表 4 制备工艺正交实验结果 Table 4 Orthogonal test results of the preparation process |
| 表 5 制备工艺正交实验结果方差分析 Table 5 Analysis of variance of orthogonal experiment in preparation process |
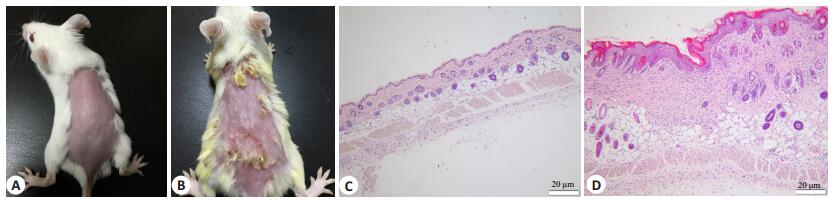
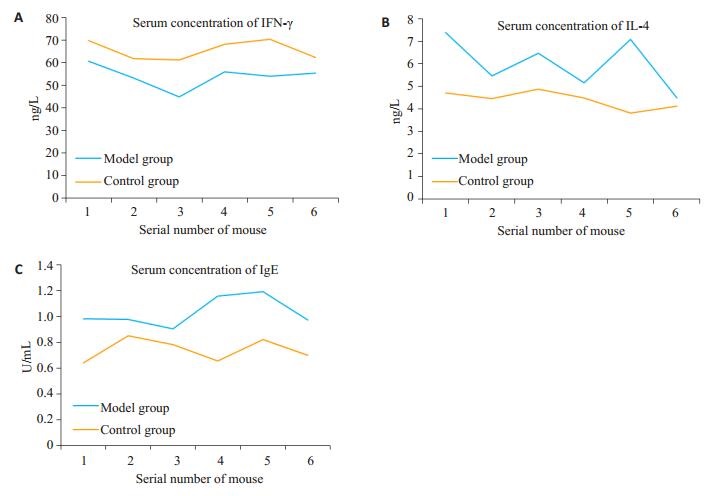
(1)搔抓行为:模型组小鼠10 min内搔抓23.00± 4.56次,对照组4.00±1.79次,模型组小鼠10 min内搔抓次数显著高于对照组(t=9.500,P < 0.05);(2)局部皮肤表现及皮肤组织病理变化:对照组动物皮肤未见异常,模型组动物皮肤可见表面粗糙、浸润、抓破而结痂、棕红色色素沉着等;病理显示表皮角化过度伴角化不全,棘细胞增生、棘层肥厚,局部表皮坏死、出血,表皮及真皮层甚至皮肤全层弥漫性炎细胞浸润(图 1);(3)血清IFN-γ、IL-4及IgE浓度:模型组小鼠血清IFN-γ浓度显著低于对照组(P < 0.05),而IL-4、IgE浓度均显著高于对照组(P < 0.05,图 2)。
|
图 1 特应性皮炎动物模型的建立 Figure 1 Establishment of animal model of atopic dermatitis. A: Dorsal skin of a normal mouse; B: Dorsal skin of a model mouse; C: Pathology of the dorsal skin of s normal mouse; D: Pathology of the dorsal skin of a model mouse. |
|
图 2 血清IFN-γ、IL-4、IgE的浓度 Figure 2 Serum concentration of IFN-γ (A), IL-4 (B) and IgE (C). |
由表 6极差分析结果可知:4个因素中对皮肤含水量的影响顺序为E>F>D>G,其中E1的影响最显著,由表 7方差分析结果可知:F、D、G这3个因素差异均无统计学意义(P > 0.05),选择最低浓度水平,即改善皮肤含水量的最优组合为D1E1F1G1;由表 8极差分析结果可知:4个因素中对TEWL的影响顺序为G>F>E>D,其中G1的影响最显著,由表 9方差分析结果可知:E、F、D这3个因素差异无统计学意义(P > 0.05),选择最低浓度水平,即改善皮肤TEWL的最佳组合为D1E1F1G1。因为两个皮肤生理指标优选结果均一致,所以D1E1F1G1为此次最优处方的优选结果,即透明质酸钠0.125 g;神经酰胺0.025 g;丹皮酚0.25 g;山茶籽油0.5 g。
| 表 6 含水量变化正交实验结果 Table 6 Orthogonal experiment results of water content variation |
| 表 7 含水量变化正交实验结果方差分析 Table 7 Variance analysis of orthogonal experiment results of water content variation |
| 表 8 TEWL变化正交实验结果 Table 8 Orthogonal experiment results of TEWL change |
| 表 9 TEWL变化正交实验结果方差分析 Table 9 Variance analysis of orthogonal experiment of TEWL change |
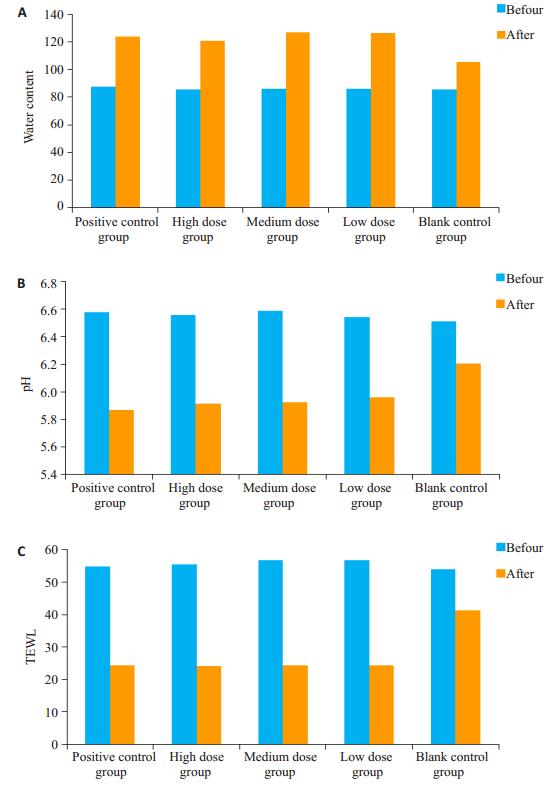
治疗后高剂量组、中剂量组、低剂量组皮肤含水量、pH、TEWL的变化均优于空白对照组,差异具有统计学意义(P < 0.05);高剂量组、中剂量组、低剂量组皮肤含水量变化、pH变化、TEWL变化与阳性对照组相比,差异不具有统计学意义(P > 0.05,图 3)。
|
图 3 使用润肤剂前后皮肤含水量、pH值和TEWL的变化 Figure 3 Changes of skin water content (A), pH (B) and TEWL (C) after application of the emollients. |
该润肤剂无论是单次给药还是多次给药,对家兔完整皮肤和破损皮肤均未见受试区域皮肤红斑、水肿、色素沉着、出血、粗糙或菲薄等情况,按《化妆品卫生规范(2007版)》皮肤刺激性/腐蚀性试验中表 1评分,结果均为0分,即该润肤剂无皮肤刺激性。
3 讨论目前,关于AD动物模型的制备技术已相当成熟,且大多以小鼠来制备,其中包括使用自发性AD小鼠[21]、NC/Nga鼠[22]、转基因小鼠[23]以及BALB/c小鼠等。由于自发性AD小鼠价格昂贵、饲养条件要求高、制备技术难度高;NC/Nga鼠在国内较难买到,价格昂贵;转基因小鼠价格昂贵且制备技术还不成熟,仍需进一步探讨;而BALB/c小鼠遗传基因纯正、个体之间差异小、整体素质好、饲养要求不高,所以本课题所制备的AD动物模型均使用BALB/c小鼠。此次造模的结果显示,模型组小鼠的搔抓次数明显高于对照组;模型组小鼠背部皮肤局部表现与组织病理切片均符合AD的特征;血清酶联免疫吸附试验显示:IL-4、IgE浓度升高;IFN-γ浓度降低,也符合AD发病的免疫学机制。上述结果充分证明了该AD动物模型制备成功,可用于本课题筛选最优处方润肤剂及药效学实验。
本课题采取检测AD小鼠使用润肤剂前后皮肤生理指标的改变来进行处方优选,具有客观及可量化性。目前已证实皮肤含水量、TEWL这两个生理指标能反映皮肤局部的生理状态[24],其中皮肤含水量是用来评价化妆品或外用药保湿功效的最常用指标,也可用于检测皮肤的干燥程度,而TEWL是判断皮肤屏障功能优劣的最常用指标,TEWL越大,皮肤越干燥,屏障功能越差。如今皮肤检测仪已被广泛用于检测患者皮肤的受损程度[25]。本实验通过皮肤检测仪的使用收集了主要成分浓度不一的润肤剂对皮肤屏障的影响的数据,使我们可以精准地调整有效成分的浓度,从而优选出最佳处方。另外,这也为我们今后在临床上对皮肤屏障受损的患者进行精准治疗提供了实验支持,我们可以在治疗前先通过检测发现患者皮肤屏障受损的主要指标,再针对性地使用改善相应指标的润肤剂进行治疗,以求达到最佳的治疗效果。值得进一步探讨的是,本实验在优选处方过程中发现透明质酸钠的用量对皮肤含水量、TEWL的改变没有统计学差异,这跟实验的设想有出入,可能与实验使用的小分子透明质酸钠有关,其分子量小,易渗透进入真皮层,导致角质层的含水量增加不明显;也可能是神经酰胺与透明质酸钠同时具有补水的作用,但神经酰胺的补水效果是透明质酸的16倍[26],两者交互影响产生了以上现象;还有可能是AD小鼠使用该润肤剂的时间(1周)不长,影响了结果。今后可单独使用透明质酸钠对小鼠进行验证实验,进一步明确其补水能力。
在药效学实验过程中观察到AD小鼠皮肤干燥、粗糙、浸润、红斑等症状在使用了该润肤剂之后明显改善,皮肤含水量、TEWL、pH均明显优于对照组,说明了该润肤剂能有效缓解AD的症状、修复受损的皮肤屏障,而且在实验后期观察到,停止使用该润肤剂2周后,AD小鼠红斑、瘙痒、脱屑等症状没有复发。另外,在进行皮肤刺激性实验时观察到,润肤剂对皮损的修复速度优于赋形剂,这可能与丹皮酚具有消炎、止痒作用有关;也可能是该润肤剂修复了皮肤屏障,加速了皮肤的愈合,因此,该润肤剂有望用于治疗及预防AD。
综上所述,本研究成功制备了以神经酰胺、透明质酸钠、丹皮酚、山茶籽油为主要成分的保湿润肤剂,并通过检测AD小鼠皮肤生理指标的改变来优选最佳处方,对其进行药效学及皮肤刺激性实验,证实了该润肤剂能有效修复AD小鼠的皮肤屏障,缓解其背部红斑、干燥、瘙痒等症状。实验的结果将为今后通过皮肤生理指标检测了解AD患者皮肤屏障受损程度,从而使用相应的保湿润肤剂防治提供了依据。但实验中仅使用了一种皮肤屏障受损程度相似的AD小鼠对润肤剂的处方进行优选,得到了该受损程度所对应的最佳组分配比。今后,我们将采用多种皮肤屏障受损程度不一的AD小鼠来对润肤剂的处方进行优选,优选出不同受损程度下对应的最优处方,以求今后能对不同的AD患者进行精准的治疗。
| [1] | 瞿旻晔, 袁晓琳, 马健. 特应性皮炎发病过程及其机制研究现状探讨[J]. 中国皮肤性病学杂志, 2015, 29(10): 1085-7. |
| [2] | 彭星, 刘玉梅. 特应性皮炎发病机制的研究进展[J]. 中国实验诊断学, 2014, 18(10): 1734-7. |
| [3] | 唐萍, 谭琦, 王华. 皮肤屏障关键结构与特应性皮炎的相关性[J]. 激光杂志, 2013, 34(5): 118-9. |
| [4] | Yoshida S, Yasutomo K, Watanabe T. Treatment with DHA/EPA ameliorates atopic dermatitis-like skin disease by blocking LTB4 production[J]. J Med Invest, 2016, 63(3-4): 187-91. |
| [5] | 杨扬, 马慧军, 胡蓉. 皮肤角质层的相关屏障结构和功能的研究进展[J]. 中国美容医学, 2012, 21(1): 158-61. |
| [6] | 任发亮, 顾恒. 中外特应性皮炎诊疗指南比较[J]. 中国皮肤性病学杂志, 2013, 27(2): 210-3. |
| [7] | 杨雪源, 徐丽敏, 周爱民, 等. 含马齿苋及牛油果树提取物的医学护肤品辅助治疗特应性皮炎的临床观察[J]. 临床皮肤科杂志, 2010, 39(7): 460-2. |
| [8] | Novotny J, Janusova B, Novotny M, et al. Short-chain ceramides decrease skin barrier properties[J]. Skin Pharmacol Physiol, 2009, 22(1): 22-30. DOI: 10.1159/000183923. |
| [9] | Na JI, Hwang JS, Park HJ, et al. A new moisturizer containing physiologic lipid granules alleviates atopic dermatitis[J]. J Dermatolog Treat, 2010, 21(1): 23-7. DOI: 10.3109/09546630903085336. |
| [10] | 崔媛, 段潜, 李艳辉. 透明质酸的研究进展[J]. 长春理工大学学报(自然科学版), 2011, 34(3): 101-6. |
| [11] | 陈祥娥, 凌沛学. 透明质酸与化妆品[J]. 食品与药品, 2010, 20(7): 278-80. |
| [12] | 杨正生, 彭振辉, 姚青海, 等. 丹皮酚的药理作用研究进展[J]. 中国药物与临床, 2011, 11(5): 545-7. |
| [13] | 高健, 相海鹰, 许同桃, 等. 丹皮酚及其席夫碱衍生物的抑菌性研究[J]. 化学试剂, 2007, 29(1): 59-60. |
| [14] | 陈軻, 刘振香, 罗小会. 野生山茶籽油润肤霜的研制[J]. 金华职业技术学院学报, 2015, 15(3): 80-5. |
| [15] | 蒋玲艳, 王林果, 欧熳熳. 茶油抑菌效果的研究[J]. 安徽农业科学, 2008, 36(14): 5913-4. |
| [16] | 王爱萍, 袁丹, 孙考祥, 等. 山茶油对非甾体抗炎药经皮渗透的促进作用[J]. 沈阳药科大学学报, 2006, 50(10): 621-4. |
| [17] | Choi J H, Park B H, Kim H G, et al. Inhibitory effect of Psidium guajava water extract in the development of 2, 4-dinitrochlorobenzene-induced atopic dermatitis in NC/Nga mice[J]. Food Chem Toxicol, 2012, 50(8): 2923-9. DOI: 10.1016/j.fct.2012.04.044. |
| [18] | 纪玉青, 贾强, 赵雪铮, 等. 2, 4-二硝基氯苯诱导超敏反应性皮炎小鼠淋巴细胞增殖与活化研究[J]. 中国职业医学, 2014, 41(5): 489-95. |
| [19] | 张丽霞, 王倩, 陈金, 等. 特应性皮炎小鼠模型建立方法的研究[J]. 实用医院临床杂志, 2014, 11(2): 16-8. |
| [20] | 中华人民共和国卫生部. 化妆品卫生规范-2007(皮肤刺激性/腐蚀性试验[J]. 北京:中华人民共和国卫生部, 2007: 102-9. |
| [21] | Hattori K, Nishikawa M, Watcharanurak K, et al. Sustained exogenous expression of therapeutic levels of IFN-gamma ameliorates atopic dermatitis in NC/Nga mice via Th1 polarization[J]. J Immunol, 2010, 184(5): 2729-35. DOI: 10.4049/jimmunol.0900215. |
| [22] | Matsuda H, Watanabe N, Geba G P, et al. Development of atopic dermatitis-like skin lesion with IgE hyperproduction in NC/Nga mice[J]. Int Immunol, 1997, 9(3): 461-6. DOI: 10.1093/intimm/9.3.461. |
| [23] | 云晴, 杨高云, 乌日娜. 小鼠模型在特应性皮炎方面的研究进展[J]. 临床和实验医学杂志, 2012, 11(22): 1827-9. |
| [24] | 蔄茂强, PeterME. 特应性皮炎患者皮肤的水通透屏障功能改变及其临床意义[J]. 临床皮肤科杂志, 2007, 36(10): 671-3. |
| [25] | 张怀亮. 皮肤生理量化指标研究新进展[J]. 中国中西医结合皮肤性病学杂志, 2003, 2(1): 59-62. |
| [26] | 魏静, 张伟敏, 钟耕. 神经酰胺对皮肤生理作用及其在化妆品中应用[J]. 粮食与油脂, 2007, 21(1): 21-4. |
 2017, Vol. 37
2017, Vol. 37

