年龄相关性黄斑变性(AMD),又称老年性黄斑变性,多发于50岁以上老年患者,是发达国家老年人致肓的最常见原因[1],而其中以脉络膜新生血管(CNV)为特点的湿性AMD更是导致视力明显下降和致盲的主要类型[2]。随着我国经济、文化、卫生条件的改善和提高,该病在我国呈明显上升趋势。研究显示,在我国50岁以上老人中湿性老年性黄斑变性的发病率约2.26~3.04%,并且该病的发生随着年龄的增加而明显增加[1, 3-6]。
湿性AMD为脉络膜毛细血管通过Bruch膜的裂隙进入色素上皮下,形成CNV所致,其视网膜外屏障破坏,导致视网膜水肿,可出现视网膜下渗出,出血及瘢痕[7],从而严重影响患者中心视力及生活质量。目前,新近出现的抗新生血管形成的药物雷珠单抗(商品名为Lucentis)是我国引进的一种用于治疗湿性AMD的药物,它可以抑制新生血管生成,同时减少血管渗漏、消除组织水肿。因其显著的疗效已成为国内外治疗眼部新生血管性疾病的发展趋势和研究热点,国内外均有应用Lucentis治疗湿性AMD取得良好疗效的报道[8-12]。
多焦视网膜电图(mfERG)可以检测视网膜后极部20%~30%视野内各小区域的视网膜功能, 对发现早期视网膜病变及缺少形态学改变的微小黄斑病变具有较好的应用价值。可应用于观察湿性AMD的病情进展及疗效评估。但应用mfERG观察Lucentis治疗后黄斑视功能变化的研究较少,且结论各异[13-15]。本研究旨在采用mfERG评价湿性AMD患者接受玻璃体腔注射Lucentis前后的客观视功能的改变。
1 对象和方法 1.1 研究对象前瞻性地纳入由眼底荧光素血管造影(FFA)、光学相干断层扫描(OCT)确诊的湿性AMD病例,初诊和随访期间患者最佳矫正视力(BCVA)大于等于0.1,以确保mfERG检查期间的良好固视。纳入标准:(1)所有患者年龄>50岁,排除高度近视性黄斑变性、糖尿病视网膜病变、视网膜前膜等其它视网膜疾病可能,排除白内障等其他影响屈光介质因素;(2)患者在本院经FFA、OCT和检查并结合临床特征诊断为湿性老年黄斑变性;(3)未做过眼底激光光凝或球内注射药物等侵入性治疗;(4)能负担治疗的昂贵费用。剔除标准:(1)合并严重高血压、糖尿病、心、肺、肾功能不全者;(2)合并近视性黄斑变性、糖尿病视网膜病变、视网膜前膜等可能影响疗效的眼部疾患;(3)合并严重的白内障、角膜病、玻璃体积血等屈光间质混浊,影响治疗及检查者;(4)不能按计划坚持治疗和未能完成随访者。共有14例(14眼)患者纳入研究,其中男9例,女5例,年龄58~82(72.8±8.4)岁。该研究方案经过广州爱尔眼科医院伦理委员会的批准通过,所有患者均签署知情同意书。
1.2 仪器和试剂玻璃体腔注射药物为Lucentis[雷珠单抗注射液(诺适得),诺华公司]。视力检查采用国际标准视力表,mfERG检查应用德国罗兰RETIScan multifocal ERGVersion 3.15系统。
1.3 玻璃体注射所有患者注射前均被告知治疗目的和治疗后可能发生的并发症,并签署知情同意书。所有操作均由同一医生于手术室内进行无菌操作。眼表局部予以奥布卡因滴眼液表面麻醉,眼部消毒后,结膜囊内予以5%聚维酮碘冲洗消毒90 s,使用30 G注射针头由睫状体平坦部进针, 于玻璃体腔内注射雷株单抗注射液0.05 mL,注射完毕后针头拔出立即以消毒棉签顶压注射口处片刻,术后予以抗生素眼膏包眼。所有患者治疗前3d开始给予左氧氟沙星滴眼液点眼,4次/d,1次1滴,滴眼1周。
1.4 注射次数本研究采用1+PRN(按需注射)的治疗方案。注射后每月复诊,根据复诊情况决定是否重复治疗。
1.5 相关检查及随访患者于初诊时及玻璃体腔注射Lucentis后l、3、6个月分别进行视力和mfERG检查。记录并分析治疗前后患者mfERG6个环的潜伏期和反应密度。视力检查采用国内通用的标准视力表箱进行检查。
采用德国罗兰公司生产的RETIScan multifocal ERGVersion 3.15系统于初诊、随访1月、3月、6月进行检查。选用一阶反应波形和数值,将视网膜的刺激区从中心凹起按不同的离心度分成6个环形区,第1环代表中心凹区域,第2、3、4、5和第6环分别表示各环的中心位离心度视角为3.22°、7.13°、11.83°、17.52°和23.63°。在平均图形上,将笫1个负波和第1个正波分别称为Nl波和P1波。N1波振幅为基线至波谷的电位差,P1波振幅为N1波的波谷至P1波的波峰值间的电位差,由于六边形的面积不均等,各个六边形的振幅无直接可比性,因而采用振幅密度的表示法(六边形波振幅/六边形面积,单位为nV/deg2)。N1波、Pl波潜伏期分别为刺激开始至N1波波谷和P1波波峰的时间,单位为ms。
1.6 统计学分析统计学方法应用SPSS 13.0统计软件进行统计学分析。所有数据均采用均数±标准差的方式表示,对所采集的数据采用配对t检验,以P < 0.05差异具有统计学意义。
2 结果 2.1 注射次数在随访期间,所有随访患者均未发生与药物及玻璃体腔注射有关的眼部和全身严重不良反应。末次随访时,患者接受Lucentis注射次数范围为1~5次,2.86± 1.58次。
2.2 最佳矫正视力结果随访6个月时,最佳矫正视力提高11眼(78.57%),下降1眼(7.1%),2眼(14.29%)维持不变。治疗后1个月BCVA(0.18±0.05)与治疗前BCVA(0.14±0.04)相比无明显差异(P=0.07),治疗后3个月(0.45±0.30)、6个月(0.56±0.43)的BCVA与治疗前BCVA(0.14±0.04)相比较,逐渐提高,且差异均有统计学意义(P < 0.05)。
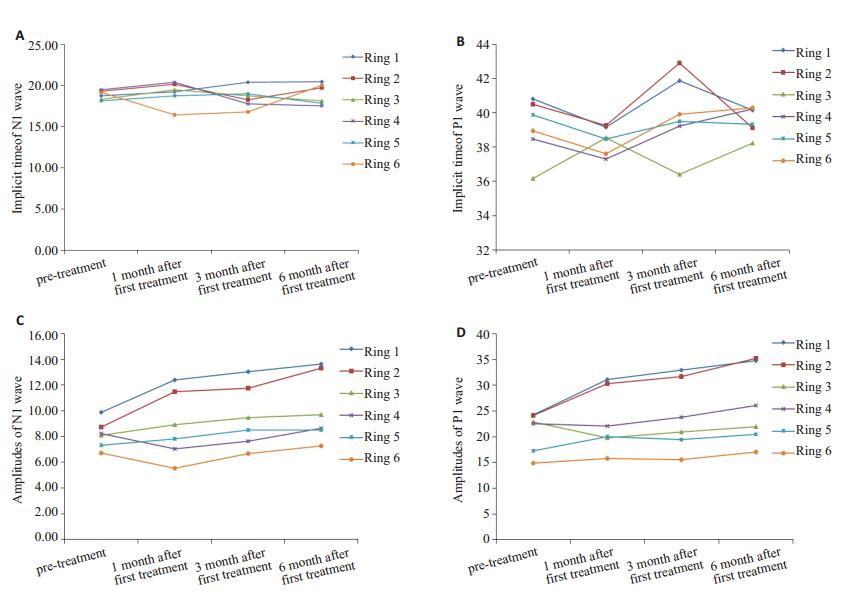
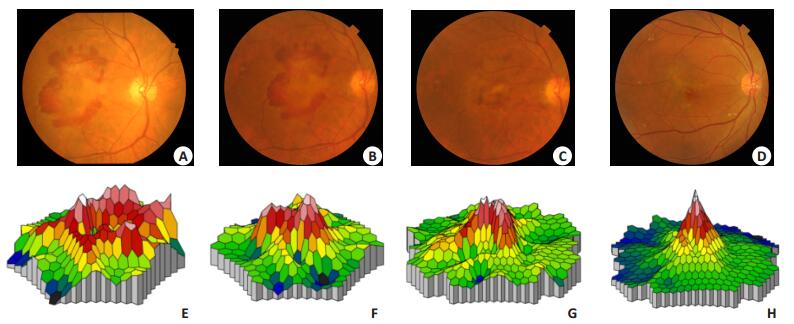
2.3 mfERG结果对mfERG进行6个同心圆的分环分析(图 1)。由图中可以看出,N1波潜伏期在治疗前与治疗后1个月、3个月及6个月时1~6环的差异均无统计学意义(P>0.05)(图 1A),P1波潜伏期在治疗前与治疗后1个月、3个月及6个月时1~6环的差异均无统计学意义(P>0.05,图 1B)。治疗后1个月、3个月、6个月第1环、2环N1波、P1波振幅密度比治疗前明显增加,差异具有明显的统计学意义(P < 0.05),治疗前与治疗后1、3、6月其余各环的差异均无统计学意义(P>0.05,图 1C,D)。图 2为一位68岁的男性湿性AMD患者,治疗前、首次治疗后1个月、3个月、6个月的眼底彩照(图 2A~D)和mfERG的反应密度三维图(图 2E~H)。
|
图 1 N1波、P1波潜伏期及振幅密度在治疗前后的变化 Figure 1 Changes of implicit time and amplitudes of the N1 and P1 waves. A: Implicit time of N1 wave; B: Implicit time of P1 wave; C: Amplitudes of N1 wave; D: Amplitudes of the P1 wave. |
|
图 2 典型病例:AMD患者治疗前后眼底彩照和mfERG的反应密度三维图 Figure 2 A typical case: the color images of the fundus (A-D) and three-dimensional density plots of mfERG (E-H) from a 68-year-old male patient with wet AMD. |
目前临床上针对湿性AMD相关CNV的治疗方法主要体现在抗血管内皮生长因子药物的应用上,常用的药物主要有雷珠单抗、贝伐单抗、阿柏西普等[16-25]。其中利用玻璃体腔注射雷珠单抗治疗湿性AMD的安全性和有效性得到了国内外学者的逐步证实[20-21, 25-26]。在本研究中,所有随访患者均未发生与药物及玻璃体腔注射有关的眼部和全身严重不良反应。随访6个月时,最佳矫正视力提高11眼(78.57%),下降1眼(7.1%),2眼(14.29%)维持不变。在随访的第l、3、6个月时与治疗前相比平均视力均有提高,其中随访第3、6个月时的视力提高具有统计学意义。本研究结果与Moschos等[13]的研究结果类似,他们对15例湿性AMD患者玻璃体腔注射雷珠单抗治疗后同样观察到了视力的稳定或提高。
湿性AMD相关CNV主要体现在对中心视力的损害上,而中心视力是评价视功能的一项传统的心理物理学指标,不能完全反映出黄斑区,尤其黄斑周围视网膜功能的变化,易受主观因素的影响。mfERG可以精确地评价外层视网膜的区域性功能改变[26-29]。为了客观评价经玻璃体腔注射雷珠单抗治疗湿性AMD对视网膜功能的影响,本研究观察了治疗前后1、3、6个月时mfERG的改变情况。
本研究中,经治疗后N1波及P1波振幅密度较治疗前有所增加,其中第1环、第2环的N1波、P1波振幅密度与治疗前差别有统计学意义(P < 0.05),提示经治疗后黄斑区的反应活动有轻微的升高,可以在一定程度上稳定或改善黄斑区的视功能。但治疗前后N1波、P1波潜伏期改变的差异无统计学意义(P>0.05),可能与多方面的因素有关,如神经细胞之间的传导方式和病变对细胞生物学特性的影响等。但是,有研究表明视网膜电图潜伏期改变的临床意义不如振幅重要[30]。该研究结果与Moschos等[13]的研究结果部分一致,经玻璃体腔注射雷珠单抗治疗湿性AMD随访1年的结果显示治疗后视力有显著提高,mfERG1环的N1波及P1波振幅密度较治疗前有所增加,2环保持不变,3环无改变。两项研究比较分析,这一差异的原因之一可能为两个研究所采用的治疗方案不同,本研究采用的是1+PRN的治疗方案。另一个原因则可能为对mfERG分析时采用的分组方法不同。在本研究中,我们测量并比较了按外层视网膜细胞排列规律划分的全部6个环的视网膜电生理反应以精确评价不同区域的视网膜功能,而不是合并多个环或仅检测其中某一部分的电生理反应。
本研究结果表明尽管在治疗后1个月、3个月和6个月均不同程度的观察到视力和mfERG的提高,但它们的变化趋势却并不完全相同,以及BCVA和mfERG改善进程存在差异,造成这一现象的原因尚不清楚,有待于进一步探讨。本研究的主要局限性在于基线水平上的选择偏倚,为了确保mfERG检查过程中的良好固视,本研究排除了视力低于0.1的患者,但是对于黄斑病变的患者,极有可能存在旁中心注视的情况,所以在检查过程中不能完全相信患者本身的固视,还应该重视过程中的眼底刺激位置监测。由于本研究使用的该版本罗兰系统暂无这个功能,本研究忽略了旁中心注视的情况。另外由于伦理因素,无法设立空白对照组以排除如自然病程等对结果的影响。另外由于本研究患者样本量有限,随访时间偏短,今后需要扩大样本量,延长随访时间,完善mfERG对治疗预后的推测、对下次治疗时间的预测等信息进行进一步深入观察和研究。
综上所述,经玻璃体腔注射雷珠单抗治疗湿性AMD后患者视力提高,mfERG结果显示治疗后N1、P1波平均反应密度逐渐增加,说明经玻璃体腔注射雷珠单抗治疗湿性AMD可以在一定程度上改善黄斑区的视功能,mfERG可以作为一种评估治疗后患者视功能变化情况的良好指标。
| [1] | Jonasson F, Fisher DE, Eiriksdottir GA, et al. Five-Year incidence, progression, and risk factors for Age-Related macular degeneration the age, gene/environment susceptibility study[J]. Ophthalmology, 2014, 121(9): 1766-72. DOI: 10.1016/j.ophtha.2014.03.013. |
| [2] | Age-Related Eye Disease Study 2 Research Group, Huynh N, Nicholson BP, et al. Visual acuity after cataract surgery in patients with age-related macular degeneration: age-related eye disease study 2 report number 5[J]. Ophthalmology, 2014, 121(6): 1229-36. DOI: 10.1016/j.ophtha.2013.12.035. |
| [3] | You QS, Xu L, Yang H, et al. Five-year incidence of age-related macular degeneration: the Beijing Eye Study[J]. Ophthalmology, 2012, 119(12): 2519-25. DOI: 10.1016/j.ophtha.2012.06.043. |
| [4] | Yang K, Wang FH, Liang YB, et al. Associations between cardiovascular risk factors and early age-related macular degeneration in a rural Chinese adult population[J]. Retina, 2014, 34(8): 1539-53. DOI: 10.1097/IAE.0000000000000118. |
| [5] | Peng Y, Tao QS, Liang YB, et al. Eye care use among rural adults in China: the Handan Eye Study[J]. Ophthalmic Epidemiol, 2013, 20(5): 274-80. DOI: 10.3109/09286586.2013.823216. |
| [6] | Myers CE, Klein BE, Gangnon R, et al. Cigarette smoking and the natural history of age-related macular degeneration: the Beaver Dam Eye Study[J]. Ophthalmology, 2014, 121(10): 1949-55. DOI: 10.1016/j.ophtha.2014.04.040. |
| [7] | Ablonczy Z, Dahrouj M, Marneros AG. Progressive dysfunction of the retinal pigment epithelium and retina due to increased VEGF-A levels[J]. FASEB J, 2014, 28(5): 2369-79. DOI: 10.1096/fj.13-248021. |
| [8] | Avery RL, Castellarin AA, Steinle NC, et al. Systemic pharmacokinetics following intravitreal injections of ranibizumab, bevacizumab or aflibercept in patients with neovascular AMD[J]. Br J Ophthalmol, 2014, 98(12): 1636-41. DOI: 10.1136/bjophthalmol-2014-305252. |
| [9] | Bhavsar AR, Torres K, Glassman AR, et al. Evaluation of results 1 year following short-term use of ranibizumab for vitreous hemorrhage due to proliferative diabetic retinopathy[J]. JAMAOphthalmol, 2014, 132(7): 889-90. |
| [10] | Ho AC, Busbee BG, Regillo CD, et al. Twenty-four-month efficacy and safety of 0.5 mg or 2.0 mg ranibizumab in patients with subfoveal neovascular age-related macular degeneration[J]. Ophthalmology, 2014, 121(11): 2181-92. DOI: 10.1016/j.ophtha.2014.05.009. |
| [11] | Parodi MB, Iacono P, La Spina C, et al. Intravitreal ranibizumab for naive extrafoveal choroidal neovascularization secondary to agerelated macular degeneration[J]. Retina, 2014, 34(11): 2167-70. DOI: 10.1097/IAE.0000000000000223. |
| [12] | Zhao J, Li X, Tang S, et al. EXTEND Ⅱ: an open-label phase Ⅲ multicentre study to evaluate efficacy and safety of ranibizumab in Chinese patients with subfoveal choroidal neovascularization secondary to age-related macular degeneration[J]. Bio Drugs, 2014, 28(6): 527-36. |
| [13] | Moschos MM, Brouzas D, Chatziralli IP, et al. Ranibizumab in the treatment of choroidal neovascularisation due to age-related macular degeneration: an optical coherence tomography and multifocal electroretinography study[J]. Clin Exp Optom, 2011, 94(3): 268-75. DOI: 10.1111/cxo.2011.94.issue-3. |
| [14] | Lubiński W, Mozolewska-Piotrowska K, Krasodomska K, et al. Evaluation of treatment efficacy of intravitreal ranibizumab injections in patients with wet type of AMD[J]. Klin Oczna, 2012, 114(3): 187-93. |
| [15] | Feigl B, Greaves A, Brown B. Functional outcomes after multiple treatments with ranibizumab in neovascular age-related macular degeneration beyond visual acuity[J]. Clin Ophthalmol, 2007, 1(2): 167-75. |
| [16] | Vottonen P, Kankaanpaa E. Cost-effectiveness of treating wet age-related macular degeneration at the Kuopio University Hospital in Finland based on a two-eye Markov transition model[J]. Acta Ophthalmol, 2016, 94(7): 652-6. DOI: 10.1111/aos.2016.94.issue-7. |
| [17] | Schicht M, Hesse K, Schroeder H, et al. Efficacy of aflibercept (EYLEA (R)) on inhibition of human VEGF in vitro[J]. Ann Anat, 2017, 211: 135-9. DOI: 10.1016/j.aanat.2017.02.005. |
| [18] | Schauwvlieghe A, Dijkman G, Hooymans J, et al. Comparing the effectiveness of bevacizumab to ranibizumab in patients with exudative Age-Related macular degeneration. the BRAMD study[J]. PLoS One, 2016, 11(5): e153052. |
| [19] | Ghosh W, Wickstead R, Claxton L, et al. The Cost-Effectiveness of ranibizumab treat and extend regimen versus aflibercept in the UK[J]. Adv Ther, 2016, 33(9): 1660-76. DOI: 10.1007/s12325-016-0367-9. |
| [20] | Lu YY, Huang JF, Zhao J, et al. Effects of intravitreal ranibizumab injection on Chinese patients with wet Age-Related macular degeneration: 5-Year Follow-Up results[J]. J Ophthalmol, 2016, 2016: 6538192. |
| [21] | Qi HJ, Li XX, Zhang JY, et al. Efficacy and safety of ranibizumab for wet age-related macular degeneration in Chinese patients[J]. Int J Ophthalmol, 2017, 10(1): 91-7. |
| [22] | Veritti D, Sarao V, Parravano MA, et al. One-year results of aflibercept in vascularized pigment epithelium detachment due to neovascular AMD: a prospective study[J]. Eur J Ophthalmol, 2017, 27(1): 74-9. DOI: 10.5301/ejo.5000880. |
| [23] | Chaudhary V, Barbosa J, Lam WC, et al. Ozurdex in age-related macular degeneration as adjunct to ranibizumab (The OARA Study)[J]. Can J Ophthalmol, 2016, 51(4): 302-5. DOI: 10.1016/j.jcjo.2016.04.020. |
| [24] | Moreno TA, Kim SJ. Ranibizumab (lucentis) versus bevacizumab (avastin) for the treatment of Age-Related macular degeneration: an economic disparity of eye health[J]. Semin Ophthalmol, 2016, 31(4, SI): 378-84. DOI: 10.3109/08820538.2016.1154174. |
| [25] | Moreno MR, Tabitha TS, Nirmal J, et al. Study of stability and biophysical characterization of ranibizumab and aflibercept[J]. Eur J Biopharm, 2016, 108: 156-67. DOI: 10.1016/j.ejpb.2016.09.003. |
| [26] | Reinsberg M, Hilgers RD, Luedeke IA, et al. Testing the clinical value of multifocal electroretinography and microperimetry and the effects of intravitreal therapy with ranibizumab on macular function in the course of wet age-related macular degeneration: a 1-year prospective study[J]. Clin Ophthalmol, 2017, 11: 621-9. DOI: 10.2147/OPTH. |
| [27] | Yavas GF, Kusbeci T, Inan UU. Multifocal electroretinography in subjects with age-related macular degeneration[J]. Doc Ophthalmol, 2014, 129(3): 167-75. DOI: 10.1007/s10633-014-9460-z. |
| [28] | Yang S, Zuo C, Xiao H, et al. Photoreceptor dysfunction in early and intermediate age-related macular degeneration assessed with mfERG and spectral domain OCT[J]. Doc Ophthalmol, 2016, 132(1): 17-26. DOI: 10.1007/s10633-016-9523-4. |
| [29] | Gerth C. The role of the ERG in the diagnosis and treatment of Age-Related Macular Degeneration[J]. Doc Ophthalmol, 2009, 118(1): 63-8. DOI: 10.1007/s10633-008-9133-x. |
| [30] | Seeliger MW, Jurklies B, Kellner U, et al. Multifocal electroretinography (mfERG)[J]. Ophthalmologe, 2001, 98(11): 1112-27. DOI: 10.1007/s003470170036. |
 2017, Vol. 37
2017, Vol. 37

