2. 漯河市中心医院泌尿外科,河南 漯河 462000;
3. 解放军军事医学科学院基础医学研究所,北京 100850
2. Department of Urology, Luohe Central Hospital, Luohe 462000, China;
3. The Institute of Basic Medical Ssciences, Chinese Academy of Military Medical Sciences, Beijing 100850, China
近年来,前列腺癌和乳腺癌的发病率逐年升高,而骨转移是这两种肿瘤的主要转移方式[1-3]。目前,研究肿瘤的骨转移多采用左心室注射、胫骨注射、下腔静脉注射、尾静脉注射和原位接种等方法建立的肿瘤骨转移模型。上述几种方法,不同程度存在转移特异性差、成瘤率较低、成瘤周期长、不符合肿瘤骨转移病理生理过程等问题[4]。因此,建立一种特异性高、符合肿瘤骨转移的病理生理学过程的动物模型,对于肿瘤骨转移及抗肿瘤药物的分子机制研究具有重要的意义[5-6]。2015年,Wang等[7]建立了经髂外动脉注射建立骨转移模型的方法。但是髂外动脉注射存在创伤大、手术时间长等不足。在本研究中,我们经小鼠股动脉注射前列腺癌细胞RM-1和乳腺癌细胞4T1-luc,与髂外动脉注射法进行了对比,并初步评价了通过此方法建立前列腺癌和乳腺癌骨转移模型的操作可行性及转移效果。
1 材料和方法 1.1 实验材料小鼠前列腺癌RM-1细胞购自ATCC细胞库,表达荧光素酶报告基因(luciferase, luc)的小鼠乳腺癌4T1-luc细胞由本室构建并保存。胰酶消化、收集处于对数生长期的RM-1细胞和4T1-luc细胞,PBS洗涤后,用1×PBS重悬,计数并调整细胞密度至1×105/mL,置于冰上备用。选取体质量为18~22 g的C57BL/6J雄鼠和16~20 g的BALB/c雌鼠用于实验研究。动物由军事医学科学院实验动物中心提供,实验和饲养过程中严格遵循SPF标准。使用奥林巴斯SZ-STU1解剖镜观察小鼠腿部解剖结构,并在镜下完成注射。所有手术器械均在使用前在75%医用酒精中浸泡30 min以上。
1.2 建立小鼠肿瘤骨转移模型将C57BL/6J小鼠分为4组,每组15只,分别经股动脉和髂外动脉途径注射生理盐水和RM-1细胞悬液,比较两种不同注射方式所需时间、小鼠存活率,注射21天后将下肢骨HE切片,显微镜下观察并比较两种方法建立骨转移模型的成瘤率;BALB/c雌鼠15只,经股动脉注射4T1-luc细胞,后期使用活体成像检测骨转移特异性。给予小鼠腹腔注射60~80 μL 2%戊巴比妥钠溶液,待麻醉成功后,将小鼠四肢伸展,固定于操作板上。腿部备皮后,暴露约4 cm2手术区域。消毒后,用无菌洞巾覆盖(图 1A)。在腹股沟下1cm处由下向上纵行剪开皮肤,用剪刀将皮下筋膜和脂肪钝性分离,充分暴露股动脉和股静脉。股动脉位于股静脉外侧,颜色较浅,在解剖镜下可观察到股动脉搏动(图 1B)。用注射器将细胞悬液吹打混匀后,吸取100 μL,连接31G针头,排空注射器内的空气。用弯血管钳夹闭近心端动、静脉及周围组织(图 1C),在解剖镜下,由近心端向远心端方向,向股动脉中注射细胞悬液(图 1D)。注射完毕后,拔出注射器,在针眼部位贴附小块医用吸收性明胶海绵(图 1E),松开血管钳,使用棉签压迫止血3~5 min,待止血成功后将明胶海绵小心揭开(图 1F)。使用75%医用酒精冲洗血管周围组织以杀死渗出液中的肿瘤细胞,用棉签吸干酒精。注射完成后,将脏器复位,缝合腹壁和皮肤,对皮肤创口进行酒精消毒(图 1G)。髂外动脉注射参考Wang [7]等报道的方法。髂外动脉和股动脉位置关系见示意图。在暴露股动静脉后逆行探寻,打开腹壁找到髂外动脉(图 1H)。
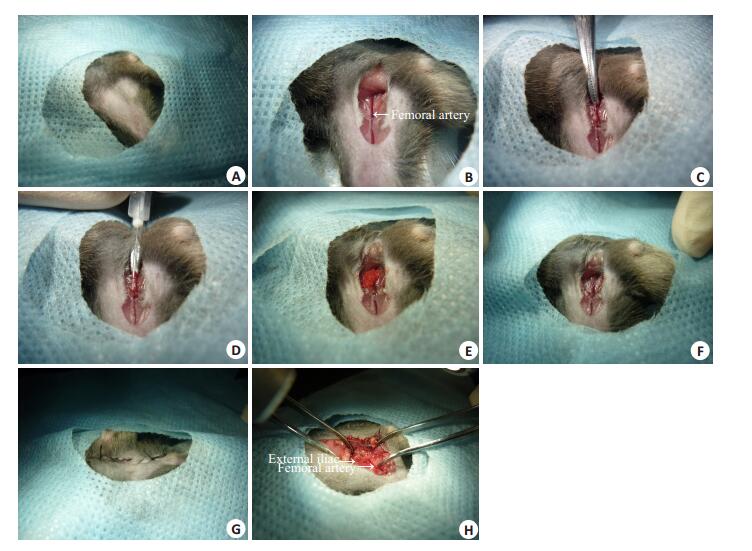
|
图 1 建立肿瘤骨转移动物模型的流程 Figure 1 Procedures for establishing mouse models of bone metastasis of cancer. A: Exposure of skin; B: Open the skin to expose the blood vessels; C: Block femoral artery and vein; D: Inject tumor cells into femoral artery; E: Use gelatin sponge to stop bleeding; F: Stop the bleeding; G: Sew up the incision; H: Exposed area of external iliac artery injection. |
(1) 活体成像:在注射两2后,通过活体成像技术,观察是否已形成肿瘤骨转移,观察其他器官和组织中是否有转移;(2) 骨病理组织学检测:将注射侧腿骨切片并HE染色,在光镜下观察是否有肿瘤骨转移病灶;(3) 大体观察:对小鼠进行尸检,观察肝、肺、肾脏等器官是否有明显转移灶。
1.4 统计学处理采用两独立样本均数比较的t检验方法,使用SPSS18.0软件对两种注射方法的止血时间和手术时间进行处理;采用定量生存资料的非参数统计分析,对两组小鼠存活率进行比较,使用SAS9.13软件处理,使用graph prism5.01绘图。P<0.05为差异有统计意义。
2 结果 2.1 活体成像分析在注射2周后,对BALB/c雌鼠进行麻醉,腹腔注射D-luciferin(4.5 mg/25 g;事先溶于150 μL生理盐水中),2 min后进行活体成像。观察可见注射侧腿部有明显的荧光信号,其他组织和器官未见肿瘤转移(图 2A)。将注射侧腿骨和对侧腿骨取出后再次成像,注射侧腿骨中可见明显的荧光信号,而对侧腿骨呈阴性(图 2B)。
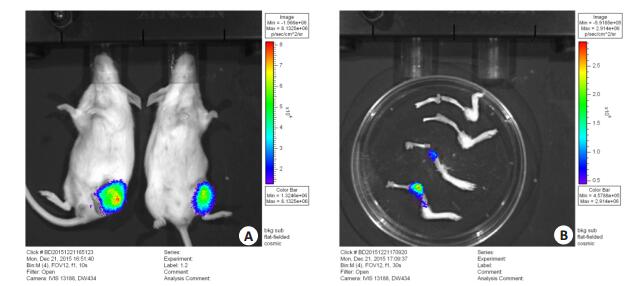
|
图 2 活体成像图 Figure 2 In vivo imaging of the tumor-nearing mice. A: In vivo imaging of BALB/c mice; B: Imaging of the femurs and tibias. |
在注射后21 d,将小鼠麻醉后处死,完整地取出注射侧腿骨,将腿骨表面软组织去除,在中性固定液中浸泡24 h,在10% EDTA脱钙液中脱钙14 d后,行石蜡包埋、切片及HE染色。镜下可见股动脉注射4T1-luc细胞的BALB/c小鼠和股动脉、髂外动脉注射RM-1细胞的C57BL/6J小鼠注射侧腿骨骨髓腔中均有明显的肿瘤转移灶(图 3)。对小鼠进行尸检,其肝、肺、肾等脏器中未见明显转移灶。
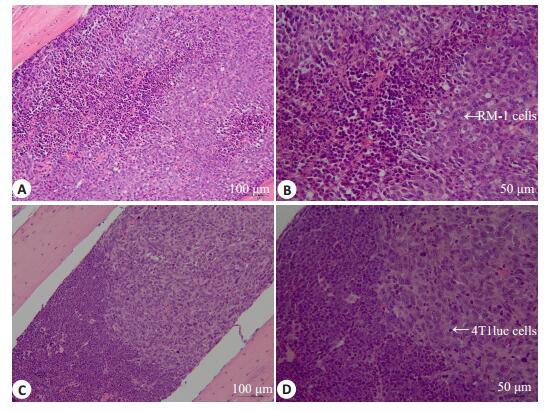
|
图 3 股动脉注射肿瘤细胞后腿骨切片 Figure 3 HE staining of the bone slices of the mice after intraarterial injection of tumor cells. A: Femoral artery injection of RM-1 cells (HE staining, original magnification: × 200); B: Femoral artery injection of RM-1 cells (HE staining, ×200); C: Femoral artery injection of 4T1 luc cells (HE staining, ×200); D: Femoral artery injection of RM-1 cells (HE staining, ×200). |
采用相同术式注射生理盐水和肿瘤细胞悬液对止血时间、手术时间和术后小鼠生存率无明显影响(表 1)。通过对止血时间、手术时间进行比较,股动脉注射肿瘤细胞悬液组止血时间为2.53±1.75 min,髂外动脉注射细胞悬液组止血时间为4.70±1.63 min (P<0.05);股动脉注射法手术时间为14.67±2.16 min,髂外动脉注射法手术时间为22.47 ± 3.50 min(P<0.05)。截止术后14 d,股动脉注射组死亡1只,髂外动脉注射组死亡5只,存活率分别为93.3% (14/15) 和66.7%(10/15),有统计学差异(P<0.05)。注射21 d后,两组小鼠腿骨中均有肿瘤转移,转移成功率均为100% (14/14和10/10)。
| 表 1 经股动脉和髂外动脉途径注射生理盐水和RM-1细胞悬液手术时间、止血时间及生存率的比较 Table 1 Comparison of operating time, hemostasis time and survival rate among the mice with RM-1 cell or saline injections via the femoral artery or the external iliac artery |
在世界范围内男性所有恶性肿瘤中,前列腺癌发病率高居第2位[8-9]。自2008年以来,我国男性前列腺癌发病率逐年升高,已成为男性泌尿系统发病率最高的肿瘤[10]。前列腺癌发展过程中,65%~75%的患者将发生骨转移[11],而死于前列腺癌的患者中,85%~100%存在骨转移[12-13]。乳腺癌在女性中的发病率亦逐年升高,73%乳腺癌晚期患者有骨转移征象[1, 14],其中75%的患者有严重的骨痛和病理性骨折[15]。
骨转移机制复杂、治疗难度大,研究其作用机理、探索预防和治疗的方法,是肿瘤研究领域的重要课题,建立一种特异高效的肿瘤骨转移模型,是相关研究开展的重要需求[16]。目前常用的骨转移模型不同程度存在操作难度大、转移特异性不高、动物术后生存率低等不足,且不符合肿瘤骨转移的病理生理学过程。左心室注射是将肿瘤细胞悬浮液注入左心室,通过血液循环将细胞运输至各器官和骨骼[17-18]。通过此种方法,肿瘤细胞容易种植在脑、肺等组织器官,骨转移特异性差,而且在操作过程中不易准确地刺中左心室;注射后不易彻底止血、容易形成血栓,小鼠死亡率高[7]。胫骨注射是在小鼠胫骨平台处沿胫骨方向穿刺,待感受到突破感后,将肿瘤细胞悬浮液注入骨髓腔中,此方法可以使肿瘤特异性地种植于骨髓腔中[19-20]。而肿瘤骨转移是肿瘤细胞通过血液循环定植于骨髓腔中,胫骨注射无法模拟肿瘤骨转移的病理生理学过程。原位注射是将肿瘤细胞接种至肿瘤原发部位,如将乳腺癌或前列腺癌细胞接种于乳腺脂肪垫或前列腺[21-22],此种方法因接种部位不同,手术难度亦不同,且此种方法更易产生肿瘤的软组织转移,骨转移效率低[18]。经尾静脉注射肿瘤细胞,主要转移至肺脏[23]。下腔静脉注射是将肿瘤细胞直接注入下腔静脉从而形成椎骨转移的方法[24]。下腔静脉分离暴露比较容易、操作简单,缺点是骨骼转移较少,且对小鼠创伤大。皮下接种是将肿瘤细胞或瘤块接种到动物皮下形成肿瘤的方法,这类方法操作简单且极易成瘤,但很难发生转移[25],目前此方法多用于评价抗肿瘤药物作用的研究。
本研究中,经股动脉注射建立骨转移模型,不仅可较好地模拟肿瘤骨转移的病理生理学过程,且具有骨转移特异性,成功率较高。采用股动脉注射技术,可以在较细的动脉段进行注射,同时可避免打开腹腔,因而可有效地减少出血量,降低感染的风险。通过研究发现,不论采取股动脉途径还是髂外动脉注射途径,注射生理盐水或肿瘤细胞悬液对手术操作时间、术后存活率和成瘤率没有明显影响,而两种术式之间存在明显差异。与髂外动脉注射相比,股动脉注射具有止血快、手术时间短、创伤小、不易感染、存活率高等优点。本研究中,动物死亡多发生于注射后5 d内,可能与失血过多、手术创伤和继发感染有关。
综上所述,本研究通过股动脉注射肿瘤细胞,成功地建立了小鼠前列腺癌和乳腺癌骨转移模型。该模型符合肿瘤骨转移的病理生理学过程,且操作简便、骨转移特异性及小鼠存活率高。此方法的建立为深入探索前列腺癌及乳腺癌骨转移的分子机制和治疗药物的研究提供了有效的工具。
| [1] | Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity[J]. Clin Cancer Res, 2006, 12(20 Pt 2): 6243s-9s. |
| [2] | Simmons JK, Hildreth BE, Supsavhad W, et al. Animal models of bone metastasis[J]. Cancer, 2015, 52(5): 827-41. |
| [3] | Macedo F, Ladeira K, Pinho F, et al. Bone metastases: An overview[J]. Oncol Rev, 2017, 11(1): 321. |
| [4] | Martine LC, Holzapfel BM, McGovern JA, et al. Engineering a humanized bone organ model in mice to study bone metastases[J]. Nat Protoc, 2017, 12(4): 639-663. DOI: 10.1038/nprot.2017.002. |
| [5] | Rosol TJ. Pathogenesis of bone metastases: role of tumor-related proteins[J]. J Bone Miner Res, 2000, 15(5): 844-50. |
| [6] | Santini D, Galluzzo S, Zoccoli A, et al. New molecular targets in bone metastases[J]. Cancer Treat Rev, 2010, 36(Suppl 3): S6-S10. |
| [7] | Wang H, Yu C, Gao X, et al. The osteogenic niche promotes early-stage bone colonization of disseminated breast cancer cells[J]. Cancer Cell, 2015, 27(2): 193-210. DOI: 10.1016/j.ccell.2014.11.017. |
| [8] | Center MM, Jemal A, Lortet-Tieulent J, et al. International variation in prostate cancer incidence and mortality rates[J]. Eur Urol, 2012, 61(6): 1079-92. DOI: 10.1016/j.eururo.2012.02.054. |
| [9] | Global Burden of Disease Cancer C, Fitzmaurice C, Allen C, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: A systematic analysis for the global burden of disease study[J]. JAMA Oncol, 2017, 3(4): 524-48. DOI: 10.1001/jamaoncol.2016.5688. |
| [10] | 鲍萍萍, 彭龚. 中国2008年前列腺癌发病、死亡和患病情况的估计及预测[J]. 中华流行病学杂志, 2012, 33: 1056-9. DOI: 10.3760/cma.j.issn.0254-6450.2012.10.014. |
| [11] | Waldman C. Skeletal complications of malignancy V[J]. Cancer, 2008, 25(1): 1-3. |
| [12] | Carlin BI, Andriole GL. The natural history, skeletal complications, and management of bone metastases in patients with prostate carcinoma[J]. Cancer, 2000, 88(12 Suppl): 2989-94. |
| [13] | Feldman AS, Meyer CP, Sanchez A, et al. Morbidity and mortality of locally advanced prostate cancer: A population-based analysis comparing radical prostatectomy versus external beam radiation[J]. J Urol, 2017, S0022-5347(17): 74504-1. |
| [14] | Plunkett TA, Smith P, Rubens RD. Risk of complications from bone metastases in breast cancer. implications for management[J]. Eur J Cancer, 2000, 36(4): 476-82. DOI: 10.1016/S0959-8049(99)00331-7. |
| [15] | Ibrahim T, Mercatali L, Amadori D. A new emergency in oncology: Bone metastases in breast cancer patients (Review)[J]. Oncol Lett, 2013, 6(2): 306-10. |
| [16] | Rea D, Del Vecchio V, Palma G, et al. Mouse models in prostate cancer translational research: From xenograft to pdx[J]. Biomed Res Int, 2016: 9750795. |
| [17] | Kang Y. Analysis of cancer stem cell metastasis in xenograft animal models[J]. Methods Mol Biol, 2009, 568: 7-19. DOI: 10.1007/978-1-59745-280-9. |
| [18] | Simmons JK, Hildreth BE, Supsavhad W, et al. Animal models of bone metastasis[J]. Vet Pathol, 2015, 52(5): 827-41. DOI: 10.1177/0300985815586223. |
| [19] | Corey E, Quinn JE, Bladou F, et al. Establishment and characterization of osseous prostate cancer models: intra-tibial injection of human prostate cancer cells[J]. Prostate, 2002, 52(1): 20-33. DOI: 10.1002/(ISSN)1097-0045. |
| [20] | 孟越, 李春雨, 郝松, 等. 肺癌骨转移小鼠模型的建立[J]. 南方医科大学学报, 2014, 34(5): 664-8. |
| [21] | Zhang Y, Toneri M, Ma H, et al. Real-Time GFP intravital imaging of the differences in cellular and angiogenic behavior of subcutaneous and orthotopic Nude-Mouse models of human PC-3 prostate cancer[J]. J Cell Biochem, 2016, 117(11): 2546-51. DOI: 10.1002/jcb.v117.11. |
| [22] | Zhang Y, Wang X, Hoffman RM, et al. Real time metastatic route tracking of orthotopic PC-3-GFP human prostate cancer using intravital imaging[J]. J Cell Biochem, 2016, 117(4): 1027-32. DOI: 10.1002/jcb.25391. |
| [23] | Elkin M, Vlodavsky I. Tail vein assay of cancer metastasis[J]. Curr Protoc Cell Biol, 2001, Chapter(19): Unit 19.2. |
| [24] | 崔明星, 詹新立, 刘会江, 等. 人前列腺癌PC-3细胞的荧光标记及其脊椎转移动物模型的建立[J]. 南方医科大学学报, 2013, 33(2): 243-8. |
| [25] | Hoffman RM. Patient-derived orthotopic xenografts: better mimic of metastasis than subcutaneous xenografts[J]. Nat Rev Cancer, 2015, 15(8): 451-2. DOI: 10.1038/nrc3972. |
 2017, Vol. 37
2017, Vol. 37
